Des traces de gadolinium peuvent être détectées dans les tissus après des applications multiples par des méthodes chimiques modernes, même sur une longue période, mais sans pertinence clinique ni séquelles associées. Néanmoins, des restrictions ont récemment été décidées pour certains produits à base de gadolinium au sein de l’UE.
Introduits en clinique en 1989, les composés de gadolinium comme agents de contraste (Gd-KM) ont rapidement triomphé grâce au potentiel de l’imagerie par résonance magnétique (IRM), mais aussi grâce à leur bonne tolérance, notamment par rapport aux agents de contraste du scanner. Au début, les composés de gadolinium étaient appréciés pour réduire les longues durées d’examen, mais ils ont été utilisés de plus en plus largement et à des doses croissantes pour la pondération du contraste T1 sur l’IRM. Le gadolinium raccourcit et catalyse le temps de relaxation T1 des protons qui gravitent autour de l’atome dans l’environnement proche, augmentant ainsi ce que l’on appelle le signal T1. Cela permet de mieux détecter et caractériser certaines lésions. Initialement utilisé uniquement pour les questions relatives au SNC afin de faciliter la détection des pathologies, leur caractérisation et le suivi de la réponse au traitement (“treatment response”), son champ d’application s’est étendu aux questions cliniques concernant pratiquement tout le corps [1,2]. On pensait alors que les MR KM contenant du gadolinium seraient rapidement et complètement éliminés par l’organisme.
Indications pour l’utilisation du Gd-KM
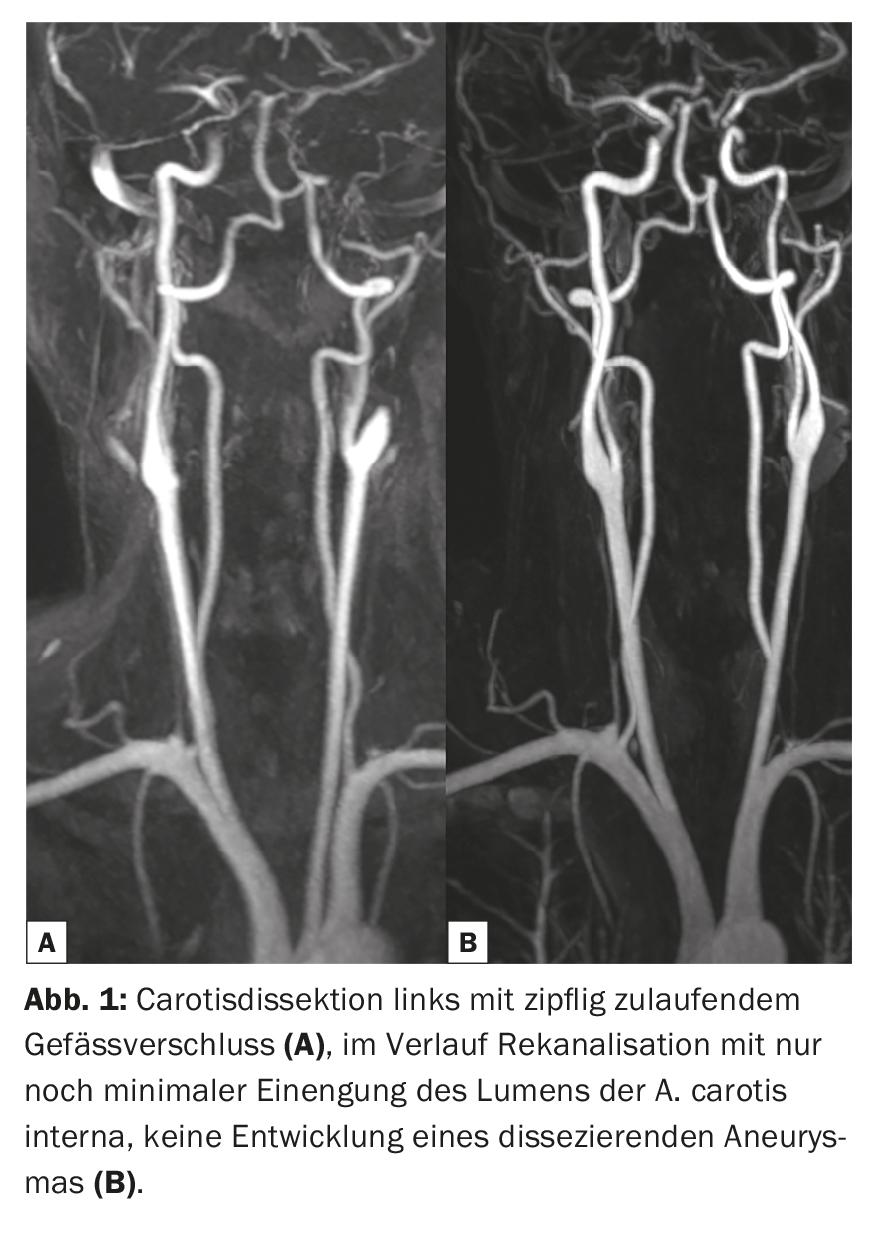
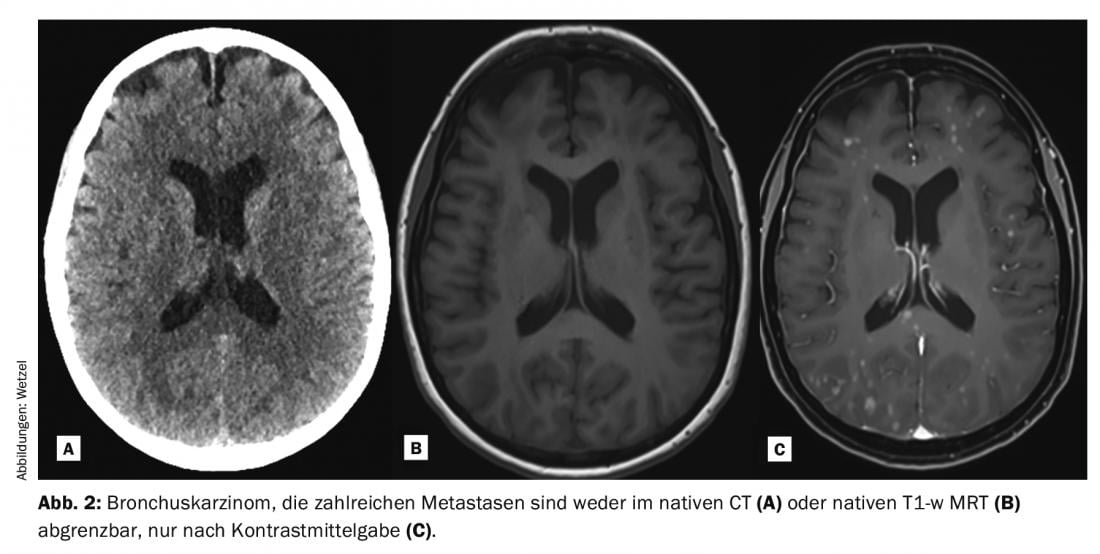
Dans la pratique clinique quotidienne, des séquences d’impulsions amplifiées par Gd-KM pondérées en T1 sont souvent mesurées après les examens natifs et converties en images. Cela se fait dans tout le corps en fonction de la question posée, même si certaines pathologies sont plus susceptibles que d’autres de recourir au Gd-KM. Grâce à l’augmentation du signal T1 des protons (plus riche en signal) dans les lésions contrastées après Gd-KM, celles-ci peuvent souvent être mieux détectées et délimitées par rapport aux tissus environnants. Pour que le signal se modifie, il faut une pondération T1, une dose correcte et des propriétés cinétiques spécifiques, en particulier au niveau du SNC avec le passage de la barrière hémato-encéphalique perturbée. Les indications typiques pour lesquelles une injection de Gd-KM est administrée pour évaluer le parenchyme cérébral sont l’examen de maladies tumorales, la sclérose en plaques, les maladies inflammatoires et les pathologies vasculaires (Fig. 1-3). Malgré les énormes progrès techniques, il existe de nombreuses pathologies et lésions qui, aujourd’hui encore, ne peuvent être visualisées que grâce à l’administration de produits de contraste. Ainsi, les Gd-KM sont souvent utilisés simplement pour exclure une pathologie [3]. Une autre indication importante de Gd-KM est la visualisation classique des zones de circulation vasculaire, généralement la zone artérielle. L’IRM et le Gd-KM ont rendu possible la visualisation non irradiante des rétrécissements, des obstructions ou des pontages vasculaires.
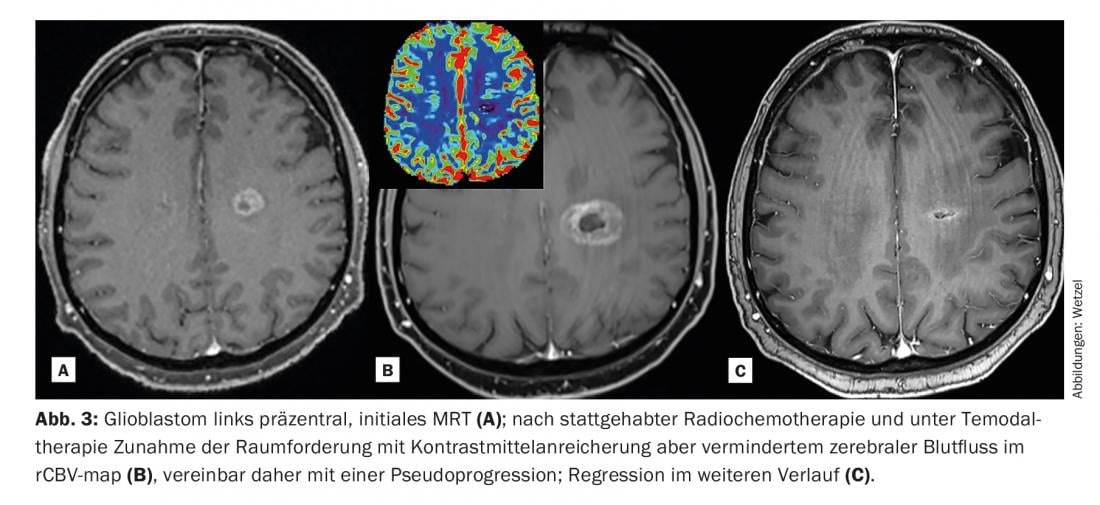
L’analyse de la perfusion RM constitue un autre domaine récent de l’application de la MC. Dans le cas des tumeurs, on observe souvent un contraste accru entre la tumeur et les tissus environnants en raison d’une vascularisation accrue, appelée néoangiogenèse, et d’une fuite vasculaire plus prononcée, appelée “perméabilité vasculaire” accrue (fuite). L’afflux de produit de contraste dans les foyers tumoraux, les inflammations ou les infections se fait souvent avec des courbes d’afflux et de lavage caractéristiques, et permet souvent d’interpréter une question clinique qui resterait obscure sans produit de contraste.
La caractérisation de la perfusion des foyers suspects se fait aujourd’hui de plus en plus à l’aide de modèles pharmacocinétiques. Outre l’amélioration de la détection, le contraste corrélé au flux sanguin permet de mieux caractériser la progression d’un foyer tumoral et son agressivité. Les schémas de perfusion typiques peuvent être décomposés de manière très spécifique à l’aide d’images codées en couleur et codées pixel par pixel en fonction de l’emplacement.
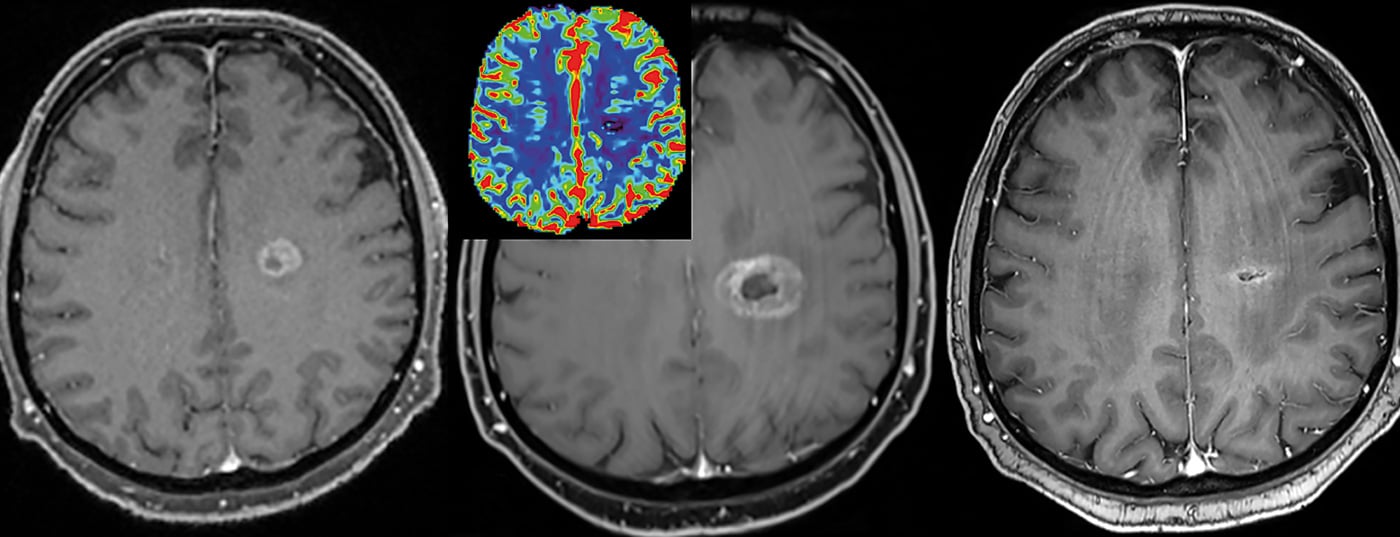
Cela permet de mieux appréhender et différencier l’hétérogénéité d’une tumeur [2]. Cela a à son tour des conséquences sur la suite du traitement et sur le suivi de la thérapie (en particulier aussi pour la radiothérapie). Les lésions peuvent ainsi être relativement bien suivies dans le temps, et notamment caractérisées et surveillées au moyen de points de repère quantitatifs.
Caractéristiques de Gd-KM
Le gadolinium est utilisé grâce à son activité “super single” – c’est le seul élément en solution qui présente sept spins électroniques individuels (singles) qui interagissent idéalement avec les protons d’eau dans les tissus. Les solutions de gadolinium présentent ainsi une propriété paramagnétique marquée. C’est l’échange d’énergie entre les électrons du gadolinium sur ses couches de valence externes et les protons excités par le signal RM qui permet d’améliorer le contraste sur l’image T1. Des temps T1 plus courts permettent donc d’obtenir un signal plus important et des motifs de contraste plus sélectifs partout où le produit de contraste est distribué. Même si l’on parle de manière simplifiée du gadolinium comme agent de contraste RM, il faut souligner que ce sont en fait des complexes de gadolinium qui sont utilisés en clinique comme agent de contraste RM (= Gd-KM). Ils sont constitués de l’atome central (Gd3+) ainsi que des chélateurs ou ligands qui l’enveloppent. Les chélateurs ou ligands lient le gadolinium de manière extrêmement forte, ce qui crée une liaison complexe. Les principes actifs sont dissous sous forme de solutions de gadolinium standardisées (Gd-KM), qui peuvent généralement être injectées par voie intraveineuse ou diluées par voie intra-articulaire. Ils présentent une concentration plus faible que les agents de contraste pour scanner et donc une exposition systémique plus faible (environ 0,01 mole pour le Gd-KM contre 0,1 mole avec les agents de contraste pour rayons X).
Les complexes de gadolinium sont très solubles dans l’eau, se distribuent au niveau vasculaire et interstitiel avec une demi-vie de distribution d’environ deux à cinq minutes et, s’ils sont néphrotrophes, sont éliminés par filtration glomérulaire rénale sous forme inchangée avec une demi-vie d’élimination d’environ 90 min. De faibles quantités de Gd-KM traversent la barrière placentaire ou peuvent également être détectées dans le lait maternel. Les MRKM spécifiques au foie ont une cinétique associée aux récepteurs, avec une captation sélective par les hépatocytes et une excrétion dans les voies biliaires, en plus de l’élimination rénale qui se produit en parallèle. Le passage hépatique résulte de groupes latéraux spécifiques aux récepteurs anioniques qui ont été liés aux ligands.
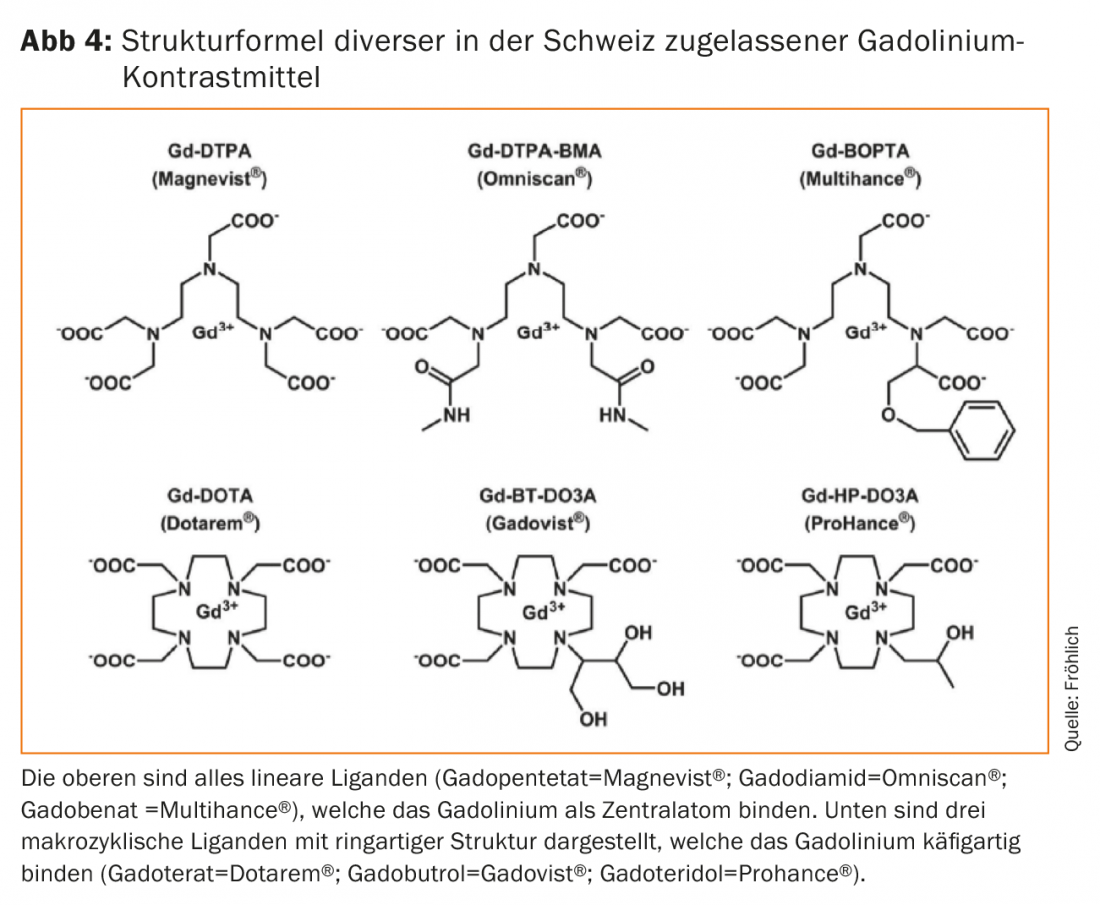
Les ligands qui fixent le gadolinium de manière thermodynamique se présentent soit sous forme de structure cyclique et annulaire, appelée macrocycle, soit sous forme de chaîne, appelée ligand linéaire (Fig. 4). Les macrocycles se révèlent nettement plus stables du point de vue thermodynamique, bien que l’importance clinique de cette propriété n’ait été reconnue que plus tard. Si le gadolinium se dissocie du complexe, il précipite dans le plasma sous forme d’hydroxyde ou de phosphate, s’accumule dans le foie, la rate et les macrophages et interagit avec de nombreux métabolismes dépendants du calcium (coagulation sanguine, respiration mitochondriale, renouvellement osseux) en tant que bloqueur du calcium. L’évaluation des conséquences de la toxicité est encore compliquée par les interactions avec les électrolytes de l’organisme comme le zinc, le fer, le cuivre ou encore le calcium. L’objectif est donc clair, il faut empêcher par tous les moyens la libération du gadolinium de la liaison complexe [5].
Fibrose systémique néphrogénique [6]
Le gadolinium a connu un premier revers en 2006, lorsque le jeune néphrologue Thomas Grobner de la clinique régionale de Wiener Neustadt a observé pour la première fois un lien entre l’administration de gadolinium à cinq de ses patients dialysés et leur nette aggravation d’une mystérieuse maladie de la peau jusqu’alors inexpliquée (dermopathie fibrogénique néphrogénique) [7]. Cette maladie mystérieuse est apparue pour la première fois en 1997 dans certaines villes américaines sous forme de cluster et n’a été publiée qu’en 2000 dans “The Lancet” [8]. Trois ans plus tard seulement, la maladie a été rebaptisée “fibrose systémique néphrogénique (FSN)” en raison d’une fibrose systémique létale chez certains patients et de la cicatrisation interne correspondante (activation des fibrocytes) [9]. Ce n’est qu’en 2011 que la maladie a été clairement définie et circonscrite, tant sur le plan histopathologique que clinique [10]. De nombreuses séries de cas ont suivi, augmentant la peur de la NSF et les spéculations sur son déclenchement. Les hypothèses allaient d’un problème de dialyse (bien que toutes les personnes concernées ne fussent pas dialysées) à des agents infectieux. Même le registre de plus de 300 cas géré par Cowper à Yale n’a pas pu fournir d’explication plausible pour la NSF. Ce n’est que Grobner et, un peu plus tard, le groupe de Copenhague autour de Henrik Thomsen qui ont partiellement éclairci le mystère. Apparemment, le Gd-KM a circulé chez les insuffisants rénaux jusqu’à ce que, dans certains cas, en particulier pour les composés complexes instables, il se dissocie et se libère dans les tissus. Chez certains patients, cela a entraîné une intoxication de type corps étranger, très douloureuse, avec une mobilisation et une prolifération importantes de fibrocytes tissulaires, la détection de cellules CD34 positives, des taux élevés de procollagène de type I, plus souvent associés à des complications en cas de postopératoire ou de prédisposition inflammatoire [11]. Peu de temps après, des contractures et des atteintes musculaires importantes sont apparues en périphérie, mais aussi de manière isolée dans le tronc, avec d’autres complications. Malgré l’utilisation de différentes thérapies, les patients n’ont pu être traités avec succès que dans quelques cas.
Les autorités de contrôle des médicaments, d’abord la FDA américaine en juin 2006, puis Swissmedic un peu plus tard, ont réagi de manière déterminée et extrêmement rapide. Ils ont demandé que l’IRM à contraste renforcé soit soigneusement évaluée chez les patients souffrant d’insuffisance rénale sévère, que la dose la plus faible possible soit utilisée et que les symptômes cliniques d’alarme soient pris en compte. Plus tard, en février 2007, l’EMA européenne a suivi avec des contre-indications pour deux agents de contraste au gadolinium linéaires et instables en cas d’insuffisance rénale préexistante (eGFR<30ml/min/1,73m2). Les précautions définies en 2007, puis en 2011, soulignent explicitement les avantages du gadolinium lors d’un examen IRM indiqué. Afin de prévenir d’autres cas de NSF, les patients dont la fonction rénale est réduite et qui ont donc des temps de circulation plus longs ont été mieux protégés. Les produits de contraste linéaires, instables et sans élimination hépatique ne devaient pratiquement plus être utilisés en cas d’insuffisance rénale, sinon les doses étaient limitées autant que possible et, si nécessaire, les préparations macrocycliques de gadolinium n’étaient utilisées qu’après une évaluation soigneuse du rapport bénéfice/risque. Ces recommandations étaient basées d’une part sur des données épidémiologiques montrant un nombre relatif de cas de NSF plus élevé avec les MRKM linéaires gadodiamide, gadoversetamide et gadopentétate, mais aussi sur de nombreuses études précliniques démontrant les différences de stabilité et les conséquences. Les macrocycles ont ainsi acquis un statut de patient à risque, en particulier chez les patients présentant une insuffisance rénale préexistante connue. Le gadotérate, qui a été utilisé de manière prospective chez plusieurs centaines de patients dialysés en France sans entraîner de FNS, était considéré comme relativement sûr.
Dépôts de gadolinium dans le cerveau
Dès 2010, grâce aux mesures prises en plusieurs étapes, à la limitation des doses, à une plus grande retenue et au passage progressif aux MRKM macrocycliques, il n’y a plus eu de nouveaux cas de FNS, ce qui a permis à tout le monde de respirer. [12] jusqu’à ce que fin 2014, dans la revue Radiology, des chercheurs japonais dirigés par Tomonori Kanda trouvent, cette fois chez des personnes en bonne santé rénale, une corrélation dans certaines zones du cerveau entre le nombre d’examens IRM répétés avec des complexes de gadolinium et des intensités de signal plus élevées dans l’image T1 [13]. Cela concernait surtout le nucleus dentatus ainsi que le globus pallidus dès les images natives, des modifications visibles du signal n’étant généralement décrites qu’après cinq ou six examens suite à l’administration de préparations de gadolinium plutôt instables et linéaires. Par la suite, des phénomènes similaires ont pu être mesurés dans d’autres structures du SNC [14]. La spécificité de l’effet a été remise en question étant donné que des motifs de contraste similaires ont été décrits dans le cas de diverses intoxications aux métaux, de la sclérose en plaques ou encore après une irradiation. Peu après, en 2015, McDonald a pu démontrer que les signaux élevés dans le noyau denté de ses patients étaient en fait des dépôts de gadolinium [15]. Le gadolinium a pu être détecté et localisé chimiquement. Il est souvent apparu dans la zone périvasculaire, mais parfois aussi dans des zones tissulaires plus distales. Il est important de souligner que la forme sous laquelle le gadolinium était stocké dans les tissus était loin d’être claire. Il reste donc à savoir si le gadolinium, sous forme dissociée libre, était éventuellement lié à des phosphates ou des hydroxydes ou s’il continuait à être lié de manière complexe dans les tissus.
De nombreuses séries de cas rétrospectives ont suivi, qui ont montré, comme Kanda, des différences de signal significatives entre les complexes linéaires instables et les préparations de gadolinium macrocycliques plus stables. Les préparations de gadolinium macrocycliques n’ont pas entraîné de modifications mesurables du signal dans la plupart des cas (même après plusieurs utilisations répétées), tandis que les préparations plus instables ont pratiquement toujours entraîné une augmentation du signal mesurable de manière significative à l’IRM en fonction du nombre de doses de Gd-KM administrées. En fait, des études menées sur des animaux au début des années 1990 avaient déjà mis en évidence de telles différences dans l’élimination des complexes de gadolinium des différents tissus, mais on avait toujours pensé que cela n’avait que peu d’importance dans la pratique. Les nouvelles données montrant des modifications de signal (ou des résidus) apparemment visibles à long terme ont inquiété, même si aucune maladie ou pathologie visible n’a pu être attribuée à ces modifications de signal. La modification récente du signal T1 dans les tissus du SNC est donc très différente de l’intoxication associée au gadolinium, appelée NSF. D’autant plus que les effets à long terme ne sont pas clairs, l’EMA a ordonné fin 2017 l’arrêt de la commercialisation en Europe de tous les composés linéaires de gadolinium qui ne sont pas spécifiques au foie [16]. Les produits de contraste pour l’arthrographie directe par RM (gadopentétate ; Magnevist® 2.0 avec 0,002 mole de Gd/Lit) restent des exceptions, à côté du gadotérate macrocyclique (Artirem® avec 0,0025 mole de Gd/Lit). Les deux sont injectés directement dans les diverses articulations à très faible dose et concentration et sont utilisés en clinique. De même, les Gd-KM linéaires spécifiques au foie, comme le gadobénate (Multihance®) ou le gadoxétate (Primovist®), restent sur le marché. Les MR-KM macrocycliques gadoterate (Dotarem®), gadobutrol (Gadovist®) ou gadoteridol (Prohance®) peuvent continuer à être utilisés à des fins diagnostiques à la dose la plus faible possible grâce à leur stabilité de complexe. Le gadolinium, atome central potentiellement toxique, peut être mieux capturé en entropie et aussi cinétiquement grâce à la structure cyclique de ces ligands.
Compte tenu de l’incertitude quant à la pertinence clinique des modifications du signal T1 dans diverses structures du SNC, plus tard également avec des dépôts de gadolinium démontrés dans d’autres tissus (os, reins, réticulo-endothéliaux) [17,18], de nombreuses nouvelles questions se sont posées autour du gadolinium. Comment traverse-t-il la barrière hémato-encéphalique pour atteindre les deux zones du cerveau mentionnées ci-dessus ? Est-il lentement éliminé de là ? Peut-il s’y dissocier lentement et être libéré ? Peut-il y avoir localement des conséquences de type NSF ? Qu’en est-il des dépôts dans les autres tissus du corps ? Comment les macrocycles se comportent-ils par rapport aux MC linéaires ? Outre les observations aiguës, y a-t-il des conséquences à long terme qui ne peuvent pas encore être correctement évaluées ?
Ainsi, outre le profil de tolérance aiguë des préparations à base de gadolinium qui, comme la plupart des produits de contraste, peuvent entraîner des réactions d’hypersensibilité (allergiques, de type allergique) ou, à des doses plus élevées, une néphropathie induite par le KM, les questions relatives à la tolérance subchronique et chronique du Gd-KM ont pris de l’importance. En fin de compte, les experts ne peuvent pas totalement exclure un certain risque de symptômes d’intoxication chroniques ou tardifs en cas de séjour prolongé ou de résidus même faibles, même s’il n’existe aucun signe en ce sens, et ce malgré des centaines de millions d’applications de Gd-KM au total.
Et plus encore ?
De manière pas tout à fait inattendue, puisque l’imagerie RM inclut pratiquement toutes les pathologies, d’autres effets indésirables médicamenteux (EIM), parfois inexpliqués, ont été associés à l’administration de Gd-KM. Il n’était pas toujours évident de savoir si l’examen IRM ou le produit de contraste administré était responsable des symptômes observés. En particulier, les deux experts Semelka (Durham) et Ramalho ont été les premiers à postuler l’existence d’une “maladie de dépôt de gadolinium”, qu’ils ont trouvée dans de rares cas et sans lien de causalité clair chez leurs patients RM, même avec une fonction rénale tout à fait normale [19]. Les manifestations cliniques typiques incluent toute une série de maux de tête, de douleurs osseuses ou articulaires persistantes non spécifiques. Cela s’accompagne parfois d’une hypertrophie des tissus mous sous-cutanés, d’un épaississement, de douleurs périphériques dans les bras et les jambes, décrites comme des brûlures ou des coupures. Ces effets sont parfois apparus après une seule application de gadolinium et à des intervalles de temps variables (de quelques jours à quelques mois) après l’examen RM et n’ont pas pu être attribués à d’autres maladies. Parfois, le gadolinium a pu être analysé dans le plasma, l’urine ou même dans des échantillons de tissus des patients. Une certaine prédisposition génétique avec une sensibilité accrue a été discutée. Alternativement, l’éventuelle pollution de l’environnement par des traces de gadolinium, y compris dans les eaux usées et donc dans la chaîne alimentaire, a fait l’objet d’un intérêt croissant, avec des demandes d’amélioration de l’épuration des eaux usées autour des hôpitaux ou des examens de RM. Bien que de nombreux mécanismes toxiques et interactions du gadolinium avec les fonctions de l’organisme aient été décrits, qui pourraient jouer un rôle en particulier dans le domaine de la toxicité dirigée par les cytokines et les chimiokines, des effets des canaux calciques, des générateurs de radicaux oxygénés réactifs ou dans le domaine du MMPS, ainsi que de la neurotoxicité, un lien de causalité clair fait défaut.
Les quantités de traces de gadolinium parfois encore détectables après des mois, voire des années, dans les tissus du SNC mais aussi dans le reste de l’organisme, avec des quantités plus élevées selon les complexes linéaires de Gd, conduisent à se demander comment une telle cinétique peut s’expliquer. Grâce à une collaboration de recherche intensive entre la médecine légale de l’Université de Zurich et le service de radiologie de l’Hôpital cantonal de Baden, ils ont été l’un des premiers groupes de recherche à démontrer cliniquement que le gadolinium injecté est également détectable en faible quantité dans le liquide céphalorachidien [20]. Chez plus de 60 patients ayant subi une IRM et chez lesquels un prélèvement de liquide céphalorachidien était cliniquement indiqué, la teneur en gadolinium a pu être quantifiée par ICP-MS par rapport à un groupe témoin. De manière plutôt inattendue, tous les patients exposés au gadotérate ont donné une mesure positive correspondante, avec des différences parfois importantes selon les patients et aussi les maladies préexistantes, les appareils d’analyse utilisés étant extrêmement sensibles. Chez deux patients témoins, dont le LCR était également positif au gadolinium, il a été possible de prouver a posteriori qu’ils avaient subi un examen IRM antérieur avec du gadolinium. Pendant environ huit heures après l’injection, la concentration de gadolinium dans le LCR augmente lentement mais régulièrement, puis l’élimination est lente et prolongée sur de très longues périodes. Il en résulte une valeur de pic beaucoup plus tardive et une élimination très lente par rapport au plasma. Les mesures dans le LCR ont été effectuées à l’aide de la méthode de spectroscopie de masse ICP, très sensible et précise, mais qui ne permet pas de différencier le type de liaison chimique du gadolinium (libre ou solidement lié à un complexe). Les mesures du liquide céphalorachidien pourraient être la clé du passage du gadolinium, même si la barrière hémato-encéphalique est intacte – il est probable que ce passage se fasse par le plexus choroïde et éventuellement plus loin par la circulation glymphatique – bien que tout cela soit encore spéculatif. En fonction de la stabilité des complexes de gadolinium, il faut s’attendre à ce que le taux de dissociation, la transmétallisation et l’échange avec d’autres électrolytes, ions métalliques et phosphates/hydroxydes varient également dans le liquide céphalorachidien.
De nombreuses questions concernant l’élimination et la redistribution de ces compartiments distaux, éventuellement dans certaines zones du cerveau, restent ouvertes ; la forme sous laquelle le gadolinium reste finalement, s’il est redistribué et s’il est éventuellement éliminé lentement par les espaces périvasculaires, doivent être clarifiées. En principe, il convient de souligner que même les experts ne sont pas d’accord sur la valeur des observations susmentionnées. En particulier, l’importance de nombreux effets sub-toxiques des différentes formes de gadolinium (selon la forme de liaison et la dose), avec des conséquences précliniques ou cliniques, reste ouverte. On a ainsi décrit l’induction de nécroses et d’apoptoses dans les cellules tubulaires rénales, une cytotoxicité accrue ou encore d’autres réactions néphrotoxiques, hématotoxiques, neurotoxiques ou encore inflammatoires [21]. Alors que les autorités européennes ont catégoriquement banni du marché les préparations linéaires de gadolinium, plus instables, les autorités sanitaires américaines sont généralement plus réticentes, recommandant l’utilisation des préparations macrocycliques de Gd, plus stables, en cas d’utilisation répétée ou même en pédiatrie, mais autorisant également la poursuite de l’utilisation clinique des complexes linéaires, plus instables. Ceci en précisant qu’aucun effet néfaste n’est connu à ce jour concernant les dépôts de gadolinium, qu’aucune modification histopathologique n’a été mise en évidence et que de nombreuses questions restent en suspens concernant la cinétique. L’autorité suisse de contrôle des médicaments, Swissmedic, n’a pas encore pris de position claire.
Comme c’est souvent le cas dans la médecine moderne, nous nous sommes laissés emporter par l’enthousiasme pour cette nouvelle technique d’imagerie à faible rayonnement, avec un contraste marqué des tissus mous et un Gd-KM parfaitement toléré, sans faire preuve d’esprit critique. Il s’agit maintenant d’utiliser cliniquement les produits de contraste contenant du gadolinium de manière bien indiquée et raisonnable. L’utilisation de complexes macrocycliques de gadolinium plus stables ou de MRKM spécifiques au foie n’indique pas, à l’heure actuelle, l’existence d’une quelconque maladie secondaire associée, malgré la présence de traces et d’éventuelles augmentations du signal T1 dans divers tissus, même sur de longues périodes. Il s’agit d’une part de ne pas mal interpréter l’augmentation possible du signal sur les images natives après l’administration séquentielle de plusieurs doses de gadolinium, et d’autre part de comparer le bénéfice potentiel de l’administration de gadolinium avec le risque extrêmement faible. Les patients doivent être informés de l’utilité prédominante de l’administration d’un produit de contraste à base de gadolinium en cas d’indication clinique et pour exclure une pathologie.
Messages Take-Home
- Les Gd-KM sont généralement utilisés par voie IV à une dose de 0,1 mmol Gd/kg de poids corporel par voie IV. Les applications spéciales telles que les examens du foie ou les angiographies vasculaires nécessitent des doses plus faibles. L’arthrographie directe par RM, dans laquelle le Gd-KM est injecté par voie intra-articulaire, nécessite de très faibles doses de Gd-KM.
- Les Gd-KM doivent être utilisés à la dose la plus faible possible. En cas d’administration répétée et de risques associés, chaque administration doit être soigneusement pesée et les Gd-KM macrocycliques plus stables doivent être utilisés. Chez les patients insuffisants rénaux avec un DFGe <30 ml/min/1,73 m2, une dose unique de Gd-KM (=0,1 mmol/kg pc) au maximum peut être administrée pendant sept jours.
- Des traces de gadolinium peuvent être détectées dans les tissus après des applications multiples par des méthodes chimiques modernes (ICP-MS), même sur une longue période, mais sans pertinence clinique ni séquelles associées.
- Les propriétés spécifiques de chaque préparation de gadolinium doivent être prises en compte dans la pratique clinique quotidienne.
Littérature :
- Czeyda-Pommersheim F, Martin DR, Costello JR, Kalb B : Agents de contraste pour l’imagerie par résonance magnétique. Magn Reson Imaging Clin N Am 2017 ; 25 : 705-711.
- Yuan Jm Chow SK, Yeung DK, King AD : Une méthode de cartographie à cinq couleurs codées pour l’analyse DCE-IRM des tumeurs de la tête et du cou. Radiologie clinique 2012 ; 67 : 216-223.
- Roberts TP, Mikulis D : Neuro MR : principes. JMRI 2007 ; 26 : 823-837.
- Durmo F, et al : Caractérisation des tumeurs cérébrales à l’aide de l’évaluation multibiométrique de l’IRM. Tomoy 2018 ; 4 : 14-25.
- Port M, et al. : Efficacité, stabilité thermodynamique et cinétique des chélates de gadolinium commercialisés et leurs éventuelles conséquences cliniques : une revue critique. Biometals 2008 ; 21 : 469-490.
- Matoori S, Gutzeit A, Fröhlich JM : Fibrose systémique néphrogénique en 2015. Forum Med Suisse 2015 ; 15 : 340-344.
- Grobner T : Gadolinium – un déclencheur spécifique pour le développement de la dermopathie fibrosante néphrogénique et de la fibrose systémique néphrogénique ? Nephrol Dial Transplant 2006 ; 21 : 1104-1108.
- Cowper SE, et al : Scleromyxoedema-like cutaneous diseases in renal-dialysis patients. Lancet 2000 ; 356 : 1000-1001.
- Cowper SE : Nephrogenic fibrosing dermopathy : the first 6 years. Curr Opin Rheumatol 2003 ; 15 : 785-790.
- Girardi M, et al : Fibrose systémique néphrogénique : définition clinicopathologique et recommandations de travail. J Am Acad Dermatol 2011 ; 65 : 1095-1106.
- Grebe S, et al : L’inflammation chronique et l’athérosclérose accélérée comme cofacteurs importants dans la fibrose systémique néphrogénique suite à une exposition intraveineuse au gadolinium. Clin Exp Nephrol 2008 ; 12 : 403-406.
- Bennett Cl, et al : Fibrose systémique néphrogénique induite par le gadolinium : l’ascension et la chute d’une maladie iatrogène. Clin Kidney J 2012 ; 5 : 82-88.
- Kanda T, et al. : Haute intensité du signal dans le noyau denté et le globus pallidus sur des images RM pondérées en T1 non linéaires : relation avec l’augmentation de la dose cumulative d’un matériau de contraste à base de gadolinium. Radiology 2014 ; 270(3) : 834-841.
- Pozeg P, et al : Spatio-temporal pattern of gadolinium-related hyperintensity increase within deep brain nuclei. Congrès suisse de radiologie, Lausanne 10-12, 2018 ; SS149.
- McDonald RJ, et al : Dépôt de gadolinium intracrânien après imagerie RM contrastée. Radiology 2015 ; 275 : 772-782.
- Agence européenne des médicaments EMA. L’avis final de l’EMA confirme les restrictions sur l’utilisation d’agents à base de gadolinium linéaire dans les scanners corporels. www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/Gadolinium-containing_contrast_agents/human_referral_prac_000056.jsp (consulté le 22.5.2018).
- Murata N, Murata K, Gonzalez-Cuyar LF, Maravilla MR : Gadolinium tissue deposition in brain and bone. Magn Reson Imaging 2016 ; 34 : 1359-1365.
- McDonald RJ, et al. : Comparaison des concentrations de gadolinium dans de multiples organes de rat après administration intraveineuse de chélates de gadolinium linéaires ou macrocycliques. Radiology 2017 ; 285 : 536-545.
- Ramalho M, Ramalho J, Burke LM, Semelka RC : Rétention et toxicité du gadolinium – une mise à jour. Adv Chronic Kidney Dis 2017 ; 24 : 138-146.
- Berger F, et al. : Distribution de gadolinium dans le fluide cérébrospinal après administration d’un agent de contraste RM à base de gadolinium chez l’homme. Radiology 2018 ; https://doi.org/10.1148/radiol.2018171829.
- Rogosnitzky M, Branch S : Toxicité des agents de contraste à base de Gd : une revue des mécanismes connus et proposés. Biométaux 2016 ; 29 : 365-376.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(4) : 23-29