En cas de diagnostic confirmé d’asthme sévère, un traitement complémentaire par anticorps monoclonaux peut être envisagé. Pour ce faire, on dispose actuellement d’anticorps anti-IgE ou anti-IL5 en fonction du phénotype. Les recommandations du consensus préconisent un suivi de l’évolution et une adaptation du régime thérapeutique si nécessaire.
Christian Taube, directeur du service de pneumologie de l’hôpital universitaire d’Essen (Allemagne), a illustré, entre autres, la pertinence de la capacité de diffusion comme paramètre de diagnostic différentiel à l’aide d’une étude de cas dans le cadre du DGIM 2019 [1]. La patiente, âgée de 55 ans et n’ayant jamais fumé, a présenté une dyspnée répétée à l’effort. Le traitement précédent consistait en un stéroïde inhalé en association fixe avec un bêta-2-sympathomimétique à longue durée d’action. Au cours de l’évolution, des aggravations aiguës des symptômes sont survenues à plusieurs reprises, ce qui a nécessité un traitement par stéroïdes systémiques pour obtenir une amélioration significative. Une body-pléthysmographie a révélé les résultats suivants : trouble respiratoire obstructif, obstruction sévère et hyperinflation pulmonaire. Les examens diagnostiques supplémentaires suivants ont été effectués : Capacité de diffusion, radiographie du thorax, mesure du monoxyde d’azote dans l’air expiré, test d’allergie. “Dans la BPCO, la plupart des patients présentent un emphysème prononcé, ce qui entraîne une diminution de la capacité de diffusion – c’est l’un des paramètres fonctionnels les plus sensibles”, a expliqué le conférencier. En outre, pour exclure un carcinoïde, il faut toujours réaliser une imagerie pulmonaire en présence de tels troubles. Chez la patiente de l’étude de cas, cette procédure diagnostique a permis de poser le diagnostic suivant : asthme bronchique sévère ; exacerbations récurrentes plus de trois fois par an ; aucune sensibilisation décelable ; pas d’intolérance à l’ASA (acide acétylsalicylique).

Le nombre d’éosinophiles est déterminant pour poser l’indication
En présence d’un diagnostic confirmé d’asthme sévère, il convient d’évaluer si un traitement par anticorps monoclonaux doit être envisagé. A l’heure actuelle, les deux classes de substances actives suivantes sont autorisées (aperçu 1) :
- anti-IgE (omalizumab) pour l’indication d’asthme bronchique allergique persistant sévère (exacerbation, obstruction marquée et sensibilisation à un allergène présent toute l’année, par exemple les acariens ou l’aspergillus)
- anti-IL5 (mépolizumab, reslizumab) pour l’indication de l’asthme sévère à éosinophiles (inflammation à éosinophiles). Pour la détection d’une inflammation à éosinophiles, la formule sanguine différentielle est une méthode économique et praticable, le nombre absolu de granulocytes éosinophiles étant important dans ce contexte, et non le pourcentage d’éosinophiles. L’éosinophilie sanguine est un biomarqueur bien établi et un nombre élevé d’éosinophiles est corrélé à une fréquence plus élevée d’exacerbations sévères, à une moins bonne contrôlabilité de la maladie et à une meilleure réponse au traitement anti-éosinophilique [2].

Possibilité de traitement à long terme dépendant de la réponse
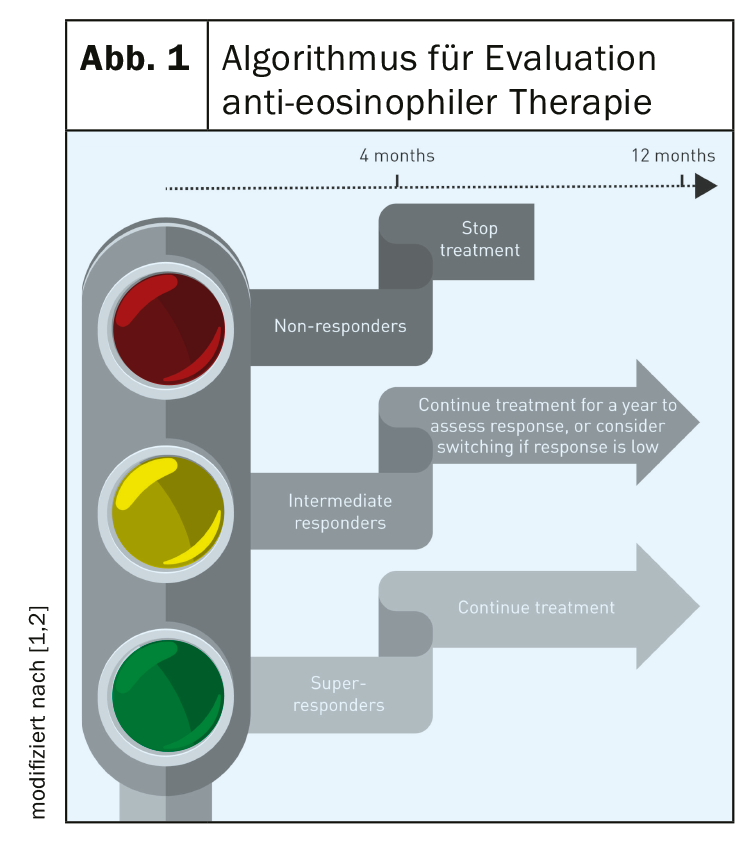
Selon Buhl et al. [2], d’autres études d’évaluation sont nécessaires pour évaluer l’efficacité du traitement par anticorps dans différentes sous-populations de patients souffrant d’asthme éosinophile sévère. Il s’agit de thérapies complémentaires non curatives, de sorte que les critères de changement ou d’arrêt de traitement sont importants. La task force d’experts européens a élaboré l’algorithme suivant (Fig. 1) : Évaluation de la réponse après une durée minimale de traitement de 4 mois – pour les “super-répondeurs”, le traitement peut être poursuivi ; “Les répondeurs intermédiaires” doivent poursuivre le traitement par anticorps anti-IL5 pendant 1 an, puis réévaluer la réponse ou passer à un autre traitement par anticorps ; pour les “non-répondeurs”, le traitement anti-éosinophilique doit être interrompu. Il n’est pas possible à l’heure actuelle de répondre à la question de savoir si le traitement par anticorps anti-IL5 pourrait entraîner à l’avenir une diminution de l’utilisation des corticostéroïdes oraux, voire leur élimination. En revanche, une vaste étude britannique a démontré empiriquement que les symptômes associés à la corticothérapie systémique sont significativement plus fréquents chez les patients souffrant d’asthme sévère que chez ceux souffrant d’asthme modéré et les non-asthmatiques (93% vs 78% vs 64% ; p<0,001) [5]. En cas d’asthme sévère, les taux de morbidité relatifs aux troubles associés à la corticothérapie systémique étaient significativement plus élevés par rapport à une forme modérée d’asthme (diabète de type 2 10% vs 7%, OR=1,46 ; IC 95% : 1,11-1,91 ; p<0,01 ; ostéoporose 16% vs 4%, OR=5,23 ; IC 95% : 3,97-6,89 ; p<0,001 ; troubles dyspeptiques (y compris ulcérations gastriques/duodénales) 65% vs 34%, OR=3,99 ; IC 95% : 3,37-4,72 ; p<0,001 ; cataractes 9% vs 5%, OR=1,89 ; IC 95% : 1,39-2,56 ; p<0,001) [5].
Les anticorps anti-IL-5, une option pour l’EGPA à l’avenir ?
Le professeur Claus Kroegel, directeur du service de pneumologie de l’hôpital universitaire d’Iéna, a montré à l’aide d’un cas clinique que le traitement par anticorps anti-IL5 pourrait également constituer une option thérapeutique dans le traitement de la granulomatose à éosinophiles avec polyangéite (EGPA ; anciennement connue sous le nom de syndrome de Churg-Strauss) à l’avenir (encadré Cas clinique) [6].

La patiente, âgée de 55 ans, souffrant d’asthme bronchique allergique corticodépendant sévère avec sensibilisation allergique polyvalente, a présenté des paresthésies récurrentes au niveau des deux plantes de pied ainsi que des douleurs persistantes au niveau des orteils et des bouts de doigts dix mois après l’arrêt du traitement par omalizumab en octobre 2015. Un traitement par 10 mg de MTX par semaine s.c. a ensuite été instauré. Au cours de l’évolution, la patiente doit réduire progressivement la dose de cortisone de 10 mg/jour (7,5 mg pendant 2 mois, puis 5 mg pendant 2 mois, puis continuer à réduire par paliers de 1 mg). Lors du contrôle 4 mois plus tard, la patiente a indiqué une légère amélioration de la dyspnée et de la toux. Cependant, les paresthésies étaient progressives et maintenant présentes de manière continue (avant-pieds, plante des pieds, orteils, doigts). Une réduction de la dose de cortisone orale en dessous de 7,5 mg/jour n’a pas été possible. De plus, deux exacerbations ont eu lieu, nécessitant à chaque fois des pulsations de cortisone. En février 2017, un traitement par 10 mg de MTX par semaine s.c. a été arrêté et un traitement par mépolizumab, un anticorps anti-IL-5 (100 mg par mois), a été initié ; la corticothérapie devait être poursuivie. Lors du contrôle 6 mois plus tard, la patiente a indiqué une nette amélioration de sa santé. La dyspnée et la toux ne sont plus que rarement présentes, elle se sent à nouveau physiquement performante et peut respirer librement. La rhinosinpathie aurait disparu et les paresthésies au niveau de la plante des pieds auraient diminué. Elle a réduit la dose de cortisone à 5 mg et n’a plus eu besoin d’impulsions de cortisone. Selon ses propres informations, la patiente se porte ensuite très bien.
Le diagnostic d’une maladie associée aux éosinophiles, telle que l’EGPA, est souvent compliqué par la nécessité de recourir à des corticostéroïdes oraux, a expliqué l’orateur. La manifestation des symptômes typiques, notamment la vascularite, les modifications pulmonaires et l’éosinophilie, serait ainsi supprimée. Dans ce cas, ce sont les manifestations extra-pulmonaires (paresthésies comme équivalent de vascularite), l’augmentation des IgG4 et enfin la réponse à un traitement anti-éosinophiles qui auraient conduit au diagnostic. Les IgG4 sont détectées chez la moitié des patients atteints d’EGPA, mais la signification de cette immunoglobuline dans ce contexte n’est pas encore claire à l’heure actuelle.
Littérature :
- DGIM : Prof. Christian Taube, directeur du service de pneumologie de l’hôpital universitaire d’Essen, présentation de transparents : Eosinophiles : 125. Congrès DGIM, Wiesbaden, 4 mai 2019.
- Buhl R, et al : Asthme éosinophilique sévère : une feuille de route vers le consensus. Eur Respir J 2017 ; 49 : 1700634.
- Ortega H, et al : Blood eosinophil counts predict treatment response in patients with severe eosinophilic asthma. J Allergy Clin Immunol 2015 ; 136 (3) : 825-826.
- Taube C, et al. : Asthme bronchique : le traitement personnalisé est-il à l’horizon ? Allergo J Int 2014 ; 23(7) : 246-251.
- Sweeney J, et al : Thorax 2016 ; 71(4) : 339-346.
- DGIM : Prof. Claus Kroegel, chef du service de pneumologie de la clinique universitaire de Jena, présentation de transparents : Eosinophiles : 125. Congrès DGIM, Wiesbaden, 4 mai 2019.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2019 ; 2(1) : 21-22