- Le traitement à long terme par UPA, jusqu’à 5,5 ans, ne montre aucun nouveau signal de sécurité (1).
- L’UPA présente un profil d’innocuité cohérent dans le traitement de la polyarthrite rhumatoïde (PR), de l’arthrite psoriasique (AP) et de la spondyloarthrite axiale (SA), bien que la fréquence des effets secondaires varie en raison des différences dans la population de patients et des comorbidités liées à la maladie (1).
- L’UPA a un profil de sécurité comparable à celui de l’adalimumab dans la PR* et le PsA (1).
* A l’exception des événements déjà connus d’herpès zoster et de NMSC plus élevés et des niveaux plus élevés de CPK.
L’UPA dans les maladies rhumatismales
La PR, la PsA et la SA sont très pénibles pour les personnes touchées : l’inflammation sous-jacente peut provoquer des lésions articulaires permanentes et réduire considérablement la qualité de vie des personnes concernées [2, 3]. L’upadacitnib (UPA, RINVOQ®) est un inhibiteur oral et réversible de la Janus kinase (JAK) qui agit spécifiquement sur JAK1 et, dans une moindre mesure, sur JAK2, JAK3 ou TYK2. L’UPA est utilisé à la dose de 15 mg une fois par jour dans la PR, la SA et la PsA et est également approuvé pour le traitement des adultes atteints de dermatite atopique (DA) modérée à sévère [4].
L’UPA a montré une forte efficacité dans les 9 études menées dans la PR, la PsA, la SA et la MA. Cependant, une utilisation sûre est tout aussi cruciale pour un traitement [4]. Les données de l’étude de surveillance ORAL, qui a comparé le tofacitinib, un inhibiteur des JAK, à un inhibiteur du facteur de nécrose tumorale (TNF) chez des patients âgés atteints de PR et présentant des facteurs de risque cardiovasculaire, soulignent la nécessité de mieux caractériser le profil de sécurité des inhibiteurs des JAK dans le traitement des maladies rhumatismales, en particulier dans le contexte des comparateurs actifs. Une nouvelle publication de Burmester et al. montre maintenant le profil de sécurité à long terme de l’UPA sur une période allant jusqu’à 5,5 ans dans les maladies rhumatismales, au cours de laquelle aucun nouveau signal de sécurité n’est apparu [1].
Traitement à long terme à l’UPA
Au total, l’innocuité de l’UPA a été évaluée chez 6000 patients atteints de PR, PsA, SA et MA sur 15 000 patients-années. Dans la PR, la SA et la PsA, un total de 9 études de phase IIb/III ont été incluses, ce qui signifie que des données sont disponibles sur 4298 patients traités ayant reçu au moins une dose d’UPA (3209 patients atteints de PR, 907 de PsA et 182 de SA). Cela correspond à un total de 11272 patients-années (9079.1 pour la PR, 1872 pour la PsA et 320 pour la SA, respectivement) [1]. La durée maximale du traitement a atteint 5,5 ans pour la PR, 3,9 ans pour la PsA et 3,3 ans pour la SA. Environ 80 % des patients de tous les groupes présentaient au moins un facteur de risque de maladie cardiovasculaire au début de l’étude (tableau 1). Les patients âgés (> 65 ans) étaient plus nombreux dans la population RA (20%) que dans la population AS (6%) [1]. Les patients ayant reçu au moins une dose d’ADA ou de MTX ont été pris en compte pour la comparaison. La plupart des patients atteints de PR et d’APS qui prenaient de l’UPA recevaient également un traitement csDMARD – chez les patients atteints de SA, l’ajout d’un traitement csDMARD était rare [1].
Tableau 1 : Données démographiques de base et caractéristiques de la maladie de l’UPA, de l’ADA et du MTX chez les patients atteints de PR, ainsi que de l’UPA et de l’ADA chez les patients atteints de PsA et de l’UPA chez les patients atteints de SA.

* L’activité de la maladie est mesurée comme suit : RA, DAS (Disease Activity Score)-28 (CRP) ; PsA, DAPSA (Disease Activity Index for Psoriatic Arthritis) ; AS, ASDAS (Ankylosing Spondylitis Disease Activity Score)
†CVLes facteurs de risque incluent les antécédents d’événements cardiovasculaires, l’hypertension, le diabète sucré, la consommation de tabac/nicotine, un taux de LDL-C élevé et un taux de HDL-C abaissé. Adapté de [1]
Pas de nouveaux signaux de sécurité sous UPA
Le profil de sécurité de l’UPA était globalement comparable dans la PR, la PsA et la SA. Des infections graves ont été observées chez des patients atteints de PR et de PsA sous traitement par UPA (Fig. 1). Ces infections n’ont que rarement entraîné l’arrêt du traitement et leur fréquence était similaire chez les patients atteints de PR sous UPA et chez les patients sous traitement par ADA. En revanche, aucune infection grave n’a été signalée chez les patients atteints de SA sous traitement par UPA. Les taux accrus d’infections graves chez les patients atteints de PsA sous UPA semblent être liés à COVID-19 [1].
Les affections malignes (à l’exclusion des cancers de la peau non mélaniques, NMSC) ont été signalées à tous les stades de la maladie, avec un taux allant jusqu’à un maximum d’un événement pour 100 patients-années (≤1,0 E/100 PY) (figure 1), ce taux étant cohérent pour toutes les maladies et également entre l’UPA et les comparateurs actifs. Aucun changement significatif de ce taux n’a été observé pendant toute la durée de la prise d’UPA. Les taux de NMSC sous traitement par UPA (≤ 0,8 U/100 PY) étaient généralement les mêmes pour toutes les pathologies, à l’exception de la SA – aucune pathologie maligne n’a été observée dans cette population de patients [1].
Des événements cardiovasculaires indésirables graves (MACE) ont été rapportés dans tous les groupes de traitement, avec des taux <0,5 pour 100 patients-années (PY) (Fig. 1). À l’exception du traitement par UPA des patients atteints de SA, où aucun événement cardiovasculaire n’a été observé. Dans l’ensemble, le taux de MACE était comparable chez les patients atteints de PR et de PsA sous traitement par UPA, ADA et MTX. Aucun lien n’a été établi entre la durée de la prise d’UPA et l’apparition de MACE. La plupart des patients ayant subi un MACE présentaient au moins un facteur de risque cardiovasculaire [1].
Des thromboembolies veineuses (TEV) ont été observées chez des patients sous UPA à tous les stades de la maladie, avec des taux de <0,4 E/100 PY dans la PR ou 0,2 E/100 PY dans la PsA et 0,3 E/100 PY dans la SA. Le nombre d’événements sous UPA était comparable à celui observé sous ADA (PR et PsA) et MTX (PR) (Fig. 1). Aucune relation n’a été observée entre la durée d’exposition à l’UPA et la survenue de TEV. La plupart des patients ayant subi une TEV présentaient au moins un facteur de risque cardiovasculaire et/ou thromboembolique [1].
Comme prévu, des cas d’herpès zoster ont également été signalés chez les patients recevant de l’UPA. Celui-ci était généralement doux ou modéré. L’herpès zoster n’a que rarement entraîné l’interruption du traitement et n’a touché qu’un seul dermatome. En outre, aucun lien n’a été établi entre la durée du traitement et l’apparition du zona [1]. Un vaccin contre l’herpès zoster est disponible. Le vaccin doit être administré 4 semaines avant le traitement par un agent immunomodulateur actif tel que l’UPA [4].
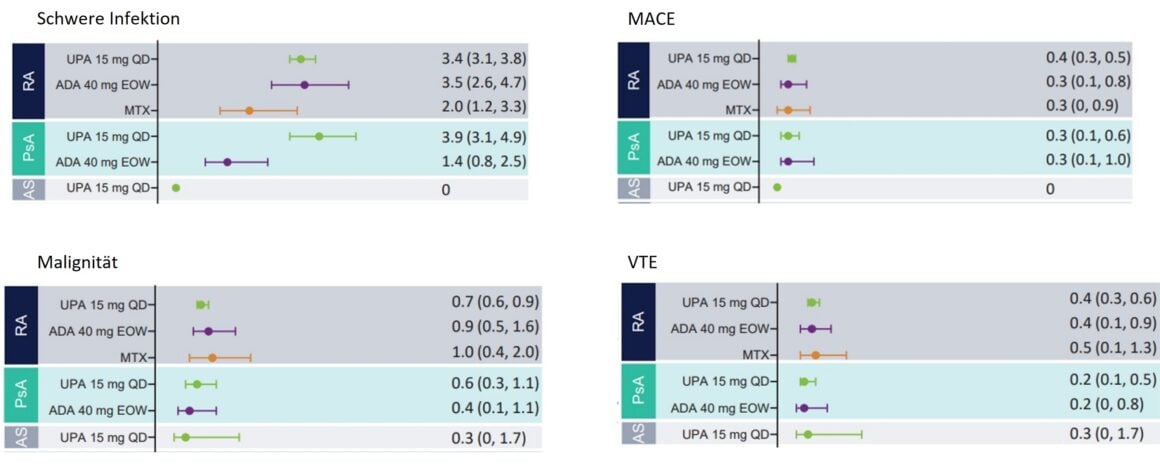
Figure 1 : Taux d’événements indésirables liés au traitement (TEAE) présentant un intérêt particulier chez les patients atteints de PR, de PsA et de SA, ajustés en fonction de l’exposition. MACE, Major Adverse Cardiovascular Events ; TEV, Thromboembolies veineuses. Adapté de [1]
Évaluer le profil bénéfice/risque
Le traitement des maladies rhumatismales doit viser à obtenir une rémission durable [5]. La rémission améliore non seulement le résultat du traitement, mais réduit également le fardeau des patients au-delà des symptômes de la maladie. ainsi, la rémission réduit le risque d’infection [6], le risque de CV [7] et peut-être aussi le risque de lymphome [8]. Les inhibiteurs JAK se sont révélés être une alternative efficace pour les patients atteints de PR, de SA et de PsA qui ne répondent pas ou ne tolèrent pas les csDMARDs ou les bDMARDs [4]. L’UPA, un inhibiteur de JAK, a fait et fait toujours l’objet de vastes programmes cliniques de phase III [1]. Les premières données à long terme de l’UPA, qui a évalué la sécurité et l’efficacité chez les patients atteints de PR et ne répondant pas au méthotrexate, sont disponibles. L’UPA en association avec le MTX est supérieur à l’ADA avec le MTX en termes de réponse clinique. L’efficacité sur les douleurs articulaires a été mesurée sur la base des critères de réponse ACR, de l’intensité de la douleur et du maintien de la fonction physique. De plus, une proportion significativement plus élevée de patients sous UPA ont atteint une rémission ou une faible activité de la maladie. Les taux d’événements indésirables étaient comparables à ceux de l’ADA, à l’exception du zona, de la lymphopénie, des troubles de la fonction hépatique (principalement des augmentations des ALT et des ALS) et des augmentations des CPK. Si l’on compare les bénéfices et les risques de l’UPA à ceux de l’ADA, l’UPA a donné de meilleurs résultats cliniques avec un profil d’événements indésirables comparable (figure 2) [9].

Figure 2 : Évaluation du rapport bénéfice/risque entre l’UPA et l’ADA dans un contexte clinique. Le nombre incrémentiel de patients ayant atteint les critères d’efficacité et de sécurité était basé sur les estimations de points “Number Needed to Treat” (NNT) et “Number Needed to Harm” (NNH) pour le traitement avec l’UPA au lieu de l’ADA. a Différence statistiquement significative pour UPA vs ADA (95% Ki). Adapté de [9]
Conclusion
En résumé, le profil d’innocuité de l’UPA est comparable dans la PR, la PsA et la SA, et aucun nouveau signal d’innocuité n’a été observé même après un traitement à long terme par l’UPA allant jusqu’à 5,5 ans (1). En outre, l’UPA présente un profil d’innocuité cohérent dans la PR, la PsA et la SA, bien que la fréquence des effets secondaires varie en raison de différences dans la population de patients et des comorbidités liées à la maladie. Globalement, le profil de sécurité de l’UPA dans la PR et la PsA est comparable à celui de l’ADA et du MTX (1).
La publication complète de Burmester et al. est disponible ici.
ACR, American College of Rheumatology ; ADA, adalimumab ; ALT, alanine aminotransférase ; ALS, aspartate aminotransférase ; CV, cardio-vasculaire, CDAI, Clinical Disease Activity Index ; csDMARD, Disease-Modifying Anti-Rheumatic Drugs synthétiques conventionnels ; DAS28, 28-joint Disease Activity Score ; HZ, Herpes zoster ; IR, Inadequate Response ; CI, Intervalle de confiance ; LDA, Low Disease Activity ; MACE, Major Adverse Cardiovascular Event ; MTX, Methotrexate ; NNT, Number Needed to Treat ; NMSC, Non-Melanoma Skin Cancer ; NNH, number needed to harm ; UPA, Upadacitinib ; VTE, thromboembolism veineux.
Références :
1. Burmester, G.R., et al, Safety profile of upadacitinib over 15 000 patient-years across rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and atopic dermatitis. RMD Open, 2023. 9(1).
2. Gudu, T. et L. Gossec, Quality of life in psoriatic arthritis. Expert Rev Clin Immunol, 2018. 14(5) : p. 405-417.
3 Combe, B., et al, 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis, 2017. 76(6) : p. 948-959.
4. information professionnelle actuelle RINVOQ® (upadacitinib) sur
www.swissmedicinfo.ch
.
5. Smolen, J.S., et al, Recommandations de l’EULAR pour la prise en charge de la polyarthrite rhumatoïde avec des médicaments antirhumatismaux de synthèse et biologiques modifiant la maladie : mise à jour 2019. Ann Rheum Dis, 2020. 79(6) : p. 685-699.
6. Accortt, N.A., et al, Impact de la rémission prolongée sur le risque d’infection grave chez les patients atteints de polyarthrite rhumatoïde. Arthritis Care Res (Hoboken), 2018. 70(5) : p. 679-684.
7. Solomon, D.H., et al, Disease activity in rheumatoid arthritis and the risk of cardiovascular events. Arthritis Rheumatol, 2015. 67(6) : p. 1449-55.
8 Baecklund, E., et al, Association de l’inflammation chronique, et non de son traitement, avec un risque accru de lymphome dans la polyarthrite rhumatoïde. Arthritis Rheum, 2006. 54(3) : p. 692-701.
9. Conaghan, P., et al, Benefit-Risk Analysis of Upadacitinib Compared to Adalimumab in the Treatment of Patients with Moderate-to-Severe Rheumatoid Arthritis. Rheumatol Ther, 2022. 9(1) : p. 191-206.
Les références peuvent être demandées par les professionnels à medinfo.ch@abbvie.com.
Rapport : Dr. med. Corinne Peter
Cet article a été rédigé avec le soutien financier de AbbVie AG, Alte Steinhauserstrasse 14, Cham.
Information spécialisée succincte UPA
CH-RNQD-230016_04/2023
En ligne depuis le 04.05.2023











