La sclérose en plaques est une maladie inflammatoire relativement fréquente du cerveau et de l’ensemble du système nerveux central, qui se caractérise par une démyélinisation dont la cause n’est pas encore claire [1]. Le diagnostic repose sur des critères diagnostiques avec l’apparition de déficits neurologiques répétés, la détection de bandes oligoclonales dans le LCR et des résultats radiologiques souvent typiques ; seule l’imagerie par résonance magnétique (IRM) est utilisée comme méthode d’imagerie. L’IRM révèle la présence de plaques inflammatoires typiques dans la substance blanche, souvent paracellulaires et périventriculaires. Parce que les
diagnostic n’est pas toujours évident, les classifications radiologiques sont très utiles (par exemple, les critères de McDonald). Ils sont basés sur une classification précise en termes de nombre, de localisation, de prise de contraste et de variations temporelles des foyers.
La sclérose en plaques (SEP) est la maladie inflammatoire chronique du système nerveux central la plus fréquente en Europe centrale. Elle survient généralement tôt dans la vie, ce qui nécessite un traitement agressif. Elle touche principalement les jeunes femmes (ratio 2:1), qui ont une longue espérance de vie et peuvent être confrontées à un handicap croissant en l’absence de traitement. Il s’agit d’une maladie dite démyélinisante du système nerveux central, dans laquelle la substance blanche est détruite par des modifications inflammatoires. Comme la maladie peut toucher l’ensemble du système nerveux et que les symptômes cliniques sont variés, il est souvent difficile de poser un diagnostic clair au début de la maladie. Cet article aborde les bases du diagnostic radiologique ainsi que les techniques et les critères qui peuvent aider à faciliter le diagnostic.
L’un des principaux problèmes de la maladie est que le facteur déclenchant (antigène) n’a pas été identifié avec précision à ce jour. D’un côté, il semble y avoir des signes clairs d’un facteur déclenchant externe, mais il est probable que la prédisposition génétique joue également un rôle. L’évolution de la maladie n’est pas uniforme et les résultats de l’imagerie primaire ne sont pas toujours clairs. Selon certains experts, la SEP n’est pas nécessairement une maladie unique. Cela signifie également que le traitement reste essentiellement symptomatique. Le traitement de la maladie a toutefois fait de grands progrès ces dernières années, notamment avec le développement de médicaments d’immunomodulation et d’immunosuppression.
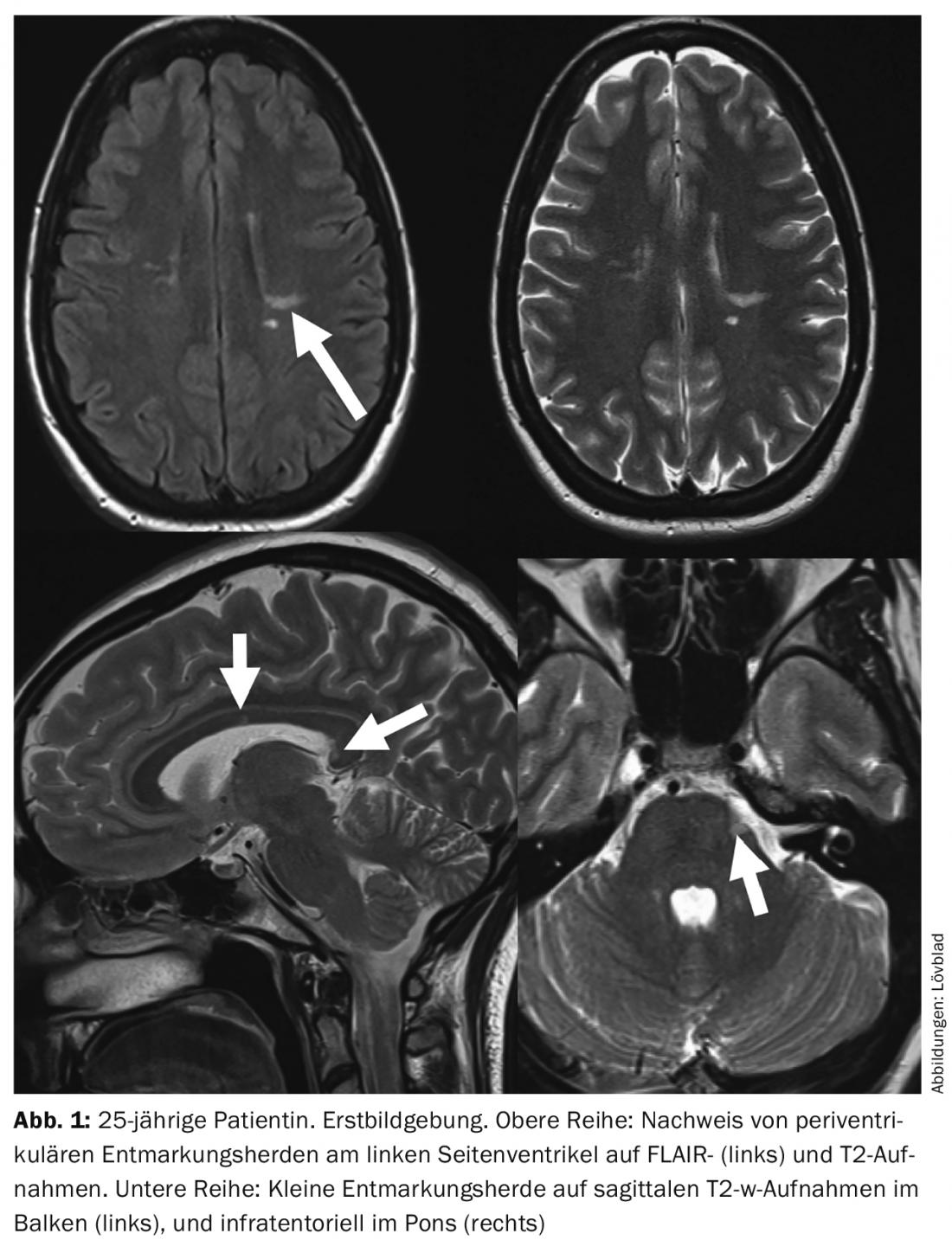
L’imagerie du SNC joue aujourd’hui un rôle central. Le diagnostic de la SEP repose généralement sur l’imagerie médicale. Il ne faut cependant pas oublier que le résultat clinique oriente toujours la procédure diagnostique [2]. Un concept important est ce que l’on appelle le “syndrome cliniquement isolé”. Il s’agit de la première apparition d’une symptomatologie neurologique isolée due à une démyélinisation inflammatoire. Ces patients ont pour la plupart, mais pas toujours, des résultats d’IRM clairs ou les développeront avec le temps. Un autre concept est le “syndrome radiologiquement isolé”, dans lequel les résultats d’imagerie montrent des changements typiques de la SEP, mais le patient est asymptomatique à cet égard (Fig. 1).
Choix de la méthode d’imagerie
Au début de l’imagerie axiale du cerveau, la tomodensitométrie a été utilisée. On pouvait parfois y voir les plaques comme des hypodensités, notamment des “doigts de Dawson” plus grands (les lésions ovoïdes perpendiculaires aux ventricules ressemblent à des doigts coupés transversalement).
La tomodensitométrie a depuis été remplacée par l’imagerie par résonance magnétique. L’IRM a l’avantage de ne pas générer de radiations ionisantes, ce qui signifie que l’examen peut être répété plusieurs fois. Mais surtout, l’IRM permet une visualisation multiplanaire du système nerveux avec une meilleure résolution pour les modifications inflammatoires du cerveau. Néanmoins, il arrive encore aujourd’hui qu’en raison d’un déficit neurologique, un patient souffrant d’un début de SEP passe un scanner en cas de suspicion d’hémorragie intracérébrale par exemple. Dans ces cas, il faut penser à des plaques démyélinisantes, surtout si les résultats attendus ne sont pas délimités. Sinon, l’IRM est la modalité d’examen de choix, tant pour le diagnostic primaire et les examens de contrôle ultérieurs que pour la réalisation d’essais thérapeutiques (“drug trials”), qui restent nécessaires pour établir le traitement optimal. Il est important que l’examen soit le plus complet possible afin de poser le diagnostic avec certitude, de commencer un traitement potentiellement efficace le plus rapidement possible et de détecter les effets secondaires des thérapies (par exemple, la leuco-encéphalopathie multifocale progressive [PML]).
Résultats de l’IRM
Les plaques démyélinisantes sont représentées en IRM sous forme d’hypointensités sur les séquences T1 et d’hyperintensités sur les séquences pondérées en T2. Les anciennes lésions de SEP “brûlées” sont appelées “trous noirs” car elles apparaissent très sombres à noires sur les séquences pondérées en T1. Le volume total de ces “trous noirs” est appelé “lesion load” (volume total de la lésion) et est en corrélation avec le statut clinique et le résultat. Une séquence qui a trouvé son plein potentiel d’application dans l’imagerie de la SEP est la séquence FLAIR. Il s’agit d’une séquence pondérée en T2, dans laquelle le liquide libre (Liqour) ne donne plus de signal : Cela permet de mieux voir les lésions proches du système ventriculaire. Ces séquences sont généralement effectuées dans le plan axial. Un plan qui est extrêmement important dans l’imagerie de la SEP est le plan sagittal : il permet une bonne visualisation topique des lésions dans la barre. Avec le développement de meilleures séquences 3D isotropes, il est désormais possible d’enregistrer des séquences pondérées T1, T2 ou FLAIR sous forme de jeu de volumes que l’on peut ensuite reconstruire dans n’importe quel plan. Cela permet également de reconstruire le plan d’image à l’identique lors d’études d’historique. Les images 3D sont également la norme dans les essais thérapeutiques, afin de pouvoir calculer les volumes des lésions.
Il ne faut jamais oublier que dans la SEP, toutes les parties du système nerveux peuvent potentiellement être touchées. C’est pourquoi il est souvent nécessaire de visualiser les autres parties comme le myélon ou les orbites, même si cela entraîne une augmentation significative du temps d’examen.
Critères de classification
Lors de l’évaluation de l’examen RM, il est important d’utiliser des critères bien établis, basés sur la description précise du nombre, de la localisation et du comportement du produit de contraste des lésions [3]. Il est également souvent important de répéter l’examen afin de montrer la fluctuation locale et temporelle des lésions. Les critères les plus utilisés pour diagnostiquer la SEP sont ceux de McDonald. Si des foyers sont présents dans au moins deux des quatre sites (périventriculaire, juxtacortical, infratentoriel ou spinal), les critères de dissémination locale sont remplis. La dissémination temporelle est remplie lorsqu’un ou plusieurs foyers cliniquement asymptomatiques absorbent le produit de contraste ou lorsque de nouveaux foyers apparaissent dans un scan d’évolution.
L’administration de produit de contraste joue encore aujourd’hui un rôle central dans le diagnostic : elle permet de visualiser l’activité de la maladie et de surveiller les plaques actives pendant un traitement et, comme nous l’avons déjà mentionné, elle fait partie des critères de McDonald. Il faut toutefois être conscient des effets secondaires potentiels. Les allergies aux produits de contraste lors de l’administration de produits de contraste par RM sont extrêmement rares. Il existe un certain risque de dermatopathie néphrogénique fibrosante (NSF) chez les patients atteints de maladies inflammatoires, mais celui-ci est également extrêmement faible. Un autre point controversé est l’accumulation possible de gadolinium dans le cerveau, en particulier chez les patients qui ont été examinés à plusieurs reprises ; c’est le cas des patients atteints de SEP, mais les données à ce sujet doivent encore être vérifiées.
Nouvelles techniques
Plusieurs techniques d’IRM récentes (“avancées”) donnent des résultats prometteurs, mais elles ne sont pas encore totalement adoptées en clinique. Comme la maladie touche la substance blanche, l’imagerie du tenseur de diffusion (DTI) serait intéressante en plus de l’imagerie de diffusion basale. Une méthode comme la DTI permet une meilleure évaluation de la “matière blanche d’apparence normale” et présente donc un grand potentiel, notamment à des fins scientifiques et pour l’établissement de nouvelles stratégies thérapeutiques. Il en va de même pour les différentes méthodes de perfusion, qui ne sont pas encore utilisées en clinique. Ces modalités joueront certainement un grand rôle dans la recherche à l’avenir et contribueront à une meilleure compréhension de la physiopathologie sous-jacente de la maladie.
Résumé
La sclérose en plaques est une maladie démyélinisante du SNC pour laquelle les critères radiologiques jouent un rôle important en plus des critères cliniques. L’IRM est la méthode de choix et consiste en une combinaison de séquences T2 et Flair avec des images pondérées T1 avec contraste. Les séquences tridimensionnelles jouent un rôle de plus en plus important, car elles permettent une reconstruction à chaque niveau du cerveau et une meilleure comparaison au cours de l’évolution. L’objectif est de présenter une maladie qui touche l’ensemble du SNC, avec une évolution dans le temps et dans l’espace. Il est important d’utiliser des critères diagnostiques établis, comme les critères de McDonald, et de les mentionner précisément dans le compte rendu radiologique.
Littérature :
- Lövblad KO, et al : Imagerie RM dans la sclérose en plaques : revue et recommandations pour la pratique actuelle. AJNR Am J Neuroradiol 2010 Jun ; 31(6) : 983-989.
- Haller S, et al : Imagerie par résonance magnétique dans la sclérose en plaques. Top Magn Reson Imaging 2009 Dec ; 20(6) : 313-323.
- Polman CH, et al : Critères de diagnostic pour la sclérose en plaques : 2010 révisions des critères de McDonald. Ann Neurol 2011 Feb ; 69(2) : 292-302.
InFo NEUROLOGIE & PSYCHIATRIE 2016 ; 14(1) : 4-6











