Le rétrécissement de la valve aortique est l’anomalie valvulaire acquise la plus fréquente et est corrigée par un AKE ou un TAVI. Cependant, malgré les progrès de la thérapie, les problèmes de rythme sont fréquents. Que faut-il faire ?
En Suisse, des milliers de patients bénéficient chaque année d’un remplacement valvulaire aortique chirurgical (RVA) ou d’une implantation de valve aortique transcathéter (TAVI). Dans la majorité des cas, l’indication primaire est une sténose valvulaire aortique calcifiante, qui touche 3 à 5% de la population âgée de plus de 75 ans [1].
Les tachyarythmies, en particulier la fibrillation auriculaire (FA) et les troubles de la conduction auriculo-ventriculaire (AV), notamment le bloc de branche gauche (BG) et les blocages AV de degré supérieur, comptent parmi les problèmes de rythme les plus fréquents avant, pendant et après un EAE chirurgical ou un TAVI. Ces troubles du rythme augmentent à la fois la morbidité et la mortalité, entraînent des séjours hospitaliers prolongés et augmentent les coûts.
Les effets cliniques de ces troubles du rythme chez les patients atteints de valvulopathie aortique sont variés et l’éventail des symptômes va de l’absence totale de symptômes et de gêne, à des palpitations occasionnelles, de la fatigue, des vertiges, des difficultés respiratoires ou des douleurs thoraciques, jusqu’à une insuffisance cardiaque grave cliniquement manifeste, une syncope, un choc cardiogénique et la mort.
Fibrillation auriculaire – Qui cherche trouve !
La fibrillation auriculaire est le trouble du rythme cardiaque le plus fréquent, avec une prévalence qui augmente fortement avec l’âge : chez les personnes de plus de 80 ans, la prévalence dépasse déjà 10% [1]. La prévalence est également plus élevée en cas d’insuffisance rénale, de BPCO, d’insuffisance cardiaque, et chez les patients ayant subi une chirurgie valvulaire (Fig. 1) [2]. Chez les patients présentant une sténose valvulaire aortique sévère, cette prévalence augmente encore sensiblement et atteint, selon la littérature, 8 à 13% avant ACE chirurgicale et 16 à 51% avant TAVI [3].
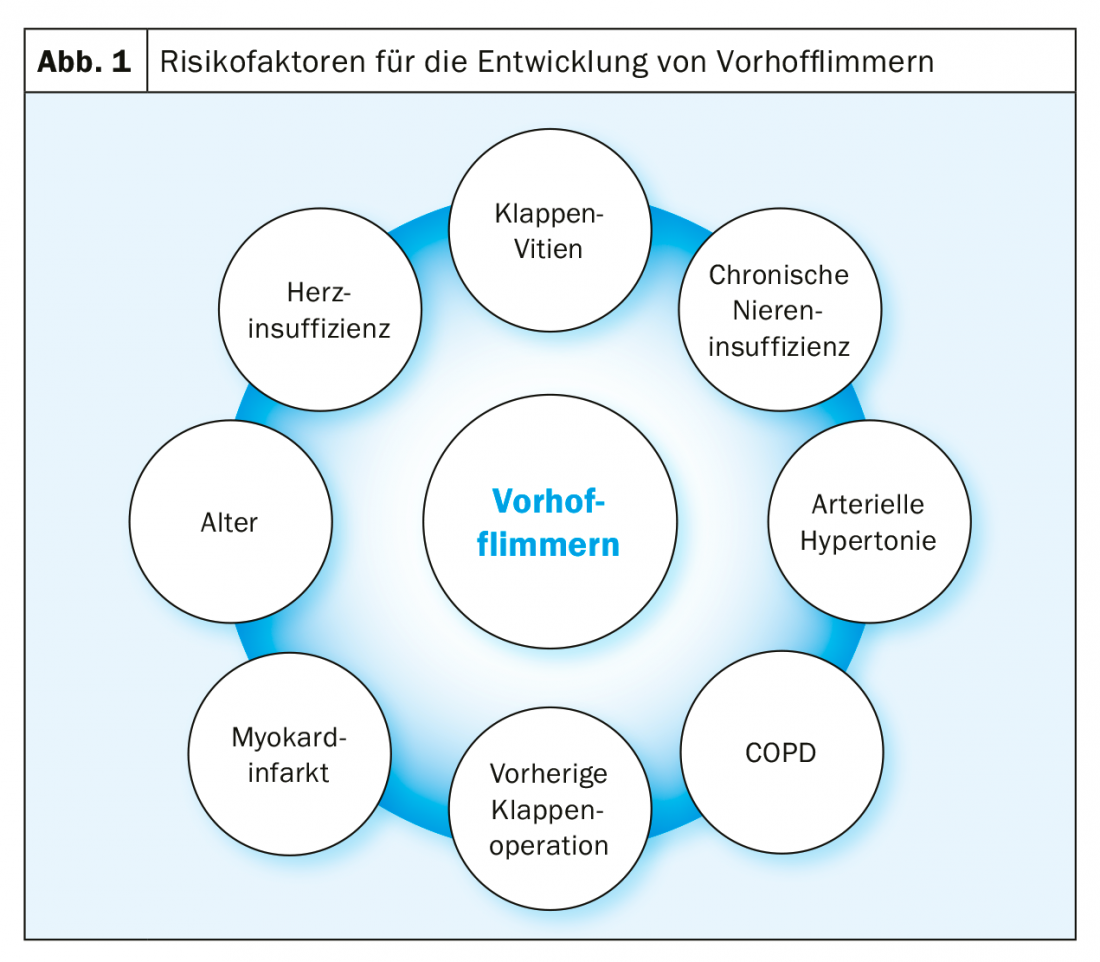
Cette prévalence très élevée de la FHV en cas de sténose valvulaire aortique sévère s’explique d’une part par la co-incidence des facteurs de risque pour les deux maladies : en général, les patients atteints de sténose valvulaire aortique sévère sont généralement des patients très âgés. D’autre part, le vitium lui-même provoque des modifications hémodynamiques qui entraînent une pression dans l’oreillette gauche et une fibrose de l’oreillette gauche, ainsi que des modifications électriques de l’oreillette. Cette transformation du substrat favorise globalement l’apparition de VHF (Fig. 2).
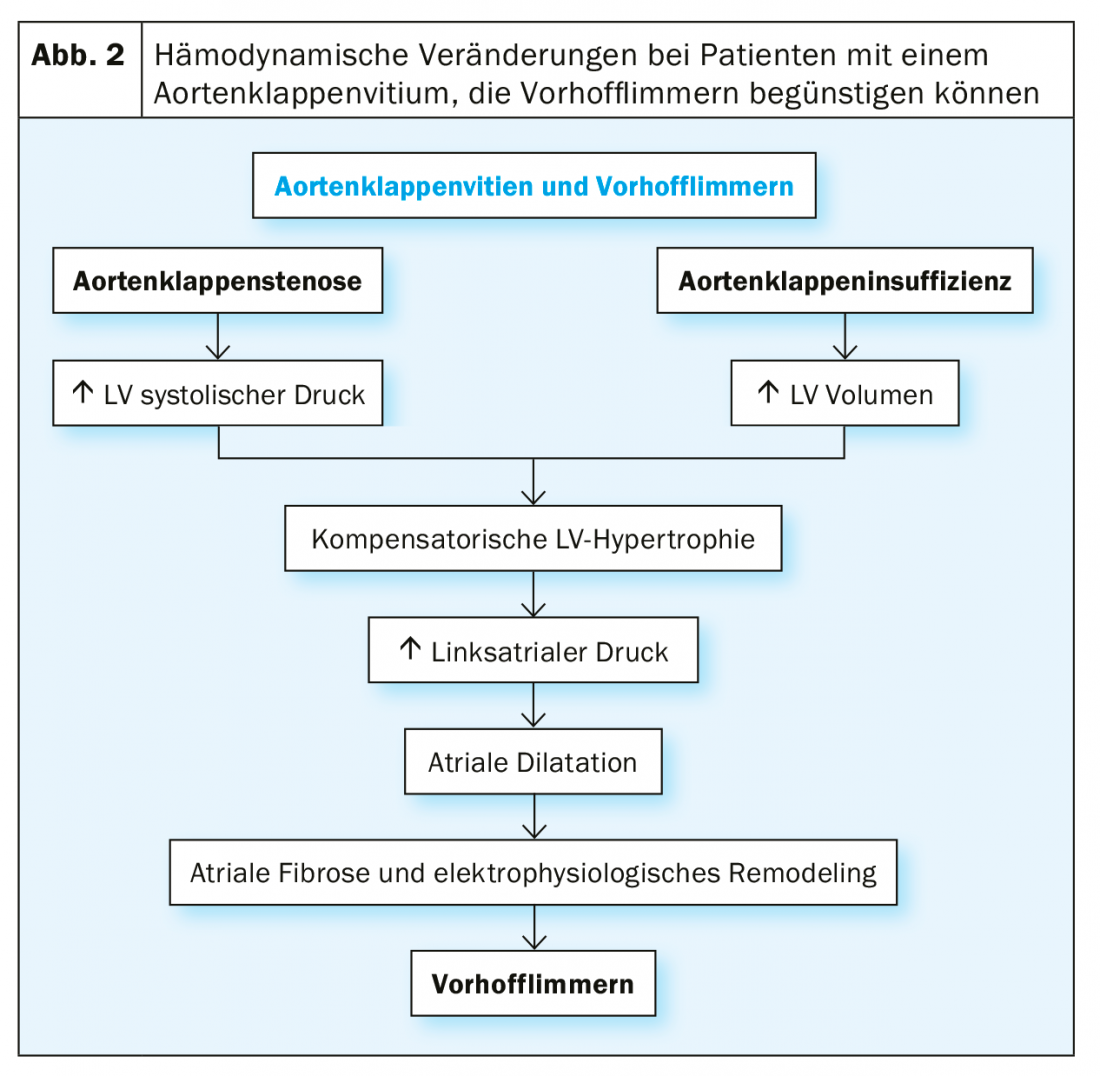
En particulier dans le cas d’un ACE chirurgical, un état hyperadrénergique est généré en péri-intervention et le traumatisme chirurgical provoque une réaction inflammatoire cardiaque qui est considérée comme coresponsable de l’apparition d’une FVC péri-interventionnelle.
Même après un AKE chirurgical ou un TAVI, le VHF est le trouble du rythme le plus fréquent et le plus récemment diagnostiqué. L’incidence dépend fortement de la méthode de dépistage utilisée : plus la surveillance du rythme est longue, plus la fréquence de la FHV est élevée.
En principe, des taux d’incidence élevés de FVO sont décrits après un ACE chirurgical et un TAVI (31-64%, respectivement 4-32%) [4]. Une étude récente de Kalra et al, dans laquelle les données de 171 480 patients ont été analysées après un ACE chirurgical et un TAVI, a révélé un taux d’incidence de la FHV d’environ 50% dans les deux groupes [2]. Dans l’importante étude NOTION, 52 patients ont été suivis en continu par un enregistreur d’événements après un EAE chirurgical ou un TAVI [4]. L’incidence de la FHV était de 100% après l’AKE chirurgical et de 82% après le TAVI. Tous les patients ont été diagnostiqués avec une fibrillation auriculaire dans les 61 premiers jours après une intervention chirurgicale et dans les 41 premiers jours après un TAVI. La charge arythmique au cours des 2 premières semaines après l’AKE chirurgical et le TAVI était significativement plus longue chez les patients ayant subi un AKE chirurgical, avec 2,8%, contre 0,04% après le TAVI (p=0,01). Toutefois, la charge arythmique a considérablement diminué après 3 mois chez les patients ayant subi un EAE chirurgical [4].
On peut supposer que la FVH était préexistante mais asymptomatique chez nombre de ces patients. Le sous-diagnostic de la fibrillation auriculaire asymptomatique est un problème général et ne concerne pas uniquement les patients atteints de sténose valvulaire aortique sévère.
Un nouveau diagnostic de FHV après un ACE chirurgical ou un TAVI entraîne un allongement de la durée d’hospitalisation par rapport aux patients sans FHV (9 vs. 6 jours pour les deux groupes ; p<0,001) [2]. Chez ces patients, on observe également une augmentation significative de la mortalité pendant l’hospitalisation après un ACE chirurgical et un TAVI par rapport aux patients sans FVH nouvellement diagnostiqué. La mortalité à 1 an des patients présentant une FHV incidente après TAVI est également significativement plus élevée par rapport aux patients sans FHV nouvellement diagnostiquée (31% vs 14% ; p<0,01) [5].
Une anticoagulation orale pour la prophylaxie thromboembolique doit être utilisée chez tous les patients présentant une FHV et un risque thromboembolique élevé.
Troubles de la conduction AV et besoin d’un stimulateur cardiaque
Les principaux facteurs de risque de troubles de la conduction AV sont l’âge, l’insuffisance cardiaque, la maladie coronarienne, l’hypertension artérielle et le diabète sucré [6]. Il n’est donc pas surprenant que les troubles de la conduction AV soient très fréquents chez les patients typiquement plutôt âgés souffrant d’une sténose valvulaire aortique sévère : chez 10 à 20% des patients bénéficiant d’un ACE chirurgical ou d’un TAVI, un stimulateur cardiaque a déjà été implanté au préalable [7]. Les facteurs de risque supplémentaires pour un trouble de la conduction AV après TAVI sont notamment le bloc de branche droit complet et un bloc AV du 1er degré (Fig. 3).
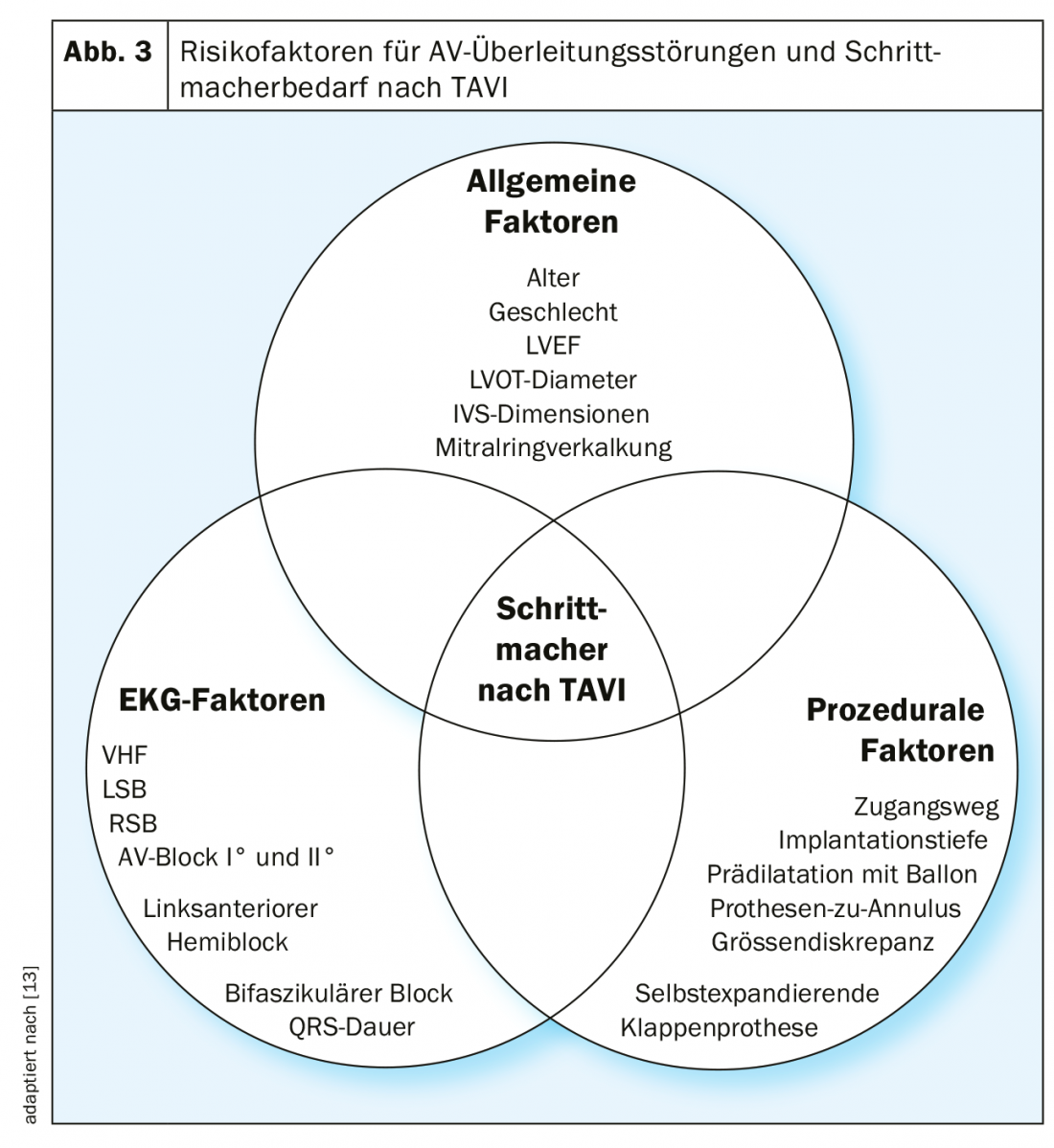
L’apparition de troubles de la conduction AV pendant et après un ACE chirurgical ou un TAVI est en outre due à la relation anatomique proche de la valve aortique avec le système de conduction. Ainsi, le fascicule gauche passe relativement superficiellement juste en dessous de la valve aortique dans la voie d’écoulement du ventricule gauche. Une compression mécanique de cette région par une valve aortique implantée en profondeur lors d’un TAVI, ou une lésion de cette région lors d’un ACE chirurgical, entraîne un bloc de branche gauche, voire un bloc AV complet, ce dernier en particulier en cas de bloc de branche droit préexistant.
En présence d’une valve aortique bicuspide ou d’une sténose valvulaire aortique sévèrement calcifiée, on observe également une prévalence plus élevée de troubles de la conduction AV et de besoin de stimulateur cardiaque en raison de la nécessité d’un débridement important.
L’incidence des troubles de la conduction AV après TAVI dépend également du modèle de valve implanté. Celle-ci est en principe plus élevée pour les prothèses valvulaires auto-expansibles par rapport aux modèles expansibles par ballonnet. La taille de l’anneau de la valve aortique par rapport au diamètre de la prothèse valvulaire joue également un rôle, en plus de la profondeur d’implantation.
Les troubles de la conduction auriculo-ventriculaire surviennent généralement pendant ou peu de temps après l’implantation de la valve, mais peuvent également survenir quelques jours après le TAVI [8]. Ce dernier point rend la prise en charge de ces patients difficile et fait qu’après un TAVI, l’indication d’implantation d’un stimulateur cardiaque est beaucoup plus libérale qu’après un ACE chirurgical. En revanche, après un ACE chirurgical, on attend jusqu’à une semaine en cas de bloc AV complet et on n’implante un stimulateur que si le bloc AV ne se rétablit pas.
L’incidence d’un bloc de branche gauche après un EAE chirurgical est de 3-4% et l’incidence d’un bloc AV complet persistant nécessitant un stimulateur cardiaque est de 3-12% [8,9]. En revanche, l’incidence du bloc de branche gauche après TAVI est de 18-65% pour les prothèses valvulaires auto-expansibles et de 4-30% pour les prothèses valvulaires expansibles par ballonnet [10]. Un stimulateur cardiaque est réimplanté chez 25-28% des patients ayant subi un TAVI avec une prothèse valvulaire auto-expansible et chez 5-7% des patients ayant subi une prothèse valvulaire expansible par ballonnet [10].
On peut supposer intuitivement qu’un bloc de branche gauche complet est de mauvais pronostic en raison de la dyssynchronie ventriculaire associée, en particulier en présence d’une fonction ventriculaire gauche réduite. De même, en cas de bloc de branche gauche iatrogène récent, il existe un risque de progression du trouble de la conduction AV jusqu’à un bloc AV complet.
Dans une méta-analyse, Regueiro et al. un taux plus élevé d’implantation de stimulateur cardiaque chez les patients présentant un nouveau bloc de branche gauche après TAVI (RR 2,18 ; IC 95%, 1,28-3,70 ; p<0,01), une mortalité cardiaque plus élevée (RR 1,39, IC 95%, 1,04-1,86, p=0,03) et un effet négatif sur la fonction de pompage ventriculaire gauche dans la première année après TAVI par rapport aux patients sans nouveau bloc de branche gauche. [11]. Cependant, les données sont contradictoires à cet égard : une autre méta-analyse, par exemple, n’a pas démontré d’augmentation de la mortalité chez les patients présentant un nouveau bloc de branche gauche après TAVI [12].
La mise en place d’un stimulateur cardiaque chez le bon patient au bon moment après un TAVI reste un défi clinique difficile à relever.
Littérature :
- Go AS, Hylek EM, Phillips KA, et al : Prévalence des fibrillations auriculaires diagnostiquées chez les adultes. Jama 2001 ; 285 : 2370.
- Kalra R, Patel N, Doshi R, et al. : Évaluation de l’incidence de la fibrillation atriale à nouveaux enclenchements après le remplacement d’une valve aortique. JAMA Intern Med 2019 ; 35294 : 1-9.
- Tarantini G, Mojoli M, Urena M, Vahanian A : Fibrillation atriale chez les patients subissant une implantation de valve aortique transcathéter : épidémiologie, timing, prédicteurs et résultats. Eur Heart J 2017 ; 38 : 285-293.
- Jørgensen TH, Thyregod HGH, Tarp JB, et al : Temporal changes of new-onset atrial fibrillation in patients randomized to surgical or transcatheter aortic valve replacement. Int J Cardiol Elsevier B.V. ; 2017 ; 234 : 16-21.
- Stortecky S, Buellesfeld L, Wenaweser P, et al : Fibrillation atriale et sténose aortique. Circ Cardiovasc Interv 2013 ; 6 : 77-84.
- Kerola T, Eranti A, Aro AL, et al : Risk Factors Associated With Atrioventricular Block. JAMA Netw open 2019 ; 2 : e194176.
- Franzone A, Windecker S : The Conundrum of Permanent Pacemaker Implantation after Transcatheter Aortic Valve Implantation. Circ Cardiovasc Interv 2017 ; 10 : 1-4.
- Roten L, Stortecky S, Scarcia F, et al : Conduction auriculo-ventriculaire après implantation d’une valve aortique par transcathéter et remplacement chirurgical de valve aortique. J Cardiovasc Electrophysiol 2012 ; 23 : 1115-1122.
- Khounlaboud M, Flécher E, Fournet M, et al : Predictors and prognostic impact of new left bundle branch block after operational valve replacement. Arch Cardiovasc Dis Elsevier Masson SAS ; 2017 ; 110 : 667-675.
- Auffret V, Puri R, Urena M, et al : Troubles de la conduction après un remplacement de valve aortique par transcathéter : état actuel et perspectives futures. Circulation 2017 ; 136 : 1049-1069.
- Regueiro A, Altisent OAJ, Trigo M Del, et al : Impact of new-onset left bundle branch block and periprocedural permanent pacemaker implantation on clinical outcomes in patients undergoing transcatheter aortic valve replacement. Circ Cardiovasc Interv 2016 ; 9 : 1-10.
- Ando T, Takagi H : L’impact pronostique du nouveau bloc de branche gauche persistant après l’implantation d’une valve aortique transcathéter : une méta-analyse. Clin Cardiol 2016 ; 39 : 544-550.
- Siontis GCM, Jüni P, Pilgrim T, et al : Predictors of Permanent Pacemaker Implantation in Patients With Severe Aortic Stenosis Undergoing TAVR. J Am Coll Cardiol Elsevier Inc ; 2014 ; 64 : 129-140.
CARDIOVASC 2019 ; 18(5) : 10-12