Environ la moitié des patients atteints d’un NSCLC nouvellement diagnostiqué peuvent bénéficier d’un traitement curatif. C’est au cours des trois premières années qui suivent que la probabilité de récidive est la plus élevée. Il n’existe pas de preuves solides en faveur d’un suivi intensif. En particulier, pas pour un suivi radiologique rapproché.
Le cancer du poumon est la maladie tumorale la plus meurtrière. Ce mauvais pronostic est notamment lié au fait que seuls 50 à 55% environ des patients atteints de cancer bronchique non à petites cellules (CBNPC) sont diagnostiqués à un stade où un traitement potentiellement curatif peut être proposé (stades I à III). En fonction du stade, 30 à 75% des patients opérés à titre curatif subissent une récidive [1–3]. La plupart des rechutes surviennent dans les trois premières années postopératoires [1,4]. Le groupe d’étude Ludwig-Lung a examiné le schéma de rechute dans trois études prospectives [4]. Sur 426 patients dont la rechute a été documentée, seuls 26% avaient une récidive locale. La survie moyenne après une rechute était inférieure à un an [5]. En outre, les patients ayant reçu un traitement curatif pour un CBNPC ont un risque élevé de développer une deuxième tumeur, principalement un nouveau cancer bronchique, une tumeur de la tête et du cou et un cancer de l’œsophage [6]. Les seconds cancers pulmonaires métachrones se produisent avec une incidence de 1 à 9% par an [7–9]. Dans le cas de tumeurs secondaires du poumon survenant de manière métachrone, il existe une chance d’avoir une nouvelle approche thérapeutique potentiellement curative (chirurgie ou radiothérapie stéréotaxique).
Le suivi des patients atteints d’un CBNPC traité à titre curatif vise principalement à détecter une récidive dans une situation où un nouveau traitement curatif permet d’améliorer la survie globale et d’obtenir un gain significatif en termes de qualité de vie. Cela comprend donc aussi bien la détection d’une récidive locale accessible à un nouveau traitement curatif ablatif local (chirurgie ou irradiation stéréotaxique) que la détection de métastases solitaires à distance (en particulier poumons, cerveau, glandes surrénales) qui, chez des patients sélectionnés, peuvent également être réséquées ou irradiées par voie stéréotaxique dans un but curatif. Aucune étude prospective randomisée n’a démontré l’intérêt d’un suivi radiologique structuré en termes de survie globale. Dans cet article de synthèse, nous souhaitons discuter des preuves relatives au suivi et des recommandations de différentes sociétés savantes.
Éléments de preuve sur le suivi du cancer bronchique
Études prospectives randomisées : Moore et al. randomisé 203 patients entre un suivi conventionnel et un suivi par des infirmières spécialisées dans le cancer du poumon [10]. Tous les patients avaient terminé leur traitement curatif et avaient une espérance de vie d’au moins trois mois. Le suivi conventionnel comprenait des contrôles ambulatoires tous les deux à trois mois. Le groupe d’intervention a eu un contact mensuel avec un infirmier spécialisé, soit par téléphone, soit lors d’une consultation pour identifier les symptômes de progression de la maladie ou les complications du traitement précédent. Les patients du groupe d’intervention présentaient une diminution statistiquement significative de l’essoufflement, un taux plus faible de neuropathie périphérique et une meilleure qualité de vie à 12 mois. Le groupe d’intervention a également obtenu de bien meilleurs résultats en termes de satisfaction à trois, six et douze mois. La survie moyenne était identique dans les deux groupes, mais le délai moyen jusqu’à la progression symptomatique était plus court dans le groupe d’intervention (6 mois contre 10,2 mois). Cette étude montre qu’un contact plus intensif et structuré avec les patients dans le cadre du suivi est important pour la satisfaction et la qualité de vie des patients et permet de détecter plus tôt les récidives, mais ne modifie pas le pronostic.
Études rétrospectives comparatives : Virgo et al. analysé 182 patients atteints de NSCLC réséqué [11]. Les patients ont été répartis en un groupe avec un suivi intensif (n=120) et un groupe avec un suivi moins intensif (n=62). Même si l’analyse était rétrospective, les groupes étaient largement équilibrés. Cependant, les patients ayant un protocole de suivi plus intensif avaient beaucoup plus de maladies concomitantes. Dans cette étude, un suivi plus intensif – caractérisé par la fréquence et l’étendue des contrôles de laboratoire et radiologiques – n’a pas permis de montrer une amélioration du délai de détection d’une récidive, de métastases ou d’une seconde tumeur. La survie globale n’était pas non plus différente dans les deux groupes.
Nakamura et al. ont étudié rétrospectivement 1398 patients suivis par des chirurgiens thoraciques (n=846) ou des pneumologues (n=552) après résection curative d’un CBNPC [12]. Le suivi par les chirurgiens thoraciques comprenait un examen clinique et une radiographie du thorax un mois après l’opération, puis tous les trois ou quatre mois pendant trois ans. Les pneumologues ont soumis les patients à un scanner thoracique tous les six mois. Les patients ayant bénéficié d’un suivi en chirurgie thoracique avaient une mortalité associée au NSCLC plus élevée (Hazard Radio, HR 1,279). En raison de l’hétérogénéité des groupes, notamment pour les examens radiologiques, ces résultats doivent être interprétés avec prudence.
Younes et Gross ont comparé rétrospectivement un suivi structuré intensif (n=67) à un suivi axé sur les symptômes (n=63) chez des patients ayant subi une résection curative d’un NSCLC [13]. Le suivi intensif comprenait des examens cliniques (semaines 1, 3 et 8, puis tous les deux mois pendant les six premiers mois et tous les trois mois jusqu’à deux ans après l’opération), des radiographies du thorax (semaines 1 et 3, puis à 2, 4, 9, 15 et 24 mois) et des tests de la fonction hépatique (à un et deux ans). Les caractéristiques cliniques des deux groupes étaient comparables. Ni la survie sans maladie ni la survie globale n’étaient significativement différentes. Chez la plupart des patients, une récidive ou une métastase a été diagnostiquée sur la base des symptômes cliniques.
Études à un bras : dans le cadre d’une étude prospective menée à l’hôpital universitaire de Bâle, 563 patients ont été suivis pendant dix ans après la résection curative d’un NSCLC au moyen de contrôles cliniques et d’examens radiologiques du thorax [14]. L’intervalle de suivi était de trois mois pendant deux ans, de six mois pendant trois années supplémentaires et d’un an de 6 à 10 ans. Ce suivi a permis à 3,1% des patients de bénéficier d’une autre option de traitement à visée curative. Environ un tiers des patients présentant une récidive ont été diagnostiqués sur la base de symptômes et non dans le cadre d’un suivi structuré. Cette étude a également examiné les coûts du suivi structuré. Ils ont été estimés à 90 000 francs suisses par année de vie gagnée.
Walsh et al. ont montré, sur une cohorte de 358 patients, que le diagnostic précoce d’une récidive chez des patients asymptomatiques n’améliorait pas le pronostic [15]. Westeel et al. ont présenté les données d’un programme de suivi intensif comprenant une bronchoscopie et une tomodensitométrie des poumons, du foie et des surrénales tous les six mois [16]. Chez 192 patients atteints de NSCLC ayant subi une résection curative, le taux de récidive était de 71%. Chez 26% des patients, la récidive a été découverte grâce au suivi structuré. Le taux de survie à trois ans était de 31% chez les patients asymptomatiques.
Une étude asiatique a examiné un suivi structuré par scanner [17]. 986 patients atteints de NSCLC réséqué (48% de stade I) ont été évalués rétrospectivement. Les patients ont été suivis à un intervalle de trois mois pendant les deux premières années, puis à un intervalle de quatre mois jusqu’à cinq ans après l’opération. Des examens TDM avec contraste renforcé ont été effectués tous les trois mois pendant deux ans, puis tous les six mois. De plus, un an après l’opération et en cas de suspicion de récidive, un PET/CT a été réalisé. Dans cette étude, le taux de récidives symptomatiques était faible (18%). 50% des récidives étaient locorégionales et 39% des patients ont subi une seconde résection curative. La survie médiane après la récidive était de 43,6 mois. Ces très bons résultats doivent être interprétés avec prudence, notamment parce qu’il s’agit d’une population asiatique et qu’en conséquence, de nombreux non-fumeurs ont été inclus, qui présentent une biologie tumorale différente (par exemple, plus de mutations EGFR) et ont également un risque plus faible de seconds cancers.
Hanna et al. ont étudié l’intérêt d’une tomodensitométrie à dose minimale (MnDCT) chez 271 patients après résection d’un NSCLC [18]. Les patients ont été suivis par un MnDCT et une radiographie conventionnelle du thorax aux mois 3, 6, 12, 18, 24, 36, 48 et 60 après l’opération. Les résultats suspects ont été examinés de manière plus approfondie à l’aide d’un scanner conventionnel et de biopsies. Le MnDCT était plus sensible (94% vs. 21%, p<0,0001) et avait une valeur prédictive négative plus élevée (99% vs. 96%, p=0,007). Au total, une récidive a été diagnostiquée chez 23,2% des patients, dont 78% étaient asymptomatiques. La survie médiane chez 37 patients soumis à un autre traitement curatif était de 69 mois. Il s’agit d’excellents résultats dans un groupe de patients sélectionnés, sans comparaison avec un groupe bénéficiant d’un suivi tumoral moins intensif.
Preuves de l’utilisation du PET/CT dans les soins postopératoires
Le principal problème lié à l’utilisation du PET/CT dans le cadre du suivi est lié aux modifications inflammatoires postopératoires dans le thorax, qui peuvent entraîner des résultats faussement positifs, car ces modifications sont souvent associées à une forte accumulation de FDG. De telles modifications inflammatoires peuvent encore être présentes six mois après l’opération [19]. Le taux de faux positifs à ce stade précoce est supérieur à 10% [20]. Ce problème est encore plus prononcé après une radiothérapie locale [21,22]. Un avantage potentiel du PET/CT est la détection précoce des métastases à distance. Il convient de préciser que la pertinence du PET/CT est limitée dans la détection des métastases cérébrales, un site fréquent de récidive. Le PET/CT a également une utilité potentielle dans la détection précoce des secondes tumeurs. Cependant, une étude prospective non randomisée n’a pas trouvé d’avantage au PET/CT par rapport aux examens radiologiques traditionnels dans le suivi des NSCLC. L’exposition aux radiations du PET/CT (environ 11 mSV) est nettement supérieure à celle d’un scanner thoracique “à faible dose” (2 mSV) ou d’une radiographie conventionnelle du thorax (0,05 mSV) [20,23]. En outre, les coûts sont également beaucoup plus élevés. A cela s’ajoutent les coûts liés à la poursuite des investigations en cas de faux positifs. Jusqu’à présent, aucune étude n’a montré de bénéfice du PET/CT dans le suivi en termes de survie ou de qualité de vie.
Recommandations actuelles des sociétés savantes
La plupart des sociétés savantes recommandent des contrôles cliniques réguliers et une radiographie conventionnelle du thorax ou un scanner thoracique (tab. 1). Dans la pratique clinique quotidienne, de nombreux médecins ne respectent pas ces recommandations et effectuent des contrôles d’imagerie supplémentaires par PET/CT ou IRM [24]. Il est intéressant de noter que, dans une enquête menée par la Société de chirurgie thoracique, seul un petit pourcentage de médecins considère que leur comportement dans le suivi des tumeurs est susceptible d’apporter un avantage de survie aux patients [25,26].
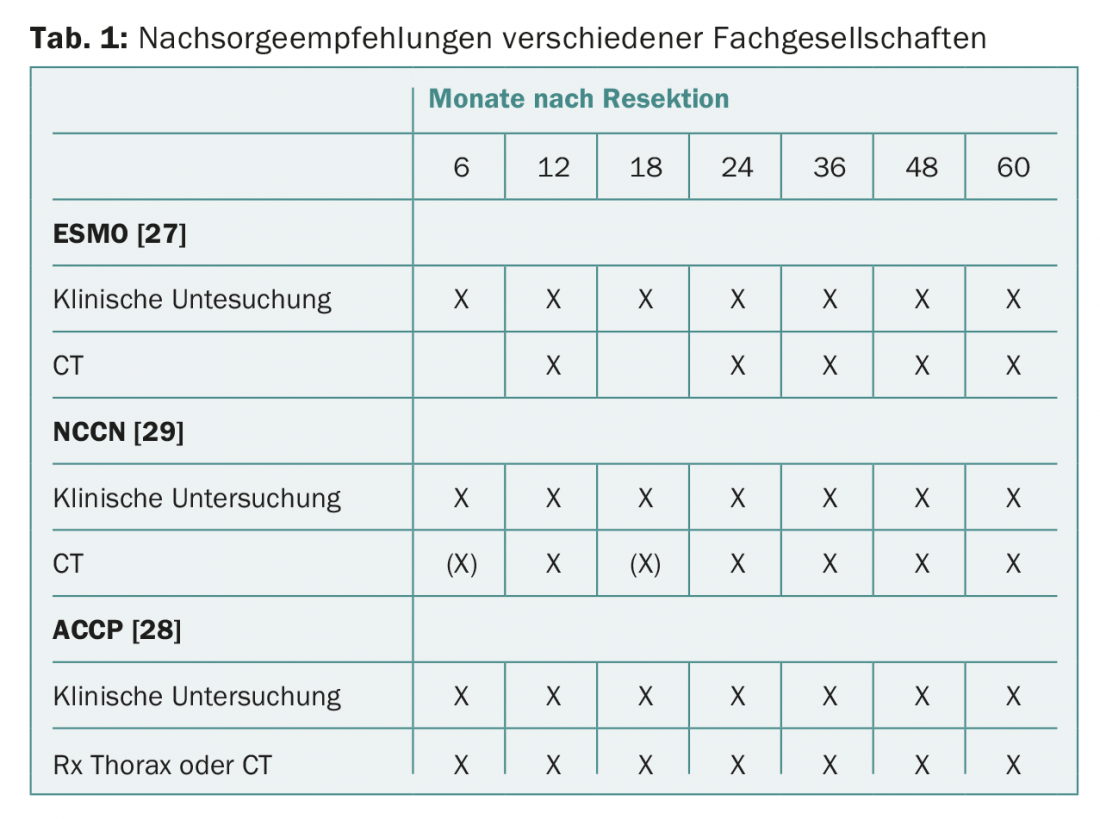
Les directives de l’ESMO (European Society for Medical Oncology) recommandent un contrôle clinique tous les trois à six mois pendant les deux à trois premières années, puis tous les ans. En ce qui concerne l’imagerie, des radiographies thoraciques et un scanner thoracique annuel sont recommandés [27].
L’American College of Chest Physicians (ACCP) recommande que les patients ayant subi une résection curative d’un NSCLC soient suivis par scanner thoracique tous les six mois pendant les deux premières années, puis tous les ans par la suite. La réalisation d’examens TEP dans le cadre d’un suivi n’est pas recommandée [28].
Les recommandations du NCCN (National Comprehensive Cancer Network) sur le cancer bronchique proposent des examens cliniques et un scanner thoracique avec ou sans contraste tous les six à douze mois pendant deux ans, puis un scanner annuel sans contraste [29]. Le PET ou l’IRM du crâne ne sont pas recommandés.
Résumé
Malgré les avantages potentiels d’un suivi intensif et basé sur l’imagerie pour la détection précoce des récidives locales qui peuvent être abordées à nouveau de manière curative et la détection précoce des secondes tumeurs, il existe peu de preuves en faveur de l’utilisation systématique d’examens allant au-delà d’un examen physique périodique et d’une radiographie conventionnelle du thorax. Aucune étude de suivi n’a montré d’amélioration de la survie ou de la qualité de vie des patients atteints de NSCLC. La plupart de ces études sont rétrospectives et présentent de nombreuses limitations. Les examens radiologiques supplémentaires sont parfois très coûteux. Plusieurs études ont montré qu’un suivi intensif n’est pas rentable [11,14]. En outre, il convient de mentionner ici qu’un recours accru aux examens radiologiques sensibles dans le cadre du suivi augmente le risque de faux positifs, ce qui nécessite des examens supplémentaires, ce qui représente une charge pour les patients et génère des coûts supplémentaires.
La majorité des patients atteints de NSCLC opérés dans une intention curative sont âgés et présentent des pathologies associées. Beaucoup sont des fumeurs actifs ou d’anciens fumeurs. Ces points justifient des consultations médicales régulières. Malgré le manque de preuves, la plupart des sociétés savantes recommandent, en plus d’un examen clinique, l’utilisation d’un scanner thoracique tous les trois à six mois. Il existe un besoin important d’études prospectives pour évaluer la place des examens radiologiques dans le suivi des patients. En dehors des protocoles d’étude, nous recommandons que le suivi se limite essentiellement à des contrôles cliniques et à une radiographie conventionnelle du thorax. Il est important de discuter avec les patients de l’importance et de la mise en œuvre du suivi. Un aspect important du suivi est en outre de motiver les patients à arrêter de fumer. Les patients qui continuent à fumer ont un risque accru de rechute, un risque plus élevé d’apparition d’une deuxième tumeur, une mortalité non cancéreuse accrue et une survie globale moins bonne [30–32].
Messages Take-Home
- Seule la moitié environ des patients atteints d’un cancer bronchique non à petites cellules (CBNPC) nouvellement diagnostiqué peut bénéficier d’un traitement curatif.
- La probabilité de rechute après un traitement curatif du NSCLC est de 30 à 75% en fonction du stade et est la plus élevée au cours des trois premières années.
- Il n’existe pas de preuves solides en faveur d’un suivi intensif après un NSCLC traité de manière curative, en particulier d’un suivi radiologique rapproché. En cas de récidive, la plupart des patients ne peuvent plus être traités de manière curative.
- Le suivi doit essentiellement comprendre des contrôles cliniques de l’évolution, des radiographies conventionnelles du thorax et éventuellement des examens par scanner.
Littérature :
- Martini N, et al : Incidence de la récidive locale et des secondes tumeurs primaires dans les cancers du poumon de stade I réséqués. J Thorac Cardiovasc Surg 1995 ; 109 : 120-129.
- al-Kattan K, et al : Récurrence de la maladie après résection pour cancer du poumon de stade I. Eur J Cardiothorac Surg 1997 ; 12(3) : 380-384.
- Martin J, et al : Long-term results of combined-modality therapy in resectable non-small-cell lung cancer. J Clin Oncol 2002 ; 20 : 1989-1995.
- Aucun auteur n’est cité : Patterns of failure in patients with resected stage I and II non-small-cell carcinoma of the lung. Le groupe d’étude Ludwig Lung Cancer. Ann Surg 1987 ; 205 : 67-71.
- Sugimura H, et al : Survival after recurrent nonsmall-cell lung cancer after complete pulmonary resection. Ann Thorac Surg 2007 ; 83 : 409-417.
- Thomas P, Rubinstein L : Récurrence du cancer après résection : cancer du poumon non à petites cellules T1 N0. Groupe d’étude sur le cancer du poumon. Ann Thorac Surg 1990 ; 49(2) : 242-247.
- Johnson BE : Second Lung Cancers in Patients After Treatment for an Initial Lung Cancer. J Natl Cancer Inst 1998 ; 90 : 1335-1345.
- Deschamps C, et al : Multiple primary lung cancers. Résultats du traitement chirurgical. J Thorac Cardiovasc Surg 1990 ; 99 : 769-777.
- Martini N, Melamed MR : Cancers pulmonaires primaires multiples. J Thorac Cardiovasc Surg 1975 ; 70 : 606-612.
- Moore S, et al : Nurse led follow up and conventional medical follow up in management of patients with lung cancer : randomised trial. BMJ 2002 ; 325 : 1145.
- Virgo KS, et al : Post-treatment management options for patients with lung cancer. Ann Surg 1995 ; 222 : 700-710.
- Nakamura R, et al : Suivi postopératoire pour les patients atteints de cancer du poumon non à petites cellules. Oncologie 2010 ; 33 : 14-18.
- Younes RN, Gross JL : Suivi du cancer du poumon à quelle fréquence et dans quel but ? Chest 1999 ; 115 : 1494-1499.
- Egermann U, et al : Suivi régulier après résection curative du cancer du poumon à petites cellules : un réel bénéfice pour les patients ? Eur Respir J 2002 ; 19 : 464-468.
- Walsh GL, et al : Is follow-up of lung cancer patients after resection medically indicated and cost-effective ? Ann Thorac Surg 1995 ; 60 : 1563-1570.
- Westeel V, et al : Pertinence d’un suivi postopératoire intensif après chirurgie pour le cancer du poumon non à petites cellules. Ann Thorac Surg 2000 ; 70 : 1185-1190.
- Song IH, et al : Facteurs pronostiques pour la survie post-récurrence chez les patients atteints de cancer du poumon non à petites cellules de stade I entièrement réséqué. Eur J Cardiothorac Surg 2014 ; 45 : 262-267.
- Hanna WC, et al : Minimal-dose computed tomography is superior to chest x-ray for the follow-up and treatment of patients with resected lung cancer. J Thorac Cardiovasc Surg 2014 ; 147 : 30-33.
- Kanzaki R, et al : Valeur clinique de la tomographie par émission de positons F18-fluorodéoxyglucose-computed tomography chez les patients atteints de cancer du poumon non à petites cellules après une chirurgie potentiellement curative : expérience avec 241 patients. Interact Cardiovasc Thorac Surg 2010 ; 10 : 1009-1014.
- Choi SH, et al : Tomographie par émission de positrons – tomographie assistée par ordinateur pour la surveillance postopératoire dans le cancer du poumon non à petites cellules. Ann Thorac Surg 2011 ; 92 : 1826-1832 ; discussion 1832.
- Dahele M, et al : Modifications radiologiques après radiothérapie stéréotaxique pour cancer du poumon de stade I. J Thorac Oncol 2011 ; 6 : 1221-1228.
- Huang K, et al : Changements radiographiques après radiothérapie stéréotaxique ablative pulmonaire (SABR) – Peut-on distinguer la récidive de la fibrose ? A systematic review of the literature. Radiother Oncol 2012 ; 102 : 335-342.
- Brix G, et al. : Exposition aux radiations des patients subissant des examens TEP/TDM en double modalité 18F-FDG sur l’ensemble du corps. J Nucl Med 2005 ; 46 : 608-613.
- Edelman MJ, Schuetz J : Suivi des cancers du poumon non à petites cellules localisés (stade I et stade II) après résection chirurgicale. Curr Treat Options Oncol 2002 ; 3 : 67-73.
- Naunheim KS, et al : Test de surveillance clinique après une opération du cancer du poumon. Ann Thorac Surg 1995 ; 60 : 1612-1616.
- Virgo KS, et al : Suivi des patients atteints de cancer du poumon : motivation des chirurgiens thoraciques. Chest 1998 ; 114 : 1519-1534.
- Vansteenkiste J, et al : 2nd ESMO Consensus Conference on Lung Cancer : early stage non-small cell lung cancer consensus on diagnosis, treatment and follow-up. Ann Oncol 2014 août ; 25(8) : 1462-1474.
- Colt HG, et al : Follow-up and surveillance of the patient with lung cancer after curative-intent therapy : Diagnosis and management of lung cancer, 3rd ed : American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013 ; 143 : e437S-54S.
- National Comprehensive Cancer Network (Réseau national de cancérologie) : NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) ; Non-Small Cell Lung Cancer. Non-Small Cell Lung Cancer (version 5 ; 2017).
- Warren GW, et al : Smoking at diagnosis and survival in cancer patients. Int J Cancer 2013 ; 132 : 401-410.
- Park SM, et al : Prediagnosis smoking, obesity, insulin resistance, and second primary cancer risk in male cancer survivors : National Health Insurance Corporation Study. J Clin Oncol 2007 ; 25 : 4835-4843.
- Gajdos C, et al : Effets adverses du tabagisme sur les résultats postopératoires chez les patients cancéreux. Ann Surg Oncol 2012 ; 19 : 1430-1438.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(3) : 18-21