La prévalence de la maladie hépatique non alcoolique (NAFLD) et du diabète de type 2 est en augmentation dans le monde entier. L’obésité, la dyslipidémie et la résistance à l’insuline sont des facteurs de risque majeurs de la NAFLD et de la stéatohépatite (NASH). Un dépistage ciblé et des mesures adéquates permettent de réduire les conséquences et les complications spécifiques au foie et au diabète.
La stéatose hépatique non alcoolique (NAFLD) est la cause la plus fréquente de maladie chronique du foie en Europe et aux États-Unis [1]. La NAFLD est considérée comme une manifestation hépatique du syndrome métabolique, mais elle peut également survenir indépendamment de celui-ci. L’obésité est considérée comme un facteur de risque commun pour la NAFLD et le diabète de type 2 (Aperçu 1). “Dans le collectif des diabétiques de type 2, la prévalence de la NAFLD est deux fois plus élevée que dans la population générale”, explique le PD Dr. med. Thomas Karrasch de l’hôpital universitaire de Giessen et Marburg (D) en se référant à une étude publiée dans le Journal Diabetes Care [22,23]. D’une part, le diabète favorise la progression de la NAFLD vers la stéatohépatite non alcoolique (NASH) et augmente le risque de cirrhose et de carcinome hépatocellulaire, d’autre part, la NAFLD est associée à un risque accru de développer un diabète de type 2 [5].
Le risque de progression de la maladie du foie gras est accru
Environ 30% des personnes atteintes de NAFLD ont une NASH et environ 10-20% des cirrhoses et des différentes formes de carcinome hépatocellulaire (CHC) sont attribuées à la NAFLD [2,3]. L’augmentation de l’incidence du CHC observée dans les pays occidentaux industrialisés a été attribuée, entre autres, à l’augmentation de la NAFLD et de la NASH [4]. Dans une étude, les diabétiques de type 2 présentaient un risque deux fois plus élevé de progression de la NAFLD [7]. Des études récentes menées dans le cadre de l’étude allemande sur le diabète indiquent que le sous-type de diabète sévèrement insulino-résistant en particulier présente une augmentation plus importante des marqueurs de substitution de la fibrose au cours des 5 premières années suivant le diagnostic de diabète [6]. La détection des patients atteints de NAFLD présentant une constellation de risques pour le développement d’un CHC va gagner en importance dans les années à venir, selon la conclusion correspondante de la version de consultation du guide S3 “Diagnostic et traitement du carcinome hépatocellulaire et du carcinome biliaire”, publiée en 2021. Il convient d’identifier un risque accru de CHC à l’aide de marqueurs prédictifs et de le surveiller dans le cadre d’un dépistage précoce [8]. Selon les lignes directrices allemandes de la NAFLD, une combinaison de systèmes de diagnostic en laboratoire et d’évaluation démographique ainsi que de diagnostics non invasifs peut être utilisée à cet effet [3,10].
|
Les choses bougent actuellement dans le domaine de la recherche de possibilités médicamenteuses pour le traitement de la NAFLD. Différents concepts thérapeutiques sont testés expérimentalement et cliniquement, de sorte que des recommandations thérapeutiques spécifiques pour le nombre croissant de patients atteints de NAFLD et de diabète devraient voir le jour dans un avenir proche [2,19]. Selon une revue publiée en 2021 dans le Journal Expert Review of Clinical Pharmacology , parmi les substances actives actuellement étudiées, l’acide obéticholique présente les résultats intermédiaires les plus prometteurs dans les études de phase III [15]. |
Détection précoce : l’indice FIB-4 et le NFS comme scores non invasifs
Les patients aux premiers stades de la NAFLD sont généralement asymptomatiques. Des scores de substitution tels que l’indice de fibrose 4 (FIB-4) et le score de fibrose spécifique à la NAFLD (NFS) ont été introduits pour détecter les patients à risque [11]. Le NFS prend en compte l’âge, l’indice de masse corporelle (IMC), le diabète sucré/la glycémie à jeun perturbée, le nombre de plaquettes, l’albumine et le quotient de dérégulation (AST/ALT) [12]. Alors que le score FIB-4 est plus facile à calculer à partir des paramètres d’âge, d’AST, d’ALT et de numération plaquettaire, sa valeur prédictive positive n’est que de 65%, contre environ 90% dans le cas du PRN [11]. Ces méthodes non invasives peuvent être utilisées comme tests complémentaires pour déterminer la stéatose et la fibrose hépatiques.
FibroScan® et CAP : des méthodes de diagnostic à haute sensibilité
Sur le plan du diagnostic de laboratoire, une augmentation de l’alanine aminotransférase (ALT, GPT) alors que l’aspartate aminotransférase (AST, GOT) est normale peut indiquer une NAFLD, bien que jusqu’à deux tiers des patients atteints de NAFLD aient des enzymes hépatiques normales [13,14]. Une échographie du foie peut révéler une stéatohépatite, mais ne permet pas de distinguer la NAFLD de la NASH [11]. Les paramètres d’atténuation contrôlée (CAP), l’élastographie transitoire (FibroScan®) ou l’imagerie par résonance magnétique (IRM) du foie ont une sensibilité supérieure à celle de l’échographie [10]. CAP est une méthode non invasive de quantification de la NASH basée sur l’élastographie transitoire, une technique qui utilise des ultrasons et des ondes élastiques à basse fréquence dont la vitesse de propagation est étroitement liée à la rigidité des tissus [11].
IRM pour quantifier la teneur en graisse du foie
Les techniques d’IRM non invasives permettent de déterminer avec précision la teneur en graisse du foie et sont aujourd’hui préférées à la biopsie hépatique pour quantifier la teneur en graisse [2]. Cependant, la biopsie du foie reste la méthode la plus appropriée pour diagnostiquer les changements inflammatoires dans le cadre de la NASH et est également considérée comme un guide pour le diagnostic de la fibrose hépatique.
Pour établir un diagnostic de NAFLD avec certitude, il faut que la stéatose hépatique soit prouvée par imagerie (sonographie, imagerie par résonance magnétique) ou par histologie hépatique. Le critère de NAFL est un taux d’hépatocytes obèses de 5% ou plus [16]. Le diagnostic différentiel consiste à exclure une consommation excessive d’alcool (consommation d’alcool chez les femmes <20 g/jour, chez les hommes <30 g/jour) ainsi que d’autres causes de lésions hépatiques telles que l’hépatite virale, la stéatohépatite alcoolique (ASH) et la stéatohépatite associée à la drogue (DASH) [17].
| Lien physiopathologique entre les troubles métaboliques et la NASH
La physiopathologie de la NASH repose sur une lésion des hépatocytes induite par les lipides, une inflammation médiée par des cellules immunitaires et une fibrose hépatique consécutive [9]. La résistance à l’insuline et l’obésité favorisent une accumulation excessive de graisse dans les hépatocytes, ce qui augmente la sensibilité des hépatocytes au stress oxydatif, aux endotoxines et à l’action des cytokines, ce qui entraîne une inflammation des tissus [11]. Ces événements favorisent le passage d’une simple stéatose à une stéatohépatite, respectivement à une NASH, caractérisée par une stéatose, une infiltration de cellules inflammatoires et une ballonisation des hépatocytes et des nécroses focales [17]. L’inflammation chronique et les dommages au foie peuvent conduire à la cirrhose, à l’insuffisance hépatique et au carcinome hépatocellulaire. |
Réduction du poids pour diminuer le risque de progression
Une réduction du poids corporel est associée à une prévalence plus faible de la NAFL et peut entraîner une réduction de la fibrose en cas de NASH. En conséquence, les changements alimentaires et l’activité physique sont des piliers importants dans le traitement de la NAFLD ainsi que dans la prévention de sa progression. L’efficacité de l’intervention sur le mode de vie dépend de l’ampleur de la réduction de poids obtenue. Une perte de poids d’environ 5% entraîne une diminution d’environ 30% de la teneur en graisse du foie [2]. Une étude prospective menée sur une période de 7 ans a montré qu’une réduction de poids de 5% entraînait une rémission de la maladie chez 75% des patients atteints de NAFLD [18]. Sur le plan nutritionnel, il est recommandé de réduire les glucides à absorption rapide, en particulier les produits contenant du fructose et les acides gras saturés [2]. En complément d’une alimentation équilibrée, une activité physique régulière (combinaison de sport d’endurance et de musculation) peut avoir un effet additif [19]. En cas d’obésité sévère et de diabète de type 2, la chirurgie bariatrique peut entraîner une réduction marquée de la graisse hépatique, parallèlement à la perte de poids.
Quelles sont les implications pharmacothérapeutiques ?
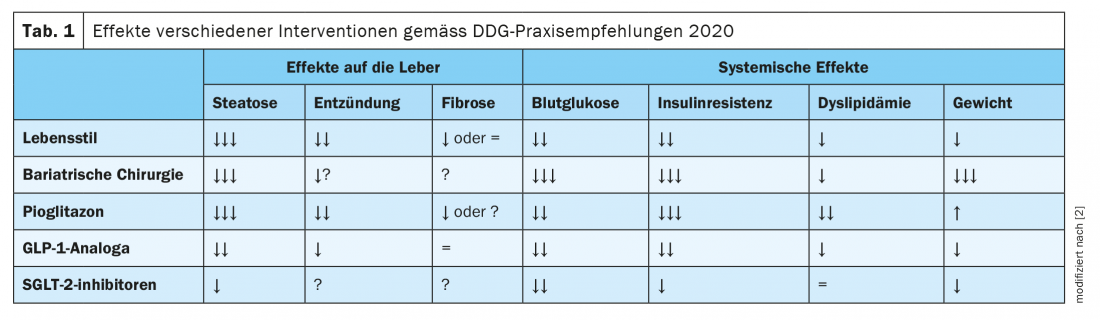
Il est vrai qu’aucun traitement pharmacologique de la NAFLD n’a encore été approuvé. En présence d’un diabète de type 2, il est toutefois possible d’utiliser des médicaments ciblés pour traiter le diabète, qui ont également un effet bénéfique sur la NAFLD. Les recommandations communes de l’European Association for the Study of the Liver (EASL), de l’European Association for the Study of Diabetes (EASD) et de l’European Association for the Study of Obesity (EASO) ainsi que celles de l’American Association for the Study of Liver Diseases recommandent l’utilisation de la pioglitazone en l’absence de contre-indications (insuffisance cardiaque, antécédents de carcinome de la vessie, risque accru de fractures osseuses). [19,20]. Des études ont montré des effets favorables sur les paramètres liés à la NAFLD, tant chez les diabétiques que chez les non-diabétiques. “La pioglitazone est actuellement le médicament qui présente les meilleures preuves”, a déclaré le Dr Karrasch [23]. Entre autres, une méta-analyse de huit essais cliniques randomisés portant sur 516 patients présentant une NASH prouvée par biopsie a montré qu’un traitement par thiazolidinedione (rosiglitazone ou pioglitazone) était associé à une amélioration du degré de fibrose et à une réduction de la NASH. Cet effet a également été observé chez les patients non diabétiques [21]. En outre, des études récentes indiquent que les agonistes du GLP-1 (glucagon-like peptide 1), comme le liraglutide, et les inhibiteurs du SGLT-2 (sodium dependent glucose transporter 2) peuvent réduire le taux de graisse hépatique dans la NAFLD et le diabète de type 2 [2]. Les recommandations pratiques de l’Association allemande du diabète (DDG) résument les effets de différentes interventions sur la NAFLD et le diabète ; elles sont présentées dans letableau 1 [2].
Congrès : Réunion annuelle de la DGIM 2021
Littérature :
- Centre allemand de recherche sur le diabète, www.dzd-ev.de/forschung/ursachen-und-behandlung-der-nicht-alkoholischen-fettlebererkrankung-nafld/index.html, (dernière consultation 16.06.2021)
- Stefan N, et al : Diabète et foie gras. Diabétologie 2020 ; 15 (Suppl 1) : S156-S159.
- Roeb E, et al. : [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol, 2015. 53(7) : 668-723.
- Lignes directrices de pratique clinique de l’ASL : Prise en charge du carcinome hépatocellulaire. J Hepatol 2018 ; 69(1) : 182-236.
- Tomah S, Alkhouri N, Hamdy O : Nonalcoholic fatty liver disease and type 2 diabetes : where do the diabetologists stand ? Clin Diabetes Endocrinol 2020 ; 6(9), https://doi.org/10.1186/s40842-020-00097-1
- Zaharia OP, et al : Risk of diabetes-associated diseases in subgroups of patients with recent-onset diabetes : a 5-year follow-up study. Lancet Diabetes Endocrinol 2019 ; 7 : 684-694.
- Simeone JC, et al : Clinical course of nonalcoholic fatty liver disease : an assessment of severity, progression, and outcomes. Clin Epidemiol 2017(9) 679-688.
- AWMF : version de consultation du guide S3 “Diagnostic et traitement du carcinome hépatocellulaire et du carcinome biliaire”, www.leitlinienprogramm-onkologie.de (dernière consultation 16.06.2021)
- Hirsova P, Gores GJ : Death receptor-mediated cell death and proinflammatory signaling in nonalcoholic steatohepatitis. Cell Mol Gastroenterol Hepatol 2015 ; 1 : 17-27
- Roeb E, Geier A : Nonalcoholic steatohepatitis (NASH) – current treatment recommendations and future developments. Z Gastroenterol 2019 ; 57(4) : 508-517.
- Heitmann J, et al. : La stéatose hépatique non alcoolique et le psoriasis – existe-t-il un réseau pro-inflammatoire commun ? JDDG 2021 ; 19(4) : 517-529.
- Sterling RK, et al : Développement d’un indice simple et non invasif pour prédire une fibrose significative chez les patients atteints de coinfection VIH/HCV. Hepatol 2006 ; 43(6) : 1317-1325.
- Weiß J, Rau M, Geier A. Maladie hépatique graisseuse non alcoolique : épidémiologie, évolution clinique, investigation et traitement. Dtsch Arztebl Int 2014 ; 111 : 447-452.
- Dowman JK, Tomlinson JW, Newsome PN : Systematic review : the diagnosis and staging of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther 2011 ; 33 : 525-540.
- Rau M, Geier A : An update on drug development for the treatment of nonalcoholic fatty liver disease – from ongoing clinical trials to future therapy. Expert Review of Clinical Pharmacology 2021 ; 14(3) : 333-340.
- Roeb E : Non-alkoholische Steatohepatitis : Fettleber mit Komplikationen | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de), https://www.pharmazeutische-zeitung.de/ausgabe-342018/fettleber-mit-komplikationen/, (dernière consultation 16.06.2021)
- Rau M, Geier A : Maladie du foie, Nonalcoholic Fatty. Dans : Kuipers E : Encyclopedia of Gastroenterology. 2ème édition. Oxford : Academic Press, Elsevier 2020 : 408-413.
- Zelber-Sagi S, et al : Predictors for incidence and remission of NAFLD in the general population during a seven-year prospective follow-up. J Hepatol 2012 ; 56 : 1145-1151.
- Stefan N, Häring HU, Cusi K : Maladie hépatique graisseuse non alcoolique : causes, diagnostic, conséquences cardiométaboliques et stratégies de traitement. Lancet Diabetes Endocrinol 2019 ; 7 : 313-324.
- Association européenne pour l’étude du foie (EASL) ; Association européenne pour l’étude du foie (EASL) ; Association européenne pour l’étude du diabète (EASD) ; Association européenne pour l’étude de l’obésité (EASO). EASL-EASD-EASO Clinical practice guidelines for the management of non-alcoholic fatty liver disease. Diabetologia 2016 ; 59 : 1121-1140.
- Musso G, et al : Thiazolidinediones and Advanced Liver Fibrosis in Nonalcoholic Steatohepatitis : A Meta-analysis. JAMA Intern Med 2017 ; 177(5) : 633-640.
- Eslam M, et al : A new definition for metabolic dysfunction-associated fatty liver disease : An international expert consensus statement. J Hepatol 2020 ; 73(1) : 202-209.
- Karrasch T : NASH/NAFLD d’un point de vue endocrinologique et diabétologique. PD Dr. med. Thomas Karrasch. Réunion annuelle de la DGIM, 20.04.2021.
HAUSARZT PRAXIS 2021 ; 16(3) : 45-46 (publié le 29.6.21, ahead of print)