La prevalenza della malattia epatica non alcolica (NAFLD) e del diabete di tipo 2 è in aumento in tutto il mondo. L’obesità, la dislipidemia e l’insulino-resistenza sono i principali fattori di rischio per la NAFLD e la steatoepatite (NASH). Uno screening mirato e misure adeguate possono ridurre le conseguenze e le complicanze specifiche del fegato e del diabete.
La malattia del fegato grasso non alcolica (NAFLD) è la causa più comune di malattia epatica cronica in Europa e negli Stati Uniti [1]. La NAFLD è considerata una manifestazione epatica della sindrome metabolica, ma può anche manifestarsi in modo indipendente. L’obesità è considerata un fattore di rischio comune per la NAFLD e il diabete di tipo 2 (Panoramica 1) . “Nel gruppo dei diabetici di tipo 2, la prevalenza della NAFLD è doppia rispetto alla popolazione generale”, spiega il PD Dr. med. Thomas Karrasch dell’Ospedale Universitario di Giessen e Marburgo (D) riferendosi a uno studio pubblicato sulla rivista Diabetes Care [22,23]. Da un lato, il diabete favorisce la progressione della NAFLD verso la steatoepatite non alcolica (NASH) e aumenta il rischio di cirrosi e di carcinoma epatocellulare; dall’altro, la NAFLD è associata a un rischio maggiore di sviluppare il diabete di tipo 2 [5].
Il rischio di progressione della malattia del fegato grasso è aumentato.
Circa il 30% delle persone affette da NAFLD ha la NASH e circa il 10-20% della cirrosi e delle varie forme di carcinoma epatocellulare (HCC) sono attribuite alla NAFLD [2,3]. L’aumento osservato dell’incidenza del carcinoma epatocellulare nei Paesi industrializzati occidentali è attribuito, tra l’altro, all’aumento della NAFLD e della NASH [4]. In uno studio, i diabetici di tipo 2 avevano un rischio doppio di progressione della NAFLD [7]. Studi recenti del German Diabetes Study indicano che soprattutto il sottotipo di diabete gravemente insulino-resistente mostra un aumento maggiore dei marcatori surrogati di fibrosi nei primi 5 anni dopo la diagnosi di diabete [6]. L’individuazione dei pazienti con NAFLD con una costellazione di rischio per lo sviluppo di HCC acquisterà importanza nei prossimi anni, secondo la relativa conclusione della versione di consultazione della linea guida S3 “Diagnostica e terapia del carcinoma epatocellulare e del carcinoma biliare”, pubblicata nel 2021. È importante identificare un aumento del rischio di HCC sulla base di marcatori predittivi e monitorarlo nel contesto della diagnosi precoce [8]. Secondo la linea guida tedesca sulla NAFLD, a questo scopo si può utilizzare una combinazione di sistemi di valutazione di laboratorio e demografici e di diagnostica strumentale non invasiva [3,10].
|
Attualmente sono in corso molte ricerche sulle opzioni farmacologiche per il trattamento della NAFLD. Si stanno testando diversi concetti terapeutici a livello sperimentale e clinico, in modo che nel prossimo futuro si possano prevedere raccomandazioni terapeutiche specifiche per il numero crescente di pazienti con NAFLD e diabete [2,19]. Secondo una revisione pubblicata nel 2021 sulla rivista Expert Review of Clinical Pharmacology , tra i principi attivi attualmente oggetto di ricerca, l’acido obeticolico mostra i risultati intermedi più promettenti negli studi di fase III [15]. |
Diagnosi precoce: indice FIB-4 e NFS come punteggi non invasivi
I pazienti nelle fasi iniziali della NAFLD sono solitamente asintomatici. Per individuare i pazienti a rischio sono stati introdotti punteggi surrogati come l’indice di fibrosi-4 (FIB-4) e il punteggio di fibrosi specifico per la NAFLD (NFS) [11]. L’NFS prende in considerazione l’età, l’indice di massa corporea (BMI), il diabete mellito/glucosio a digiuno alterato, la conta piastrinica, l’albumina e il quoziente di de-ritenzione (AST/ALT) [12]. Mentre il punteggio FIB-4 è più facile da calcolare utilizzando i parametri di età, AST, ALT e conta piastrinica, il suo valore predittivo positivo è solo del 65% rispetto al 90% circa del NCCR [11]. Queste procedure non invasive possono essere utilizzate come test complementari per determinare la steatosi epatica e la fibrosi.
FibroScan® e CAP: procedure diagnostiche ad alta sensibilità
La diagnosi di laboratorio di NAFLD può essere indicata dall’elevazione dell’alanina aminotransferasi (ALT, GPT) con aspartato aminotransferasi (AST, GOT) normale, anche se fino a due terzi dei pazienti con NAFLD hanno enzimi epatici normali [13,14]. La sonografia del fegato può rivelare la steatoepatite, ma non può distinguere tra NAFLD e NASH [11]. Il Parametro di Attenuazione Controllata (CAP), l’elastografia transitoria (FibroScan®) o la risonanza magnetica (RM) del fegato hanno una sensibilità maggiore rispetto all’ecografia [10]. La CAP è un metodo non invasivo per quantificare la NASH basato sull’elastografia transitoria, una tecnica che utilizza ultrasuoni e onde elastiche a bassa frequenza, la cui velocità di propagazione è strettamente correlata alla rigidità del tessuto [11].
Risonanza magnetica per la quantificazione del contenuto di grasso nel fegato
Le tecniche di risonanza magnetica non invasive consentono di determinare con precisione il contenuto di grasso del fegato e sono oggi preferite alla biopsia epatica per la quantificazione del contenuto di grasso [2]. Tuttavia, la biopsia epatica è ancora il metodo più appropriato per diagnosticare le alterazioni infiammatorie nel contesto della NASH ed è anche considerata innovativa per la diagnosi della fibrosi epatica.
Una diagnosi confermata di NAFLD richiede l’evidenza di un fegato grasso attraverso la diagnostica per immagini (ecografia, risonanza magnetica) o l’istologia epatica. Il criterio per la NAFL è una proporzione del 5% o più di epatociti grassi [16]. La diagnosi differenziale deve escludere il consumo eccessivo di alcol (assunzione di alcol nelle donne <20 g/giorno, negli uomini <30 g/giorno) e altre cause di danno epatico come l’epatite virale, la steatoepatite alcolica (ASH) e la steatoepatite associata ai farmaci (DASH) [17].
| Legame fisiopatologico tra disturbi metabolici e NASH
Dal punto di vista fisiopatologico, la NASH si basa sul danno epatocitario indotto dai lipidi, sull’infiammazione mediata dalle cellule immunitarie e sulla conseguente fibrosi epatica [9]. L’insulino-resistenza e l’obesità favoriscono l’accumulo eccessivo di grasso negli epatociti, aumentando la sensibilità degli epatociti allo stress ossidativo, alle endotossine e all’azione delle citochine, con conseguente infiammazione dei tessuti [11]. Questi eventi promuovono la transizione dalla semplice steatosi alla steatoepatite e alla NASH, rispettivamente, che è caratterizzata da steatosi, infiltrazione di cellule infiammatorie e palloncino degli epatociti e necrosi focale [17]. L’infiammazione cronica e il danno epatico possono portare a cirrosi, insufficienza epatica e carcinoma epatocellulare. |
Riduzione del peso per ridurre il rischio di progressione
Una riduzione del peso corporeo è associata a una minore prevalenza di NAFL e può portare a una riduzione della fibrosi nella NASH. Di conseguenza, i cambiamenti nella dieta e l’attività fisica sono pilastri importanti nel trattamento della NAFLD e nella prevenzione della progressione. L’efficacia dell’intervento sullo stile di vita dipende dall’entità della riduzione di peso ottenuta. Una perdita di peso di circa il 5% provoca una diminuzione del 30% circa del contenuto di grasso epatico [2]. In uno studio prospettico condotto per un periodo di 7 anni, è stato dimostrato che una riduzione del peso del 5% porta alla remissione della malattia nel 75% dei pazienti con NAFLD [18]. Dal punto di vista nutrizionale, si raccomanda una riduzione dei carboidrati a rapido assorbimento, in particolare dei prodotti contenenti fruttosio e degli acidi grassi saturi [2]. Oltre a una dieta equilibrata, l’attività fisica regolare (combinazione di resistenza e allenamento con i pesi) può avere un effetto additivo [19]. Nei casi di obesità grave e di diabete di tipo 2, la chirurgia bariatrica può portare a una riduzione pronunciata del contenuto di grasso nel fegato, parallelamente alla perdita di peso.
Quali sono le implicazioni farmacoterapeutiche?
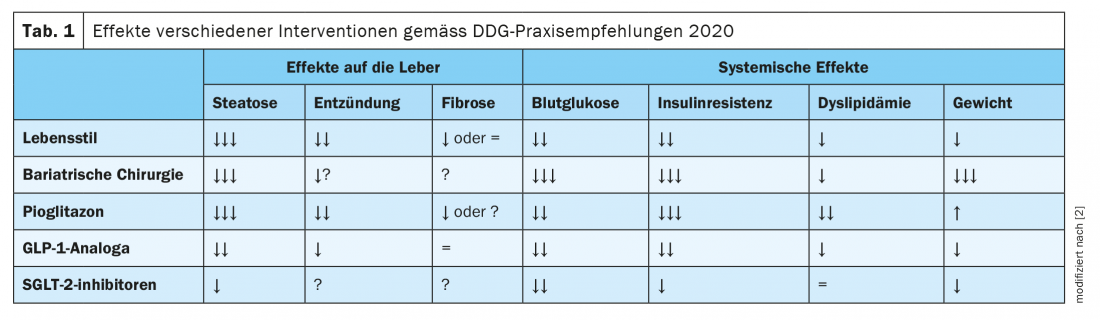
Anche se non è stata ancora approvata alcuna terapia farmacologica per la NAFLD. Tuttavia, se è presente il diabete di tipo 2, si può ricorrere a farmaci mirati per trattare il diabete, che hanno un effetto benefico anche sulla NAFLD. Le linee guida congiunte dell’Associazione Europea per lo Studio del Fegato (EASL), dell’Associazione Europea per lo Studio del Diabete (EASD) e dell’Associazione Europea per lo Studio dell’Obesità (EASO), nonché quelle dell’Associazione Americana per lo Studio delle Malattie del Fegato, raccomandano l’uso di pioglitazone se non ci sono controindicazioni (insufficienza cardiaca, storia di cancro alla vescica, aumento del rischio di fratture ossee). [19,20]. Gli studi hanno dimostrato effetti benefici sui parametri legati alla NAFLD sia nei diabetici che nei non diabetici. “Il pioglitazone è attualmente il farmaco con le migliori evidenze”, afferma il dottor Karrasch [23]. Tra gli altri risultati, una meta-analisi di otto studi clinici randomizzati che hanno coinvolto 516 pazienti con NASH provata da biopsia ha mostrato che la terapia con tiazolidinedioni (rosiglitazone o pioglitazone) era associata a un miglioramento del grado di fibrosi e alla riduzione della NASH. Questo effetto è stato riscontrato anche nei pazienti senza diabete [21]. Inoltre, studi recenti indicano che gli agonisti del GLP-1 (glucagon-like peptide 1), come la liraglutide, e gli inibitori del SGLT-2 (trasportatore di glucosio sodio-dipendente 2) possono ridurre il grasso epatico nella NAFLD e nel diabete di tipo 2 [2]. Le raccomandazioni pratiche della Società Tedesca di Diabetologia (DDG) riassumono gli effetti di diversi interventi sulla NAFLD e sul diabete; questi sono riportati nellatabella 1 [2].
Congresso: Conferenza annuale DGIM 2021
Letteratura:
- Centro tedesco per la ricerca sul diabete, www.dzd-ev.de/forschung/ursachen-und-behandlung-der-nicht-alkoholischen-fettlebererkrankung-nafld/index.html, (ultimo accesso 16.06.2021)
- Stefan N, et al: Diabete e fegato grasso. Diabetologia 2020; 15 (Suppl 1): S156-S159.
- Roeb E, et al: [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol, 2015. 53(7): 668-723.
- Linee guida di pratica clinica ASL: Gestione del carcinoma epatocellulare. J Hepatol 2018; 69(1): 182-236.
- Tomah S, Alkhouri N, Hamdy O: La malattia del fegato grasso non alcolica e il diabete di tipo 2: qual è la posizione dei diabetologi? Clin Diabetes Endocrinol 2020; 6(9), https://doi.org/10.1186/s40842-020-00097-1
- Zaharia OP, et al: Rischio di malattie associate al diabete in sottogruppi di pazienti con diabete di recente insorgenza: uno studio di follow-up di 5 anni. Lancet Diabetes Endocrinol 2019; 7: 684-694.
- Simeone JC, et al: Decorso clinico della malattia del fegato grasso non alcolica: una valutazione della gravità, della progressione e degli esiti. Epidemiologia clinica 2017(9) 679-688.
- AWMF: Versione di consultazione della linea guida S3 “Diagnostica e terapia del carcinoma epatocellulare e dei carcinomi biliari”, www.leitlinienprogramm-onkologie.de (ultimo accesso 16.06.2021)
- Hirsova P, Gores GJ : Morte cellulare mediata dai recettori di morte e segnalazione proinfiammatoria nella steatoepatite non alcolica. Cell Mol Gastroenterol Hepatol 2015; 1: 17-27
- Roeb E, Geier A: Steatoepatite non alcolica (NASH) – raccomandazioni terapeutiche attuali e sviluppi futuri. Z Gastroenterol 2019; 57(4): 508-517.
- Heitmann J, et al: La malattia del fegato grasso non alcolica e la psoriasi – esiste una rete proinfiammatoria comune? JDDG 2021; 19(4): 517-529.
- Sterling RK, et al: Sviluppo di un semplice indice non invasivo per prevedere la fibrosi significativa nei pazienti con coinfezione da HIV/HCV. Hepatol 2006; 43(6): 1317-1325.
- Weiß J, Rau M, Geier A. La malattia del fegato grasso non alcolica: epidemiologia, decorso clinico, indagini e trattamento. Dtsch Arztebl Int 2014; 111: 447-452.
- Dowman JK, Tomlinson JW, Newsome PN: Revisione sistematica: diagnosi e stadiazione della malattia del fegato grasso non alcolica e della steatoepatite non alcolica. Aliment Pharmacol Ther 2011; 33: 525-540.
- Rau M, Geier A: Un aggiornamento sullo sviluppo di farmaci per il trattamento della malattia del fegato grasso non alcolica – dagli studi clinici in corso alla terapia futura. Expert Review of Clinical Pharmacology 2021; 14(3): 333-340.
- Roeb E: Steatoepatite non alcolica: fegato grasso con complicazioni | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de), https://www.pharmazeutische-zeitung.de/ausgabe-342018/fettleber-mit-komplikationen/, (ultimo accesso 16.06.2021)
- Rau M, Geier A: Malattia del fegato, Grasso Non Alcolico. In: Kuipers E: Enciclopedia di Gastroenterologia.Seconda edizione. Oxford: Academic Press, Elsevier 2020: 408-413.
- Zelber-Sagi S, et al: Predittori per l’incidenza e la remissione della NAFLD nella popolazione generale durante un follow-up prospettico di sette anni. J Hepatol 2012; 56: 1145-1151.
- Stefan N, Häring HU, Cusi K: La malattia del fegato grasso non alcolica: cause, diagnosi, conseguenze cardiometaboliche e strategie di trattamento. Lancet Diabetes Endocrinol 2019; 7: 313-324.
- Associazione Europea per lo Studio del Fegato (EASL); Associazione Europea per lo Studio del Fegato (EASL); Associazione Europea per lo Studio del Diabete (EASD); Associazione Europea per lo Studio dell’Obesità (EASO). Linee guida di pratica clinica EASL-EASD-EASO per la gestione della malattia del fegato grasso non alcolica. Diabetologia 2016; 59: 1121-1140.
- Musso G, et al: Tiazolidinedioni e fibrosi epatica avanzata nella steatoepatite non alcolica: una meta-analisi. JAMA Intern Med 2017; 177(5): 633-640.
- Eslam M, et al.: Una nuova definizione di malattia del fegato grasso associata a disfunzione metabolica: una dichiarazione di consenso internazionale di esperti. J Hepatol 2020; 73(1): 202-209.
- Karrasch T: NASH/NAFLD da una prospettiva endocrinologica-diabetologica. PD Dr. med. Thomas Karrasch. Conferenza annuale del DGIM, 20.04.2021.
HAUSARZT PRAXIS 2021; 16(3): 45-46 (pubblicato il 29.6.21, prima della stampa).