La prevalencia de la enfermedad hepática no alcohólica (EHNA) y la diabetes de tipo 2 está aumentando en todo el mundo. La obesidad, la dislipidemia y la resistencia a la insulina son los principales factores de riesgo de la HGNA y la esteatohepatitis (EHNA). La detección selectiva y las medidas adecuadas pueden reducir las consecuencias y complicaciones específicas del hígado y relacionadas con la diabetes.
La enfermedad del hígado graso no alcohólico (HGNA) es la causa más común de enfermedad hepática crónica en Europa y EE.UU. [1]. La HGNA se considera una manifestación hepática del síndrome metabólico, pero también puede darse de forma independiente. La obesidad se considera un factor de riesgo común de la HGNA y la diabetes de tipo 2 (Visión general 1) . “En el grupo de diabéticos de tipo 2, la prevalencia del HGNA es el doble que en la población general”, explica el PD Dr. med. Thomas Karrasch del Hospital Universitario de Giessen y Marburg (D) refiriéndose a un estudio publicado en la revista Diabetes Care [22,23]. Por un lado, la diabetes favorece la progresión de la HGNA a esteatohepatitis no alcohólica (EHNA) y aumenta el riesgo de cirrosis y carcinoma hepatocelular; por otro, la HGNA se asocia a un mayor riesgo de desarrollar diabetes de tipo 2 [5].
Aumenta el riesgo de progresión de la enfermedad del hígado graso
Alrededor del 30% de los enfermos de HGNA padecen EHNA y cerca del 10-20% de las cirrosis y diversas formas de carcinoma hepatocelular (CHC) se atribuyen a la HGNA [2,3]. El aumento observado en la incidencia del CHC en los países industrializados occidentales se atribuye, entre otras cosas, al incremento de la HGNA y la EHNA [4]. En un estudio, los diabéticos de tipo 2 tenían el doble de riesgo de progresión de la NAFLD [7]. Estudios recientes del Estudio Alemán de la Diabetes indican que especialmente el subtipo de diabetes con resistencia grave a la insulina muestra un mayor aumento de los marcadores sustitutos de la fibrosis en los primeros 5 años tras el diagnóstico de la diabetes [6]. La detección de pacientes con HGNA con una constelación de riesgo para el desarrollo de CHC ganará en importancia en los próximos años, según la conclusión correspondiente de la versión de consulta de la directriz S3 “Diagnóstico y terapia del carcinoma hepatocelular y los carcinomas biliares” publicada en 2021. Es importante identificar un mayor riesgo de CHC sobre la base de marcadores predictivos y vigilarlo en el contexto de la detección precoz [8]. Según la directriz alemana sobre la NAFLD, puede utilizarse para este fin una combinación de sistemas de evaluación de laboratorio y demográficos y diagnósticos instrumentales no invasivos [3,10].
|
Actualmente se está investigando mucho sobre las opciones farmacológicas para el tratamiento de la NAFLD. Se están probando experimental y clínicamente diferentes conceptos terapéuticos, por lo que en un futuro próximo cabe esperar recomendaciones terapéuticas específicas para el creciente número de pacientes con HGNA y diabetes [2,19]. Según una revisión publicada en 2021 en el Journal Expert Review of Clinical Pharmacology , de las sustancias activas que se investigan actualmente, el ácido obetichólico muestra los resultados provisionales más prometedores en los estudios de fase III [15]. |
Detección precoz: índice FIB-4 y NFS como puntuaciones no invasivas
Los pacientes en las primeras fases de la NAFLD suelen ser asintomáticos. Se han introducido puntuaciones sustitutas como el índice de fibrosis-4 (FIB-4) y la puntuación de fibrosis específica de la NAFLD (NFS) para detectar a los pacientes de riesgo [11]. La ENF tiene en cuenta la edad, el índice de masa corporal (IMC), la diabetes mellitus/glucosa en ayunas alterada, el recuento de plaquetas, la albúmina y el cociente de de-ritis (AST/ALT) [12]. Aunque la puntuación FIB-4 es más fácil de calcular utilizando los parámetros de edad, AST, ALT y recuento de plaquetas, su valor predictivo positivo es sólo del 65%, frente a cerca del 90% en el caso del NCCR [11]. Estos procedimientos no invasivos pueden utilizarse como pruebas complementarias para determinar la esteatosis hepática y la fibrosis.
FibroScan® y CAP: procedimientos diagnósticos de alta sensibilidad
El diagnóstico de laboratorio de la HGNA puede estar indicado por la elevación de la alanina aminotransferasa (ALT, GPT) con una aspartato aminotransferasa (AST, GOT) normal, aunque hasta dos tercios de los pacientes con HGNA tienen enzimas hepáticas normales [13,14]. La ecografía del hígado puede revelar esteatohepatitis pero no distinguir entre NAFLD y NASH [11]. El parámetro de atenuación controlada (CAP), la elastografía transitoria (FibroScan®) o la resonancia magnética (RM) del hígado tienen una mayor sensibilidad que los ultrasonidos [10]. La CAP es un método no invasivo para cuantificar la EHNA basado en la elastografía transitoria, una técnica que utiliza ultrasonidos y ondas elásticas de baja frecuencia cuya velocidad de propagación está estrechamente relacionada con la rigidez del tejido [11].
IRM para la cuantificación del contenido de grasa en el hígado
Las técnicas de IRM no invasivas permiten determinar con precisión el contenido graso del hígado y hoy en día se prefieren a la biopsia hepática para la cuantificación del contenido graso [2]. Sin embargo, la biopsia hepática sigue siendo el método más adecuado para diagnosticar los cambios inflamatorios en la EHNA y también se considera pionera para diagnosticar la fibrosis hepática.
Un diagnóstico confirmado de HGNA requiere pruebas de hígado graso por imagen (ecografía, resonancia magnética) o histología hepática. El criterio para la NAFL es una proporción del 5% o más de hepatocitos grasos [16]. El diagnóstico diferencial debe excluir el consumo excesivo de alcohol (ingesta de alcohol en mujeres <20 g/día, en hombres <30 g/día) y otras causas de daño hepático como la hepatitis vírica, la esteatohepatitis alcohólica (EHA) y la esteatohepatitis asociada a fármacos (EDAF) [17].
| Vínculo fisiopatológico entre los trastornos metabólicos y la EHNA
Fisiopatológicamente, la EHNA se basa en el daño hepatocitario inducido por lípidos, la inflamación mediada por células inmunitarias y la fibrosis hepática consecutiva [9]. La resistencia a la insulina y la obesidad favorecen la acumulación excesiva de grasa en los hepatocitos, aumentando su sensibilidad al estrés oxidativo, a las endotoxinas y a la acción de las citocinas, lo que provoca la inflamación de los tejidos [11]. Estos acontecimientos promueven la transición de la esteatosis simple a la esteatohepatitis y la EHNA, respectivamente, que se caracteriza por esteatosis, infiltración de células inflamatorias y abombamiento de los hepatocitos y necrosis focal [17]. La inflamación crónica y el daño hepático pueden provocar cirrosis, insuficiencia hepática y carcinoma hepatocelular. |
Reducción de peso para reducir el riesgo de progresión
Una reducción del peso corporal se asocia a una menor prevalencia de NAFL y puede conducir a una reducción de la fibrosis en la EHNA. En consecuencia, los cambios dietéticos y la actividad física son pilares importantes en el tratamiento de la NAFLD, así como en la prevención de su progresión. La eficacia de la intervención sobre el estilo de vida depende del grado de reducción de peso alcanzado. Una pérdida de peso de alrededor del 5% provoca aproximadamente una disminución del 30% en el contenido de grasa hepática [2]. En un estudio prospectivo realizado durante un periodo de 7 años, se demostró que una reducción de peso del 5% conduce a la remisión de la enfermedad en el 75% de los pacientes con HGNA [18]. Desde el punto de vista nutricional, se recomienda una reducción de los hidratos de carbono de absorción rápida, especialmente los productos que contienen fructosa y los ácidos grasos saturados [2]. Además de una dieta equilibrada, la actividad física regular (combinación de ejercicios de resistencia y pesas) puede tener un efecto aditivo [19]. En casos de obesidad grave y diabetes de tipo 2, la cirugía bariátrica puede conducir a una reducción pronunciada del contenido de grasa hepática en paralelo a la pérdida de peso.
¿Cuáles son las implicaciones farmacoterapéuticas?
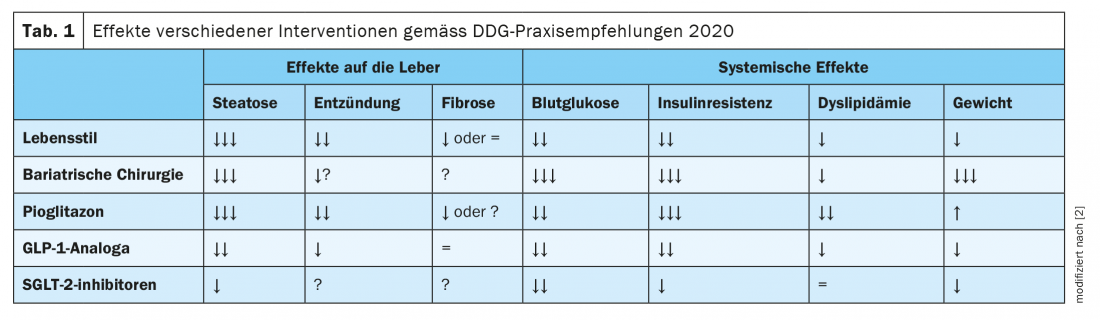
Aunque todavía no se ha aprobado ninguna terapia farmacológica para la HGNA. Sin embargo, si existe diabetes de tipo 2, puede utilizarse medicación específica para tratar la diabetes, que también tiene un efecto beneficioso sobre la NAFLD. Las directrices conjuntas de la Asociación Europea para el Estudio del Hígado (EASL), la Asociación Europea para el Estudio de la Diabetes (EASD) y la Asociación Europea para el Estudio de la Obesidad (EASO), así como las de la Asociación Americana para el Estudio de las Enfermedades Hepáticas recomiendan el uso de la pioglitazona si no existen contraindicaciones (insuficiencia cardiaca, antecedentes de cáncer de vejiga, mayor riesgo de fracturas óseas). [19,20]. Los estudios han demostrado efectos beneficiosos sobre los parámetros relacionados con la NAFLD tanto en diabéticos como en no diabéticos. “La pioglitazona es actualmente el fármaco con mejores pruebas”, afirma el Dr. Karrasch [23]. Entre otros hallazgos, un metaanálisis de ocho ensayos clínicos aleatorizados en los que participaron 516 pacientes de con EHNA comprobada mediante biopsia demostró que el tratamiento con tiazolidinedionas (rosiglitazona o pioglitazona) se asociaba a una mejora del grado de fibrosis y a una reducción de la EHNA. Este efecto también se observó en pacientes sin diabetes [21]. Además, estudios recientes sugieren que los agonistas del GLP-1 (péptido similar al glucagón 1), como la liraglutida, y los inhibidores del SGLT-2 (transportador de glucosa dependiente de sodio 2) pueden reducir la grasa hepática en la NAFLD y la diabetes de tipo 2 [2]. Las recomendaciones prácticas de la Sociedad Alemana de Diabetes (DDG) resumen los efectos de las diferentes intervenciones sobre el HGNA y la diabetes, éstas se muestran enla tabla 1 [2].
Congreso: Conferencia Anual de la DGIM 2021
Literatura:
- Centro Alemán para la Investigación de la Diabetes, www.dzd-ev.de/forschung/ursachen-und-behandlung-der-nicht-alkoholischen-fettlebererkrankung-nafld/index.html, (última consulta: 16.06.2021)
- Stefan N, et al: Diabetes e hígado graso. Diabetología 2020; 15 (Suppl 1): S156-S159.
- Roeb E, et al: [S2k Guideline non-alcoholic fatty liver disease]. Z Gastroenterol, 2015. 53(7): 668-723.
- Guía de práctica clínica de la ASL: Tratamiento del carcinoma hepatocelular. J Hepatol 2018; 69(1): 182-236.
- Tomah S, Alkhouri N, Hamdy O: Enfermedad del hígado graso no alcohólico y diabetes de tipo 2: ¿cuál es la posición de los diabetólogos? Clin Diabetes Endocrinol 2020; 6(9), https://doi.org/10.1186/s40842-020-00097-1
- Zaharia OP, et al: Riesgo de enfermedades asociadas a la diabetes en subgrupos de pacientes con diabetes de inicio reciente: un estudio de seguimiento de 5 años. Lancet Diabetes Endocrinol 2019; 7: 684-694.
- Simeone JC, et al: Evolución clínica de la enfermedad del hígado graso no alcohólico: una evaluación de la gravedad, la progresión y los resultados. Clin Epidemiol 2017(9) 679-688.
- AWMF: Versión de consulta de la directriz S3 “Diagnóstico y terapia del carcinoma hepatocelular y los carcinomas biliares”, www.leitlinienprogramm-onkologie.de (última consulta: 16.06.2021)
- Hirsova P, Gores GJ : Muerte celular mediada por receptores de muerte y señalización proinflamatoria en la esteatohepatitis no alcohólica. Cell Mol Gastroenterol Hepatol 2015; 1: 17-27
- Roeb E, Geier A: Esteatohepatitis no alcohólica (EHNA): recomendaciones actuales de tratamiento y evolución futura. Z Gastroenterol 2019; 57(4): 508-517.
- Heitmann J, et al: Enfermedad del hígado graso no alcohólico y psoriasis: ¿existe una red proinflamatoria común? JDDG 2021; 19(4): 517-529.
- Sterling RK, et al: Desarrollo de un índice no invasivo sencillo para predecir la fibrosis significativa en pacientes con coinfección por VIH/VHC. Hepatol 2006; 43(6): 1317-1325.
- Weiß J, Rau M, Geier A. Enfermedad del hígado graso no alcohólico: epidemiología, curso clínico, investigación y tratamiento. Dtsch Arztebl Int 2014; 111: 447-452.
- Dowman JK, Tomlinson JW, Newsome PN: Revisión sistemática: el diagnóstico y la estadificación de la enfermedad del hígado graso no alcohólico y la esteatohepatitis no alcohólica. Aliment Pharmacol Ther 2011; 33: 525-540.
- Rau M, Geier A: Actualización sobre el desarrollo de fármacos para el tratamiento de la enfermedad del hígado graso no alcohólico: de los ensayos clínicos en curso a la terapia futura. Revisión experta de farmacología clínica 2021; 14(3): 333-340.
- Roeb E: Esteatohepatitis no alcohólica: Hígado graso con complicaciones | PZ – Pharmazeutische Zeitung (pharmazeutische-zeitung.de), https://www.pharmazeutische-zeitung.de/ausgabe-342018/fettleber-mit-komplikationen/, (última consulta: 16.06.2021)
- Rau M, Geier A: Enfermedad hepática, grasa no alcohólica. En: Kuipers E: Enciclopedia de gastroenterología.2ª edición. Oxford: Academic Press, Elsevier 2020: 408-413.
- Zelber-Sagi S, et al: Predictores de la incidencia y remisión de la NAFLD en la población general durante un seguimiento prospectivo de siete años. J Hepatol 2012; 56: 1145-1151.
- Stefan N, Häring HU, Cusi K: Enfermedad del hígado graso no alcohólico: causas, diagnóstico, consecuencias cardiometabólicas y estrategias de tratamiento. Lancet Diabetes Endocrinol 2019; 7: 313-324.
- Asociación Europea para el Estudio del Hígado (EASL); Asociación Europea para el Estudio del Hígado (EASL); Asociación Europea para el Estudio de la Diabetes (EASD); Asociación Europea para el Estudio de la Obesidad (EASO). Guías de práctica clínica EASL-EASD-EASO para el tratamiento de la enfermedad del hígado graso no alcohólico. Diabetologia 2016; 59: 1121-1140.
- Musso G, et al: Tiazolidinedionas y fibrosis hepática avanzada en la esteatohepatitis no alcohólica: un metaanálisis. JAMA Intern Med 2017; 177(5): 633-640.
- Eslam M, et al.: A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J Hepatol 2020; 73(1): 202-209.
- Karrasch T: NASH/NAFLD desde una perspectiva endocrino-diabetológica. PD Dr. med. Thomas Karrasch. Conferencia anual de la DGIM, 20.04.2021.
HAUSARZT PRAXIS 2021; 16(3): 45-46 (publicado el 29.6.21, antes de impresión).