Les tumeurs malignes du tractus gastro-intestinal sont fréquentes et le besoin d’options thérapeutiques supplémentaires est élevé. Lors de la réunion annuelle de l’ASCO de cette année, de nouveaux résultats d’études intéressants ont été présentés pour les cancers colorectaux ainsi que pour les cancers de l’œsophage, de la jonction gastro-œsophagienne et de l’estomac. Celles-ci pourraient bientôt changer le quotidien clinique.
Les tumeurs malignes du tractus gastro-intestinal sont fréquentes. Aux États-Unis, 338 090 nouveaux cas (environ 20% de tous les nouveaux cas de tumeurs malignes diagnostiqués) et 169 280 décès (environ 30% de tous les décès dus à des tumeurs malignes) sont attendus cette année [1]. Selon le Registre suisse des tumeurs, 22 505 personnes ont développé un cancer colorectal (CCR) en Suisse au cours de la période d’observation 2013-2017 et 8939 décès ont été causés par ce cancer. Au cours de la même période, 5009 des 7727 personnes atteintes de carcinomes de l’œsophage (Ö), de la jonction gastro-œsophagienne (GEJ) et de l’estomac sont décédées [2]. Ces chiffres mettent en évidence le besoin d’options thérapeutiques supplémentaires pour le traitement des tumeurs de ces systèmes d’organes.
Lors de la réunion annuelle de la Société américaine d’oncologie (American Society of Oncology, ASCO) en juin 2021, de nouveaux résultats d’études ont été présentés pour les cancers colorectaux ainsi que pour les cancers de l’œsophage, de la jonction gastro-œsophagienne et de l’estomac. Les paragraphes suivants présentent les normes de traitement actuelles ainsi que les avancées scientifiques récemment présentées et présentant un intérêt particulier.
Cancer du côlon
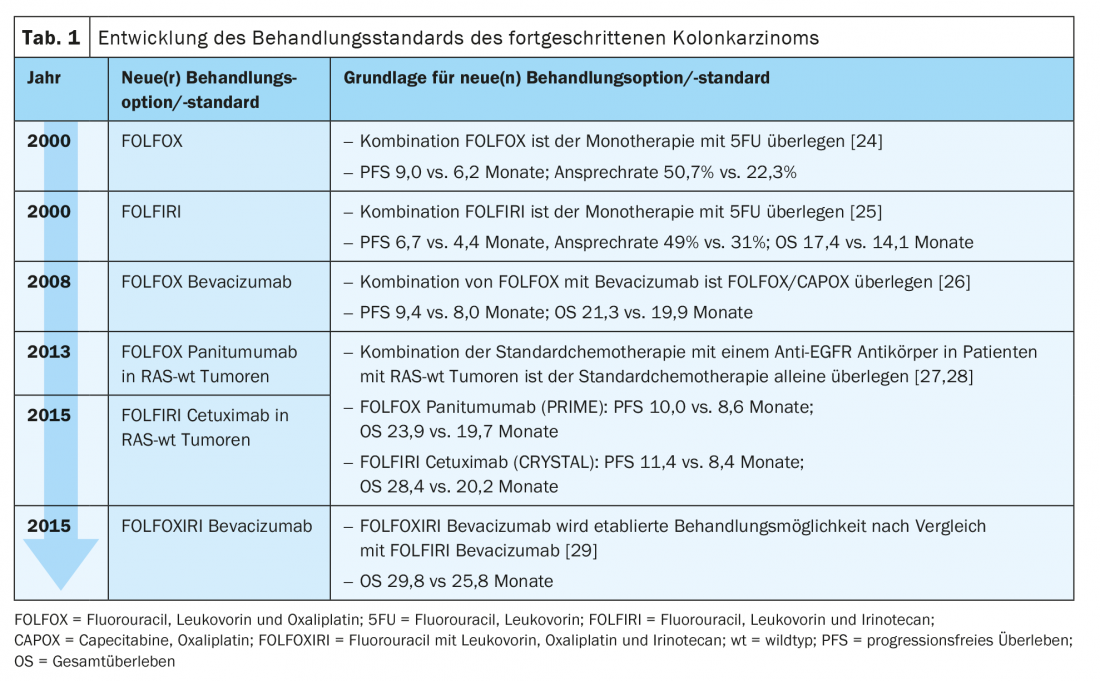
Le traitement standard du cancer du côlon avancé en première ligne consiste aujourd’hui en une combinaison de deux à trois agents chimiothérapeutiques avec un anticorps (Ab) dirigé contre le récepteur du facteur de croissance épidermique (EGFR) ou contre le facteur de croissance de l’endothélium vasculaire (VEGF) (tableau 1).
Avec l’introduction croissante de la pathologie moléculaire dans la pratique clinique quotidienne, l’analyse de l’instabilité des microsatellites (MSI) est devenue possible en tant qu’approche des éventuels défauts présents dans le système de réparation des mésappariements d’ADN. Même si la fréquence des MSI dans le CRC dépend du stade et qu’elles sont plus fréquentes dans les stades précoces (I/II : environ 20% ; III : environ 12% ; IV : 4-5%) [3], les MSI sont également intéressantes dans les stades avancés de la tumeur, en particulier dans le contexte des options de traitement immunothérapeutique. Le et al. ont montré dès 2015 que la présence d’une déficience de réparation des mésappariements (MMR-d) dans des carcinomes de différents tissus d’origine était associée à un taux de réponse (RR ) plus élevé, à une survie sans progression ( PFS) plus longue et à une survie globale ( OS) améliorée sous traitement par pembrolizumab, un anticorps anti-PD-1. Le collectif de cette étude était composé en grande partie de patients atteints de CCR [4]. Sur cette base, l’utilisation des anti-PD-1 Ab monoclonaux pembrolizumab et nivolumab – également en combinaison avec l’anti-CTLA4 Ab ipilimumab – est actuellement à l’étude chez les patients atteints de cancer du côlon avancé.
Keynote-177
L’étude de phase III KEYNOTE-177 a comparé l’utilisation du pembrolizumab (nom commercial KEYTRUDA® ; fabricant Merck/MSD) en tant que première ligne de traitement pour les CRC avancés et métastatiques présentant un niveau élevé de MSI (MSI-H) à une chimiothérapie standard. 307 patients ont été randomisés dans un bras d’intervention avec pembrolizumab 200 mg trois fois par semaine et dans un bras de comparaison avec une chimiothérapie standard à base de fluorouracile +/- bevacizumab ou cetuximab. Les critères d’évaluation primaires étaient l’OS et la PFS. Dès la deuxième analyse intermédiaire, après une période d’observation médiane de 32,4 mois, la mPFS s’est avérée nettement supérieure pour l’immunothérapie (16,5 contre 8,2 mois). Le taux de réponse global (Overall Response Rate, ORR) selon les critères d’évaluation de la réponse dans les tumeurs solides (Response Evaluation Criteria in Solid Tumors , RECIST) était également significativement plus élevé dans le groupe pembrolizumab (43,8% contre 33,1%). De plus, le groupe d’intervention a connu beaucoup moins d’effets indésirables graves liés au traitement ( TRAEs ) (22% de TRAEs ≥degré3 contre 66%) [5]. Ces données prometteuses ont été confirmées lors de l’assemblée annuelle de l’ASCO 2021. A 36 mois, le taux de PFS a été de 42% dans le bras intervention contre 11% dans le bras standard. L’avantage de l’ORR pour le groupe pembrolizumab était encore un peu plus net que dans l’analyse précédente, avec 45,1% vs 33,1%. Le délai entre la randomisation et la prochaine ligne de traitement ou le décès du patient (PFS 2) était également nettement plus long dans le groupe pembrolizumab (54,0 contre 24,9 mois). De plus, le traitement par pembrolizumab a montré un taux d’OS significativement plus élevé à 36 mois (61% vs 50%). Un cross-over est prévu dans le design de l’étude, l’OS médian pour le groupe pembrolizumab n’était pas encore atteint au moment de la présentation à la réunion annuelle de l’ASCO en 2021 [6]. Le pembrolizumab est autorisé en Suisse pour le traitement du CCR métastatique avec MSI-H en monothérapie en première ligne de traitement [7].
CheckMate 142
L’étude de phase II CheckMate 142 évalue le rôle du nivolumab (nom commercial OPTIVO® ; fabricant BMS) après progression sous/après, ou en cas d’intolérance au fluorouracile, en association avec l’oxaliplatine et/ou l’irinotécan chez des patients atteints de CCR MSI-H avancé ou métastatique. 74 patients avec ≥3lignes de traitement antérieures ont été inclus et ont reçu au moins une dose de nivolumab 3 mg/kg de poids corporel toutes les deux semaines. Le critère d’évaluation principal était l’ORR selon RECIST. Après douze mois, le RR était de 31% et 69% des patients avaient une évolution stable de la maladie pendant au moins douze semaines. La durée médiane de la réponse au traitement n’avait pas encore été atteinte au moment de l’inclusion des données [8]. Le design de l’étude a été élargi au cours de l’étude et une immunothérapie combinée avec nivolumab et ipilimumab à faible dose (nom commercial YERVOY® ; fabricant BMS) a été étudiée comme première ligne de traitement pour le groupe de patients atteints de CCR métastasé. Ici, on a observé un RR de 64%, une réponse complète (CR) dans 9% et un contrôle continu de la maladie à 24 mois dans 79% des cas [9]. Le nivolumab est autorisé en Suisse en monothérapie ou en association avec l’ipilimumab pour le traitement des patients adultes atteints de CRC métastatique avec MMR-d/MSI-H après un traitement antérieur à base de fluoropyrimidine en association avec l’irinotécan ou l’oxaliplatine [7,10]. Il existe une recommandation de prise en charge du nivolumab par l’Office fédéral de la santé publique (OFSP) de la Confédération suisse, mais pas de l’ipilimumab [7].
Carcinomes de l’œsophage, de la jonction gastro-œsophagienne et de l’estomac
CheckMate 648
Jusqu’à présent, le pronostic des carcinomes épidermoïdes avancés de l’œsophage était malheureusement nettement limité, avec un SG médian d’environ dix mois – malgré l’utilisation d’agents chimiothérapeutiques. L’étude CheckMate 648 compare désormais la chimiothérapie seule à la combinaison de la chimiothérapie et du nivolumab, ainsi qu’à la combinaison des agents immunothérapeutiques nivolumab et ipilimumab en première ligne de traitement. Près de 1000 patients atteints de carcinome épidermoïde avancé de l’œsophage ont été randomisés dans trois groupes de traitement, indépendamment de leur statut PD-L1 : (1) nivolumab (240 mg toutes les deux semaines) et chimiothérapie (fluorouracile et cisplatine quatre fois par semaine) ; (2) nivolumab (3 mg/kg de poids corporel toutes les deux semaines) et ipilimumab (1 mg/kg de poids corporel six fois par semaine) ; (3) chimiothérapie seule. Les critères d’évaluation primaires étaient l’OS et la PFS dans le groupe de patients avec une expression de PD-L1 ≥1%. Les critères d’évaluation secondaires définis étaient la SG, la PFS et le RR chez tous les patients, indépendamment de l’expression de PD-L1.
A 12 mois, dans la population avec expression de PD-L1 ≥1%, le taux d’OS a été de 58% dans le groupe nivolumab + chimiothérapie vs 37% dans le groupe chimiothérapie, ainsi qu’un avantage de survie médian de 6,3 mois pour la combinaison nivolumab + chimiothérapie. Cela a également été confirmé chez les patients inclus indépendamment de l’expression de PD-L1, avec un taux d’OS de 54% vs 44% et un avantage de survie de 2,5 mois. Cependant, en examinant de près l’analyse des sous-groupes avec la ventilation de l’avantage de survie selon le statut PD-L1, il apparaît clairement qu’il existe un effet dominant de la sous-population PD-L1 positive et que l’avantage de survie démontré est en tout premier lieu imputable à ce sous-groupe. On peut se demander si les patients PD-L1 négatifs en bénéficient. Des avantages cliniquement significatifs ont également été observés pour nivolumab + chimiothérapie en termes de PFS et de RR.
La comparaison entre nivolumab + ipilimumab et la chimiothérapie seule a donné des résultats similaires avec un OS de 57% vs 37% à 12 mois et un avantage de survie de 4,6 mois sous immunothérapie dans la population de patients exprimant PD-L1 ≥1%. L’analyse des sous-groupes selon le statut PD-L1 est très similaire à celle de la comparaison nivolumab + chimiothérapie vs chimiothérapie. Sur la base de ces données, l’utilisation de nivolumab + chimiothérapie et de nivolumab + ipilimumab chez les patients atteints de carcinome épidermoïde avancé de l’œsophage PD-L1-positif doit être considérée comme un nouveau standard. Actuellement, le nivolumab et l’ipilimumab ne sont pas encore autorisés en Suisse dans cette indication [7,10]. Chez les patients atteints d’un cancer de l’œsophage PD-L1 négatif, la chimiothérapie seule reste une option.
Si le nivolumab est approuvé en première ligne dans cette indication, cela modifiera la séquence des options thérapeutiques, du moins pour les patients atteints de tumeurs PD-L1 positives. Jusqu’à présent, le nivolumab est indiqué pour le traitement des adénocarcinomes avancés ou récidivants de l’estomac ou du GEJ après deux ou plusieurs traitements systémiques antérieurs – actuellement, une garantie de paiement est nécessaire en Suisse [7,10]. Par conséquent, si l’utilisation est maintenant transférée à la première ligne de traitement, cette option médicamenteuse doit être reconsidérée dans les lignes de traitement ultérieures. La prise en compte de facteurs spécifiques au patient, tels que la présence d’une maladie auto-immune, pourrait servir de guide à cet égard. En principe, l’utilisation des options thérapeutiques les plus efficaces au début du traitement est un principe oncologique courant et suggère l’utilisation de l’immunothérapie en première ligne de traitement en l’absence de contre-indications.
CheckMate 649
Enzinger et al. ont établi en 2016 FOLFOX (fluorouracile, leucovorine, oxaliplatine) comme schéma de chimiothérapie pour le traitement des patients atteints de carcinome métastatique de l’OE/GEJ en première ligne de traitement. Leur étude a montré une OS et une PFS comparables avec le traitement standard de l’époque ECF (épirubicine, cisplatine, fluorouracile) vs FOLFOX pour ce groupe de patients, principalement des adénocarcinomes [11]. Dans le bras d’intervention comme dans le groupe témoin, la chimiothérapie avait été associée au cetuximab. Toutefois, cela ne correspond à aucun schéma thérapeutique standard établi pour les cancers de l’œsophage/de l’estomac et, en utilisant l’anti-EGFR-Ab dans les deux groupes d’étude, cela ne permet pas de tirer des conclusions sur les bénéfices spécifiques au groupe.
CheckMate 649 compare désormais la chimiothérapie standard seule (CAPOX, capécitabine et oxali-platine trois fois par semaine ou FOLFOX fluorouracile deux fois par semaine) avec le traitement combiné de chimiothérapie et nivolumab (360 mg trois fois par semaine ou 240 mg deux fois par semaine) et avec l’association d’immunothérapie nivolumab + ipilimumab en première ligne de traitement. Les patients atteints d’adénocarcinomes avancés de l’œsophage/GEJ et de l’estomac ont été inclus. Les critères d’évaluation primaires pour le groupe nivolumab + chimiothérapie et pour le groupe chimiothérapie étaient la PFS et la SG chez les patients présentant un score combiné positif (CPS) ≥5%– le CPS décrivant la proportion de cellules tumorales et immunitaires (lymphocytes et macrophages) positives pour le PD-L1 par rapport à l’ensemble des cellules tumorales. Après une période d’observation d’environ un an, une supériorité significative de nivolumab + chimiothérapie a été observée, tant pour la PFS que pour l’OS. Cet effet a également été vérifié pour les patients avec un SCP ≥1%et pour tous les patients randomisés au hasard [12]. Des données supplémentaires sur les sous-groupes viennent d’être présentées à la réunion annuelle de l’ASCO. Ici, l’avantage en termes d’OS et de PFS de nivolumab + chimiothérapie était plus net chez les patients atteints de carcinomes avec des seuils PD-L1 plus élevés. Dans l’ensemble de la population, un bénéfice pour l’immunothérapie a été observé indépendamment du statut PD-L1, ce bénéfice étant, comme pour CheckMate 648, tiré par la sous-population PD-L1 positive. Pour les adénocarcinomes PD-L1-positifs de l’œsophage/GEJ et de l’estomac, FOLFOX combiné au nivolumab est donc un nouveau standard. Il n’existe actuellement pas d’autorisation de mise sur le marché pour le nivolumab dans cette indication en Suisse [7]. Les données du bras d’étude nivolumab + ipilimumab sont toujours en attente [13].
KEYNOTE-811
En 2008, l’étude REAL-2, une étude de non-infériorité, a établi CAPOX comme alternative au fluorouracile et au cisplatine dans le traitement des cancers avancés de l’œsophage/GEJ et de l’estomac, quelle que soit leur histologie. Une fluoropyrimidine et un composé du platine ont chacun été associés à l’anthracycline épirubicine [14].
L’essai ToGA, une étude randomisée de phase III, a ensuite évalué l’ajout de trastuzumab, un anti-HER2-Ab, à cette chimiothérapie standard (capécitabine et cisplatine, ou fluorouracile et cisplatine) en première ligne de traitement. Les patients atteints de carcinomes avancés de l’estomac et du GEJ HER-2-positifs ont été inclus. La triple association avec une anthracycline, préexistante à REAL-2, n’a pas été intégrée dans ce schéma d’étude en raison de la cardiotoxicité de ce groupe de médicaments et des propriétés cardiotoxiques du trastuzumab. En raison d’une augmentation significative de l’OS, la combinaison de la chimiothérapie et du trastuzumab est devenue la nouvelle norme de traitement dans ce groupe de patients [15].
Dans l’étude KEYNOTE-811, l’ajout de pembrolizumab 200 mg toutes les trois semaines au traitement standard susmentionné en première ligne est maintenant étudié pour ce même groupe de patients. Les résultats initiaux ont été présentés lors de la réunion annuelle de l’ASCO 2021 : Ils ont montré une amélioration significative du RR de 74,4% vs. 51,9% et un taux de RC de 11,3% vs. 3,1% sous pembrolizumab + chimiothérapie. Le taux de rémission partielle était de 63% vs. 49%. Les critères d’évaluation primaires OS et PFS sont encore en suspens [16].
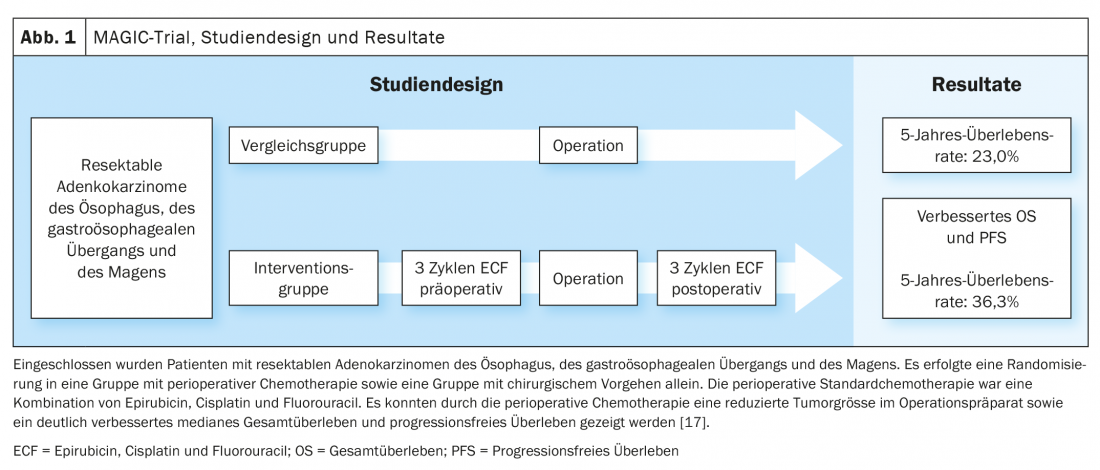
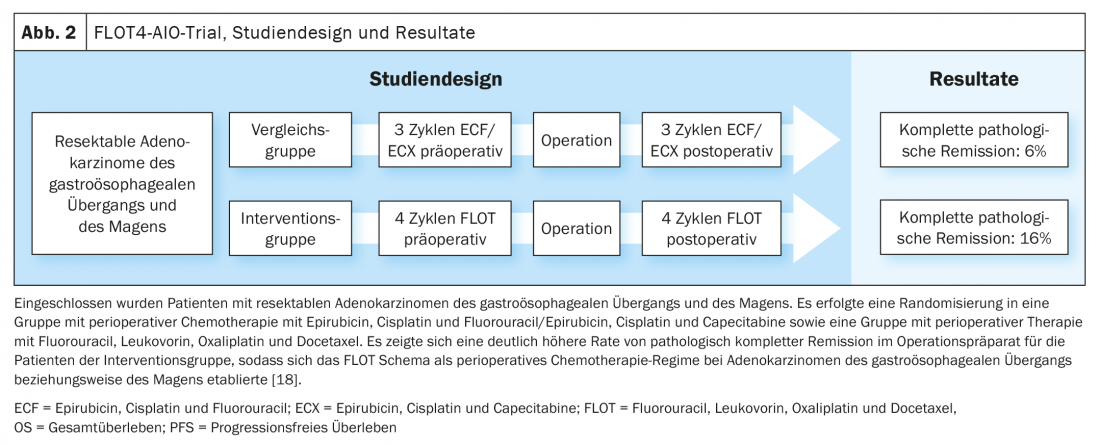
Mise à jour CROSS/Mise à jour Neo-AEGIS
Sur la base des données de l’étude MAGIC et du développement du concept de traitement dans l’étude FLOT4-AIO, la chimiothérapie périopératoire par FLOT (fluorouracile, leucovorine, oxaliplatine, docétaxel) est devenue une option de traitement curatif établie des cancers gastro-œsophagiens (Fig. 1, Fig. 2) [17,18]. En revanche, l’approche thérapeutique trimodale de l’étude CROSS (figure 3) [19]. L’étude Neo-AEGIS se penche actuellement sur la question de savoir laquelle des deux approches – chimiothérapie périopératoire (protocole MAGIC/FLOT) ou radiochimiothérapie néoadjuvante analogue à CROSS – présente un avantage.
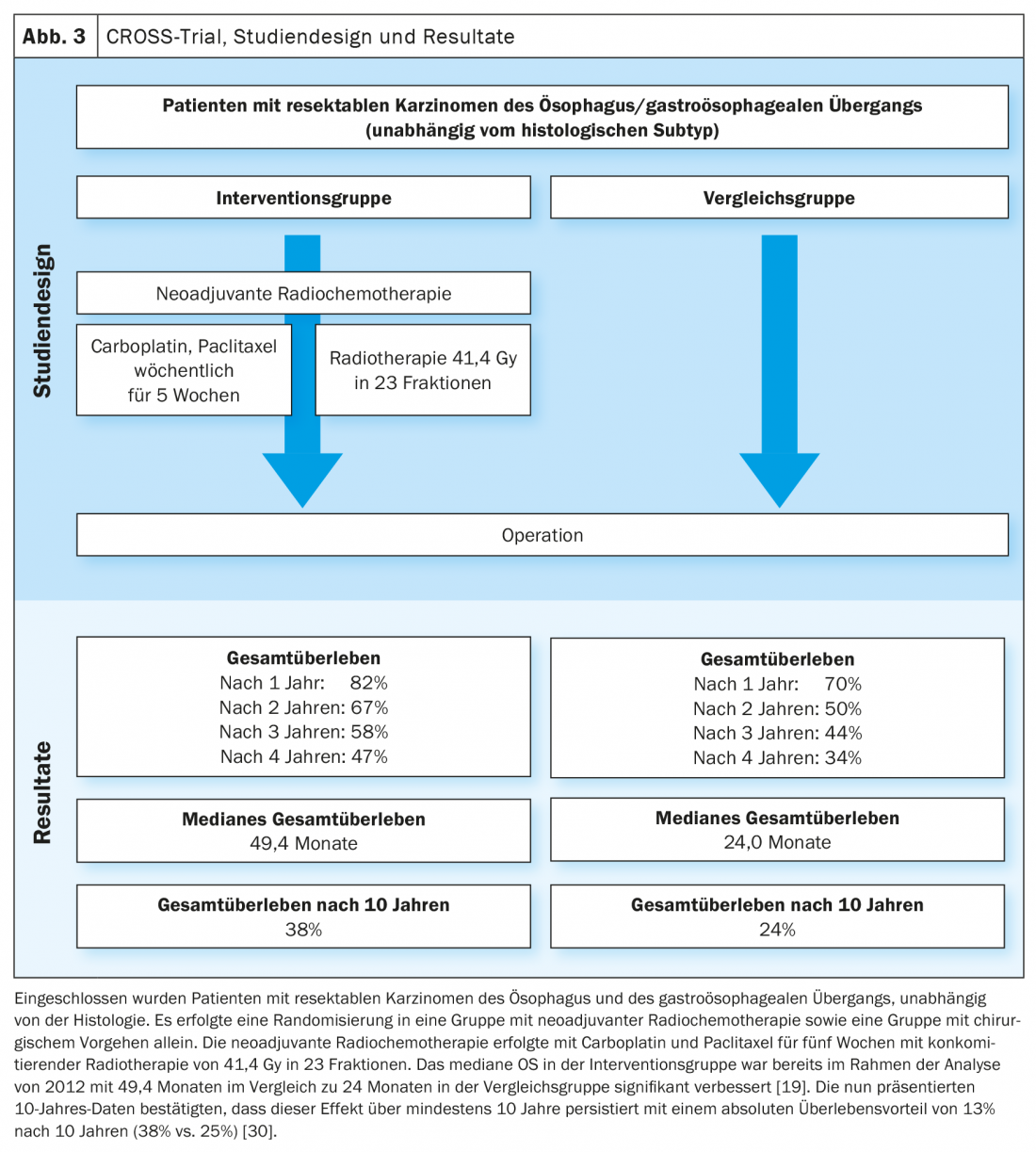
Pour ce faire, des patients atteints d’adénocarcinomes résécables de l’œsophage/de l’œsophage ont été randomisés 1:1 pour recevoir une chimiothérapie périopératoire (d’abord analogue à MAGIC, puis analogue à FLOT4-AIO au cours de l’évolution) et une thérapie trimodale analogue à CROSS [20]. Dans l’analyse actuelle (ASCO 2021), une approche de non-inférioritéa été adoptée. Aucun élément n’a permis de conclure à une nette infériorité de la chimiothérapie périopératoire par rapport à l’approche trimodale. Néanmoins, les patients traités de manière analogue au CROSS présentaient un taux plus élevé de résection en milieu sain (R0), davantage de ganglions lymphatiques histologiquement négatifs après le traitement antérieur (ypN0), un degré de régression tumorale et une CR pathologique plus élevés. Le taux de neutropénies ≥grade3 et le nombre de septicémies neutropéniques étaient plus élevés dans le groupe chimiothérapie périopératoire, tandis que les décès postopératoires à l’hôpital/pneumonies postopératoires et SDRA ainsi que les insuffisances anastomotiques étaient à peu près aussi fréquents. Le critère d’évaluation principal de l’étude était le taux de survie, pour lequel un résultat comparable a été obtenu après une période de suivi de trois ans [21].
Il n’est donc pas encore possible de formuler une recommandation claire à partir des données actuelles de l’étude Neo-AEGIS. Les facteurs liés au patient, tels que les comorbidités, doivent être pris en compte dans le choix de l’approche thérapeutique. En outre, les options thérapeutiques ultérieures doivent être prises en compte dans le choix du traitement. Ainsi, après le régime CROSS, une immunothérapie adjuvante avec nivolumab, analogue à l’étude CheckMate 577, est envisageable. Pour étudier ce point, des patients présentant des cellules cancéreuses résiduelles dans la pièce opératoire après un traitement trimodal ont été randomisés dans un groupe d’intervention avec nivolumab et un groupe témoin avec placebo. Une survie sans maladie nettement plus longue a été observée dans le groupe nivolumab (22,4 mois contre 11,0 mois) [22]. Dans cette indication, le nivolumab est autorisé en Suisse, mais il n’existe actuellement aucune recommandation de prise en charge par l’OFSP [7,10].
GO2
De nombreuses études qui façonnent le paysage oncologique se basent sur des populations dont l’âge médian est d’environ 60 ans. Cela ne reflète toutefois que partiellement la réalité du quotidien en oncologie, car le collectif de patients oncologiques se compose de plus en plus de patients âgés présentant des comorbidités ou des restrictions de l’état de santé liées à l’âge.
Cette question a été abordée dans le cadre de la réunion annuelle 2021 de l’ASCO pour les patients atteints de cancers gastro-œsophagiens avancés. L’étude de phase III GO2 a été menée auprès d’une population dont l’âge médian était de 76 ans. La chimiothérapie palliative de trois semaines par CAPOX a été administrée à trois niveaux de dosage : à pleine dose (oxaliplatine 130 mg/m2 le jour 1 et capécitabine 625 mg/m2 deux fois par jour les jours 1 à 14), ainsi qu’à 80% et 60% de cette dose. Dans le cadre d’une approche de non-infériorité, la PFS a été comparable sans perte significative entre les trois groupes de dosage, avec une meilleure tolérance globale du niveau de dosage le plus faible [23].
Messages Take-Home
- L’immunothérapie par pembrolizumab entraîne une amélioration de la survie sans progression et de la survie globale, ainsi qu’un taux de réponse au traitement supérieur à celui de la chimiothérapie standard dans le traitement de première ligne des cancers du côlon avancés et métastatiques présentant une instabilité élevée des microsatellites (MSI-H).
- L’association nivolumab-chimiothérapie et l’immunothérapie combinée nivolumab-ipilimumab entraînent une meilleure survie globale que la chimiothérapie standard seule dans le traitement de première ligne du carcinome épidermoïde avancé de l’œsophage avec expression de PD-L1 ≥1%.
- L’association du nivolumab et de la chimiothérapie permet d’obtenir une meilleure survie sans progression et une meilleure survie globale que la chimiothérapie standard seule dans le traitement de première ligne des adénocarcinomes avancés de l’œsophage, de la jonction gastro-œsophagienne et de l’estomac, en particulier dans la sous-population PD-L1 positive.
- La chimiothérapie périopératoire n’est pas inférieure à l’approche trimodale avec radiochimiothérapie néoadjuvante dans le traitement curatif des adénocarcinomes résécables de l’œsophage et de la jonction gastro-œsophagienne en termes de survie globale, mais elle entraîne plus souvent des neutropénies et obtient moins de résections R0, et
- Régression de la tumeur dans la tumeur primaire et les ganglions lymphatiques.
Littérature :
- Siegel RL, et al : Cancer Statistics 2021. CA Cancer J Clin. 2021 ; 71 : 7-33.
- Centre national d’enregistrement du cancer, www.nkrs.ch/de/stat (dernier accès septembre 2021)
- Battaglin F, et al : Microsatellite instability in colorectal cancer : overview of its clinical significance and novel perspectives. Clin Adv Hematol Oncol. 2018 ; 16(11) : 735-745.
- Le DT, et al : Blocage du PD-1 dans les tumeurs présentant un déficit de réparation des mésappariements. N Engl J Med. 2015 ; 372(26) : 2509-2520.
- André T, et al : Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med. 2020 ; 383(23) : 2207-2218.
- André T, et al : Final overall survival for the phase III KN177 study : pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). Abstract 3500, ASCO 2021 Virtual Meeting, 4-8 juin 2021.
- Office fédéral de la santé publique OFSP : Liste des spécialités. www.spezialitätenliste.ch (dernier accès septembre 2021)
- Overman MJ, et al : Nivolumab chez les patients atteints de cancer colorectal métastatique à ADN défectueux ou à instabilité des microsatellites (CheckMate 142) : une étude de phase 2, multicentrique, en ouvert. Lancet Oncol. 2017 ; 18(9) : 1182-1191. Erratum in : Lancet Oncol. 2017 ; 18(9).
- Helwick C : CheckMate 142 Updated Analysis : First-Line Nivolumab Plus Low-Dose Ipilimumab in MSI-H/dMMR Metastatic Colorectal Cancer. Poste ASCO. 2020. https://ascopost.com/issues/april-25-2020/checkmate-142-updated-analysis/
- Compendium OPTIVO. https://compendium.ch/product/1310903-opdivo-inf-konz-40-mg-4ml/mpro#MPro7100 (dernier accès septembre 2021)
- Enzinger PC, et al : CALGB 80403 (Alliance)/E1206 : Une étude randomisée de phase II de trois régimes de chimiothérapie plus le cetuximab dans les cancers métastatiques de l’œsophage et de la jonction gastro-œsophagienne. J Clin Oncol. 2016 ; 34(23) : 2736-2742.
- Janjigian YY, et al : nivolumab de première ligne plus chimiothérapie versus chimiothérapie seule pour les adénocarcinomes gastriques, gastro-oesophagiens et oesophagiens avancés (CheckMate 649) : un essai de phase 3 randomisé, en ouvert. Lancet . 2021 ; 398(10294) : 27-40.
- Moehler MH, et al : Première ligne (1L) nivolumab (NIVO) plus chimiothérapie (chimio) versus chimio dans le cancer gastrique avancé/le cancer de la jonction gastro-œsophagienne/l’adénocarcinome de l’œsophage (GC/GEJC/EAC) : Expanded efficacy and safety data from Checkmate 649. Abstract 4002, ASCO 2021 Virtual Meeting, 4-8 juin 2021.
- Cunningham D, et al : Capécitabine et oxaliplatine pour le cancer avancé de l’œsophage. N Engl J Med. 2008 ; 358 : 36-46.
- Bang YJ, et al. : Trastuzumab en association avec la chimiothérapie versus chimiothérapie seule pour le traitement du cancer de la jonction gastrique ou gastro-œsophagienne avancé (ToGA) HER2-positif : un essai contrôlé randomisé de phase 3, en ouvert. Lancet . 2010 ; 376 : 687-697.
- Janjigian YY, et al. : Pembrolizumab plus trastuzumab et chimiothérapie pour le cancer gastrique ou de la jonction gastro-œsophagienne (G/GEJ) métastatique HER2+ : résultats initiaux de l’étude mondiale de phase 3 KEYNOTE-811. Abstract 4013, ASCO 2021 Virtual Meeting, 4-8 juin 2021.
- Cunningham D, et al : Chimiothérapie périopératoire versus chirurgie seule pour les cancers gastro-oesophagiens résécables. N Engl J Med. 2006 ; 355 : 11-20.
- Al-Batran SE, et al : Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adénocarcinoma (FLOT4-AIO) : result from the phase 2 part of a multicentre, open-label, randomized phase 2/3 trial. Lancet Oncol. 2016 ; 17 : 1697-1708.
- Van Hagen P, et al : Chimioradiothérapie peropératoire pour le cancer de l’œsophage ou de la jonction. N Engl J Med 2012 ; 366 ; 2074-2084.
- Reynolds JV, et al. : ICORG 10-14 : NEOadjuvant trial in Adenocarcinoma of the oEsophagus and oesophagGastric junction International Study (Neo-AEGIS). BMC Cancer. 2017 ; 17 : 401.
- Reynolds JV, et al : Neo-AEGIS (Neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study) : Preliminary results of phase III RCT of CROSS versus perioperative chemotherapy (Modified MAGIC or FLOT protocol). Abstract 4004, ASCO 2021 Virtual Meeting, 4-8 juin 2021.
- Kelly RJ, et al. : CheckMate 577 Investigators. Adjuvant nivolumab dans les cancers de la jonction œsophagienne ou gastro-œsophagienne réséqués. N Engl J Med. 2021 ; 384(13) : 1191-1203.
- Hall PS, et al : Efficacité de la chimiothérapie de réduction d’intensité avec l’oxaliplatine et la capécitabine sur la qualité de vie et le contrôle du cancer chez les patients âgés et fragiles atteints d’un cancer gastro-œsophagien évolué. L’essai clinique randomisé GO2 phase 3. JAMA Oncol. 2021 ; 7(6) : 869-877.
- De Gramont A, et al : Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol. 2000 ; 18(16) : 2938-2947.
- Douillard JY, et al : Irinotecan combiné avec le fluorouracil comparé au fluorouracil seul en tant que traitement de première ligne du cancer colorectal métastatique : un essai randomisé multicentrique. Lancet . 2000 ; 355(9209) : 1041-1047. Erratum in : Lancet. 2000 ; 355(9212) : 1372.
- Saltz LB, et al : Bevacizumab en association avec une chimiothérapie à base d’oxaliplatine comme traitement de première ligne dans le cancer colorectal métastatique : une étude randomisée de phase III. J Clin Oncol. 2008 ; 26(12) : 2013-2019. Erratum in : J Clin Oncol. 2008 ; 26(18) : 3110. Erratum in : J Clin Oncol. 2009 ; 27(4) : 653.
- Douillard JY, et al : Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med. 2013 ; 369(11) : 1023-1034.
- Van Cutsem E, et al : Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 ; 33(7) : 692-700.
- Cremolini C, et al : FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab en tant que traitement de première ligne des patients atteints de cancer colorectal métastatique : mise à jour de la survie globale et des analyses de sous-groupes moléculaires de l’étude TRIBE de phase 3 en ouvert. Lancet Oncol. 2015 ; 16(13) : 1306-1315.
- Eyck BM, et al : Ten-Year Outcome of Neoadjuvant Chemoradiotherapy Plus Surgery for Esophageal Cancer : The Randomized Controlled CROSS Trial. J Clin Oncol. 2021 ; 39(18) : 1995-2004.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(5) : 12-18