Le premier médicament pour le traitement causal des patients atteints d’amyotrophie spinale associée au 5q (5q-SMA), l’oligonucléotide antisens nusinersen, a été approuvé en 2017 [1]. Le médicament cible la cause de la maladie, le déficit en protéine SMN [1]. De vastes études cliniques et dans le monde réel ont démontré que le nusinersen peut conduire à une stabilisation et même à une amélioration des fonctions motrices – dans tous les groupes d’âge et les SMA de type I-III [2-7].
La 5q-SMA est une maladie néomusculaire progressive autosomique récessive [8]. En l’absence de traitement, les patients risquent une dégradation progressive des motoneurones et donc une faiblesse et une atrophie musculaires croissantes [8]. Jusqu’à l’introduction d’un traitement médicamenteux causalement efficace, la forme infantile de la 5q-SMA, dont les symptômes se manifestent dès les six premiers mois de vie, était considérée comme l’une des principales causes de décès d’origine génétique chez les nourrissons et les jeunes enfants [8]. Le nusinersen (SPINRAZA®) est une option thérapeutique qui permet de maintenir, voire d’augmenter la force musculaire. [1-7].
Le nusinersen entraîne la formation de quantités plus importantes de protéine SMN [9].
La cause de la dénervation progressive des muscles squelettiques est un déficit de la protéine “Survival Motor Neuron” (SMN), qui est vitale pour les motoneurones. En raison de mutations ou de délétions dans le gène SMN1, les patients atteints de 5q-SMA produisent trop peu de protéine SMN [8].
Le nusinersen contribue à la production d’une plus grande quantité de protéine SMN fonctionnelle, ce qui permet aux motoneurones de survivre [9]. Cela permet de ralentir, voire d’arrêter l’évolution de la maladie. Les patients bénéficient du maintien ou de l’amélioration de la fonction musculaire. L’efficacité du nusinersen a été démontrée pour tous les groupes d’âge et tous les degrés de la maladie : pour les nourrissons atteints de 5q-SMA présymptomatique, les enfants et les adolescents symptomatiques et les adultes [2-7].
Les enfants atteints de 5q-SMA bénéficient d’un traitement présymptomatique
Dans les essais cliniques, de nombreux enfants atteints de 5q-SMA et traités par nusinersen ont atteint des étapes motrices importantes qui n’ont pas été observées chez les patients atteints de 5q-SMA non traités [2-4]. Il est apparu qu’un traitement précoce par SPINRAZA pouvait permettre un développement adapté à l’âge des enfants atteints de 5q-SMA. La plupart des patients atteints de 5q-SMA diagnostiquée génétiquement et traités de manière présymptomatique par nusinersen dans l’étude clinique NURTURE avaient atteint les étapes motrices correspondant à leur âge lors de l’évaluation intermédiaire de l’étude (tableau 1) [10].
Tableau 1 : Évaluation intermédiaire de l’étude NURTURE en février 2020 ; âge moyen des participants à l’étude 3,8 ans (n = 25) [10]
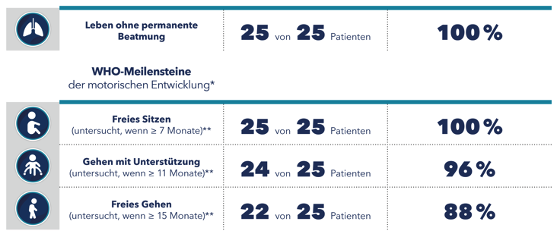





* Âge auquel les enfants en bonne santé atteignent normalement ces étapes.
** Le moment de l’examen se situait dans la fenêtre de temps indiquée par l’OMS. [11]
Des améliorations significatives ont également été observées au niveau des fonctions bulbaires, nécessaires à la mastication et à la déglutition [12]. Alors que de nombreux patients atteints de 5q-SMA non traités se fatiguent en mâchant, s’étouffent avec la nourriture ou ont besoin d’une sonde d’alimentation [13-16], le traitement présymptomatique par le nusinersen dans l’étude NURTURE a permis à 92% des enfants de continuer à avaler et à 84% de se passer de sonde d’alimentation [12]. En conséquence, les parents d’enfants atteints de 5q-SMA et traités par nusinersen ne se sont généralement pas inquiétés de la déglutition, de l’alimentation et du poids de leurs enfants. [12].
Efficacité du nusinersen également démontrée chez les adultes
De vastes données issues d’études d’observation menées chez des patients adultes atteints de 5q-SMA montrent que le traitement par nusinersen peut entraîner des améliorations significatives sur toutes les échelles de fonction motrice utilisées (HFMSE, RULM, distance de marche de 6 minutes) [5-7].
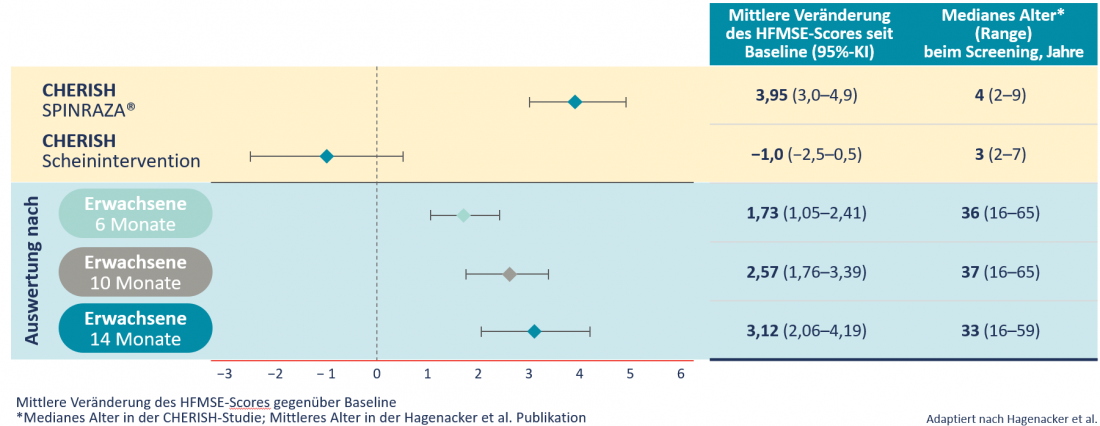
Dans une étude prospective multicentrique portant sur 139 patients provenant de 10 centres cliniques en Allemagne, , un pourcentage élevé de patients atteints de 5q-SMA de type II ou III ont montré des améliorations cliniquement significatives de leurs fonctions motrices. À tous les moments de l’étude, les patients ont obtenu en moyenne des améliorations statistiquement significatives du score HFMSE. Celui-ci avait augmenté de 3,12 points après 14 mois. En revanche, au cours de l’évolution naturelle de la maladie, le score HFMSE diminue en moyenne de 0,5 à 1,0 point par an [6]. On a observé une amélioration du score HFMSE chez les adultes comparable à celle observée chez les enfants (tableau 2) [6].
Tableau 2 : Changements moyens du score HFMSE depuis la ligne de base : Comparaison de 126 enfants ayant débuté la maladie 5q-SMA plus tard dans l’étude CHERISH et de 173 patients adultes de l’étude Hagenacker et al. Publication [3,6].

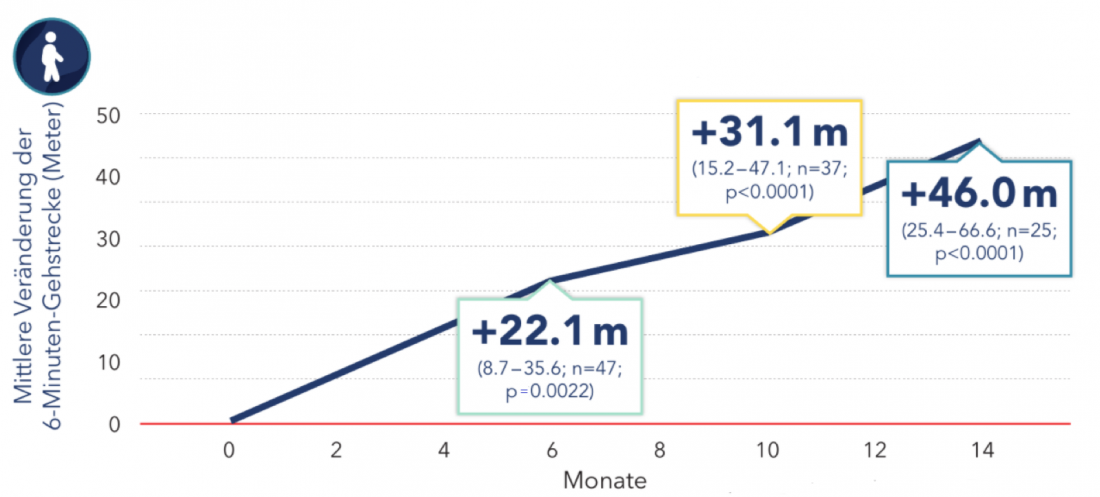
Le score RULM, qui mesure la fonction des membres supérieurs, a montré une amélioration significative de 1,09 point en moyenne à 14 mois dans l’étude. En outre, les patients ont réussi à parcourir 403 mètres en moyenne en 6 minutes. Ils ont ainsi pu marcher en moyenne 46 mètres de plus qu’avant le début du traitement (Fig. 2) [6].
L’âge des patients n’a pas eu d’influence sur les résultats. L’ampleur des améliorations dépendait toutefois du niveau de fonction motrice résiduelle du patient au début de l’étude. Plus le niveau des fonctions motrices restantes avant le début du traitement était élevé, plus l’effet attendu du traitement par Nusinersen était important [6].
Figure 2 : Modification de la distance de marche de 6 minutes chez les adultes traités par Nusinersen. Les cases indiquent la moyenne et l’IC à 95% [6]. Modifié d’après Hagenacker T et al. [6].
Les patients veulent participer à la vie normale
De nombreux patients adultes souhaitent conserver leur force afin de pouvoir s’asseoir, se lever et marcher de manière autonome [17]. Les fonctions des mains et des bras sont indispensables pour les tâches quotidiennes, comme se laver ou s’habiller de manière autonome. Les capacités motrices fines jouent également un rôle important dans l’environnement social des patients, ce qui se traduit par l’utilisation d’un smartphone ou d’un ordinateur portable.
Cependant, dans l’évolution naturelle de la 5q-SMA, on observe une faiblesse musculaire progressive et une perte des fonctions motrices [8]. Le traitement par nusinersen peut donner aux adultes atteints de 5q-SMA un espoir pour l’avenir. Les patients peuvent ainsi non seulement obtenir une stabilisation à long terme du statu quo fonctionnel, mais beaucoup d’entre eux connaissent des améliorations pertinentes de leurs fonctions motrices, ils ont plus de force dans les mains et les doigts et peuvent mieux se lever, se tenir debout plus longtemps et marcher plus loin [5-7].
Action ciblée – centrale dans le SNC
Pour ce faire, Nusinersen agit de manière ciblée sur la cause de la 5q-SMA. Il se lie de manière réversible au pré-ARNm du gène paralogique SMN2, qui est utilisé pour la formation de la protéine SMN chez les patients atteints de 5q-SMA. Les facteurs d’épissage sont ainsi déplacés et l’exon 7 reste dans l’ARNm SMN2 mature, ce qui permet la formation d’une plus grande quantité de protéine SMN fonctionnelle (Fig. 3) [1, 9].
Figure 3 : Mécanisme d’action ciblé du nusinersen [9].

Le nusinersen est administré par voie intrathécale via une ponction lombaire, ce qui lui permet d’atteindre directement l’endroit où il est censé agir, à savoir le système nerveux central [1]. L’application intrathécale permet au nusinersen d’atteindre directement le site d’action central et d’y exercer son action ciblée et spécifique sur le pré-ARNm du gène SMN2 [1]. L’effet du nusinersen se manifeste rapidement, 1 à 3 jours seulement après l’injection [18]. La grande spécificité du nusinersen et son application ciblée dans le système nerveux central se sont avérées sûres dans l’utilisation à long terme et ont en outre entraîné un effet durable sur les fonctions motrices d’un large éventail de patients atteints de 5q-SMA [5-7,10,19-23].
Parallèlement, l’administration intrathécale présente des avantages en termes d’adhérence. Les données disponibles à ce jour montrent que la plupart des patients reçoivent leurs doses de nusinersen comme prévu [24]. Pour d’autres maladies, il a été démontré que l’observance est plus élevée pour les traitements administrés en clinique que pour les traitements administrés quotidiennement par voie orale [25,26]. On peut donc supposer qu’en raison de l’administration intrathécale, les médecins peuvent s’assurer que les patients reçoivent la bonne dose de nusinersen au bon moment et que leur état de santé et leur réponse au traitement peuvent être surveillés de manière routinière.
Aucun effet secondaire systémique attendu
Un avantage important de l’utilisation intrathécale du nusinersen est l’exposition spécifique au compartiment, ce qui rend les effets secondaires systémiques peu probables. Cela a été confirmé dans des études cliniques et dans le monde réel. Les maux de tête, les douleurs dorsales et les vomissements sont les événements indésirables les plus fréquemment observés et associés à l’administration intrathécale [1]. Ils peuvent survenir peu après l’administration de nusinersen et sont en grande partie dus au syndrome post-ponction qui peut survenir après une ponction lombaire, même sans application de substances médicamenteuses [6]. Le profil de sécurité du nusinersen est bien documenté sur 7 ans [19].
Utilisation également possible en cas de scoliose
Même en cas de scoliose prononcée ou d’autres déformations importantes de la colonne vertébrale, fréquentes chez les patients atteints de 5q-SMA, l’injection intrathécale de nusinersen peut généralement être effectuée avec succès, en toute sécurité et rapidement [27]. Si nécessaire, l’injection dans l’espace du LCR doit être réalisée sous contrôle d’imagerie par tomodensitométrie (TDM) [27].
Conclusion
L’application centrale de Nusinersen permet d’obtenir un effet ciblé directement là où il est nécessaire. L’efficacité du nusinersen a été démontrée dans de vastes études cliniques et dans des études dans le monde réel pour tous les groupes d’âge et tous les degrés de sévérité de la 5q-SMA [2-7]. Les patients adultes atteints de 5q-SMA peuvent également bénéficier de la thérapie et obtenir une stabilisation ou des améliorations cliniquement significatives de leurs fonctions motrices [5-7].
Les avantages du nusinersen se reflètent également dans la satisfaction des patients : dans une étude prospective observationnelle menée en Allemagne sur des patients adultes, 95,7% ont déclaré être satisfaits du nusinersen – indépendamment de l’âge et de la gravité de la maladie [28].
On dispose désormais d’une vaste expérience de la pratique clinique quotidienne. Plus de 11 000 patients dans le monde ont été traités avec le nusinersen [29].
Littérature
- SPINRAZA® Information professionnelle, mise à jour août 2019 (www.swissmedicinfo.ch)
- Finkel RS, Mercuri E, Darras BT, et al. Nusinersenversus Sham Control in Infantile-Onset Spinal Muscular Atrophy. N Eangl J Med. 2017;377:1723-32.
- Mercuri E, Darras BT, Chiriboga CA, et al. Nusinersen versus Sham Control in Later-Onset Spinal Muscular Atrophy. N Engl J Med. 2018;378:625-35.
- De Vivo DC, Bertini E, Swoboda KJ, et al. Nusinersen initié chez les nourrissons au cours de la phase pré-symptomatique de l’atrophie musculaire spinale : résultats intermédiaires d’efficacité et de sécurité de l’étude de phase 2 NURTURE. Neuromuscul Disord. 2019;29:842-56.
- Walter MC, Wenniger S, Thiele S, et al. Safety and Treatment Effects of Nusinersen in Longstanding Adult 5q-SMA Type 3 – A Prospective Observational Study. J Neuromuscul Dis. 2019;6:453-65.
- Hagenacker T, Wurster CD, Günther R, et al. Nusinersen in adults with 5q spinal muscular atrophy : a non-interventional, multicentre, observational cohort study. Lancet Neurol. 2020;19:317-25.
- Maggi L, Bello L, Bonanno S, et al. Nusinersensafety and effects on motor function in adult spinal muscular atrophy type 2 and 3. J Neurol Neurosurg Psychiatry. 2020;91(11):1166-74.
- Lunn MR, Wang CH. Atrophie musculaire spinale. Lancet. 2008;371:2120-33.
- Goodkey K, Ashley T, Maruyama R, et al. Nusinersen dans le traitement de l’atrophie musculaire spinale. Méthodes Mol Biol. 2018 ; 1828 : 69-76.
- Swoboda KJ, Kirschner J, Finkel RS, et al ; Groupe d’étude NURTURE. Effet du nusinersen chez les nourrissons qui commencent le traitement à un stade pré-symptomatique de la SMA : résultats NURTURE. Cure SMA 2020 Virtual SMA Conference ; 8-12 juin 2020 ; https://curesma2020.biogenscicomm.com/curesma2020/sma/swoboda/#home. Consulté en septembre 2021.
- Groupe d’étude multicentrique de référence sur la croissance de l’OMS. Étude de l’OMS sur le développement moteur : indices de réalisation pour six grandes étapes du développement moteur. Acta Paediatr Suppl. 2006 ; 450 : 86 – 95.
- Swoboda KJ, Sansone VA, De Vivo DC, et al. Preserved swallowing function in infants who initiated nusinersen treatment in the presymptomatic stage of SMA : results from the NURTURE study. Présenté à la Conférence Clinique et Scientifique MDA 2021, 15-18 mars 2021.
- Van der Heul AMB, Wijngaarde CA, Wadman RI, et al. Bulbar Problems Self-Reported by Children and Adults with Spinal Muscular Atrophy. J Neuromuscul Dis. 2019;6:361-8.
- Finkel RS, McDermott MP, Kaufmann P, et al. Observational study of spinal muscular atrophy type I and implications for clinical trials. Neurologie. 2014;83:810-7.
- Van der Heul AMB, Cuppen I, Wadman RI, et al. Problèmes d’alimentation et de régurgitation chez les nourrissons atteints d’amyotrophie spinale de type 1 : une étude d’observation. J Neuromuscul Dis. 2020;7:323-30.
- Choi YA, Suh DI, Chae JH, et al. Trajectoire de changement de l’état de swallowing dans l’atrophie musculaire spinale de type I. Int J Pediatr Otorhinolaryngol. 2020;130:109818.
- Burbridge C, Kelly K, Garcia L, et al. PND74 Mapping a qualitative exploration of meaningful change in later-onset (type II or III) spinal muscular atrophy to the Hammersmith Functional Motor Scale Expanded (HFMSE). Valeur dans la santé. 2019 ; 22, Suppl 2, p284.
- Mazur C, Powers B, Zasadny K, et al. Pharmacologie cérébrale des oligonucléotides antisens intrathécaux révélée par imagerie multimodale. JCI Insight. 2019;4:e129240.
- Claborn MK, Stevens DL, Walker CK, et al. Nusinersen : A treatment for spinal muscular atrophy. Ann Pharmacother. 2019 ; 53(1) : 61-69.
- Castro D, Finkel RS, Farrar MA, et al. Nusinersen in infantile-onset spinal muscular atrophy : results from longer-term treatment from the open-label SHINE extension study. Neurologie. 2020 ; 94(15):1640.
- Chiriboga CA, et al. Traitement à long terme par le nusinersen : résultats de l’étude shine sur l’atrophie musculaire spinale tardive. Présenté à l’AAN 2020 ; 25. avril-1er mai 2020 ; https://www.neurologylive.com/view/nusinersen-shows-efficacy-in-infantile-and-lateonset-spinal-muscular-atrophy ; Consulté en septembre 2021.
- Acsadi G, Crawford TO, Müller-Felber W, et al. Sécurité et efficacité du nusinersen dans l’atrophie musculaire spinale : l’étude EMBRACE. Nerf musculaire. 2021;63:668-77.
- Duong T, Wolford C, McDermott, MP, et al. Nusinersen Treatment in Adults With Spinal Muscular Atrophy. Neurol Clin Pract. 2021 ; 11(3) : e317-27.
- Paradis A, et al. Nusinersen experience in later onset spinal muscular atrophy. Présenté à la WMS 2020.
- Seal BS, Anderson S, Shermock KM, et al. Factors Associated with Adherence Rates for Oral and Intravenous Anticancer Therapy in Commercially Insured Patients with Metastatic Colon Cancer. J Manag Care Spec Pharm. 2016;22:227-35.
- Moran K, Null K, Huang Z, et al. Retrospective Claims Analysis Indirectly Comparing Medication Adherence and Persistence Between Intravenous Biologics and Oral Small-Molecule Therapies in Inflammatory Bowel Diseases. Adv Ther. 2019;36:2260-72.
- Cordts I, Lingor B, Friedrich P, et al. Administration intrathécale de nusinersen chez des patients adultes atteints d’atrophie musculaire spinale et présentant une anatomie spinale complexe. Ther Adv Neurol Disord 2020 ; 13 : 1756286419887616
- Meyer T, Maier, A, Uzelac Z, et al. Expectations de traitement et perception du traitement chez les patients adultes atteints d’atrophie musculaire spinale recevant du nusinersen. Eur J Neurol. 2021 ; 28(8) : 2582-95.
- New Data at Cure SMA 2021 ; Biogen, https://investors.biogen.com/news-releases/news-release-details/new-data-cure-sma-2021-highlight-long-term-efficacy-spinrazar ; Dernier accès : septembre 2021
Information professionnelle abrégée SPINRAZA® Z: Un flacon contient 12 mg de nusinersen dans 5 ml de liquide céphalo-rachidien artificiel. I : Traitement de l’amyotrophie spinale associée à la 5q (SMA) D : Administration intrathécale par ponction lombaire (LP). 4 Doses de saturation de 12 mg (5 ml) par application aux jours 0, 14, 28, 63 ; traitement d’entretien tous les 4 mois 12 mg (5 ml). Spinraza ne peut être administré que dans des centres neuromusculaires spécialisés à l’hôpital. Le personnel médical traitant doit impérativement avoir de l’expérience dans le diagnostic et le traitement des patients atteints d’amyotrophie spinale et dans la réalisation de la PL. CI : hypersensibilité à la substance active ou aux excipients. VM : Pas de données de sécurité à long terme. Risque d’effets secondaires liés à la PL. Difficultés de la PL chez les très jeunes patients/patients atteints de scoliose. Examen des plaquettes et de la coagulation avant et régulièrement pendant le traitement. Surveillance des protéines urinaires avant et régulièrement pendant le traitement. ECG avant le début et régulièrement pendant le traitement. Possible neurotoxicité en cas de doses élevées et/ou d’utilisation prolongée. Envisager de rechercher une hydrocéphalie chez les patients présentant des troubles de la conscience. S : Non recommandé pendant S. EI : forme infantile : Infections respiratoires, rhinopharyngite, infections urinaires, otites, grippe, constipation, flatulence, perte de poids, éruptions cutanées. Début de la maladie plus tardif : fièvre, céphalées, vomissements, épistaxis, congestion des voies respiratoires, allergie saisonnière, douleurs dorsales, chute. Réduction possible de la croissance. Incidence des anticorps anti-drug (ADA) faible, aucune influence apparente du développement d’ADA sur la réponse clinique, les événements indésirables ou le profil pharmacocinétique du nusinersen n’a été observée. Post-marketing : infections graves telles que méningite, hydrocéphalie communicante, méningite aseptique, hypersensibilité (par ex. angio-œdème, urticaire, éruption cutanée). IA : Pas d’interaction avec le CYP450, interaction par liaison compétitive aux protéines plasmatiques, effet compétitif ou inhibition des transporteurs faible. Liste A. L’information professionnelle complète est publiée sur www.swissmedicinfo.ch. Biogen Switzerland AG, 6340 Baar. Mise à jour de l’information : août 2019. Biogen-29360_09.2020
Biogen Switzerland AG
30, rue du Neuhof
6340 Baar
www.biogen.ch
Biogen-128051_09.2021