La prise en charge de l’hidradénite suppurée reste un défi clinique. Il est souvent nécessaire de combiner différentes modalités de traitement pour atteindre un niveau suffisant de contrôle de la maladie. Une étude a démontré que l’utilisation combinée de l’adalimumab parallèlement à l’excision chirurgicale est efficace et sûre. À ce jour, l’adalimumab est le seul médicament biologique autorisé dans l’HS, mais plusieurs autres candidats anti-inflammatoires systémiques sont actuellement étudiés dans le cadre de programmes d’essais cliniques.
L’hidradénite suppurée (HS) est une maladie chronique, récurrente, progressive et à médiation immunitaire. Les nodules, abcès et fistules apparaissent préférentiellement au niveau axillaire, inguinal et anogénital et peuvent être très douloureux. Falk Bechara, médecin-chef en dermatologie à l’hôpital universitaire de la Ruhr-Universität Bochum (Allemagne) [1]. Les critères suivants permettent de diagnostiquer l’HS [2–4]:
- morphologie caractéristique des lésions,
- répartition caractéristique des lésions,
- Chronicité et manifestations récurrentes
Si un patient remplit ces trois critères de diagnostic, il s’agit d’une HS avec une sensibilité de 90% et une spécificité de 97% [2–4]. La sévérité de l’HS est généralement évaluée selon la classification de Hurley [2–4] (léger=stade I, modéré=stade II, sévère=stade III). Il y a encore beaucoup de questions en suspens concernant la physiopathologie, a déclaré l’orateur. Il semble que de très nombreux médiateurs de l’inflammation et d’autres paramètres soient hautement régulés chez les patients HS.
Les principales options de traitement de l’HS sont aujourd’hui : les antibiotiques systémiques, la chirurgie, les médicaments biologiques. Le professeur Bechara a ajouté que la plupart du temps, plusieurs de ces approches thérapeutiques sont combinées [1].
OP : changement de paradigme concernant l’approche
Une intervention chirurgicale est généralement nécessaire pour les patients en stade II ou III de Hurley [11]. Il s’agit en premier lieu d’éliminer les canaux de fistule et d’empêcher l’apparition récurrente de lésions isolées [12,13]. Le professeur Bechara a expliqué que l’on ne pratiquait plus aujourd’hui de résection anatomique phrophylactique complète pour les fistules initiales, comme on le faisait autrefois [1]. Au lieu de cela, l’accent est actuellement mis sur l’identification des lésions tissulaires irréversibles. Il s’agit de réséquer de manière ciblée les stades cicatriciels fistulisants irréversibles et non pas simplement toutes les manifestations inflammatoires de la maladie. Les lésions peu profondes peuvent être opérées à plat et combinées avec des médicaments, il n’est pas toujours nécessaire de procéder de manière radicale, a expliqué le conférencier.
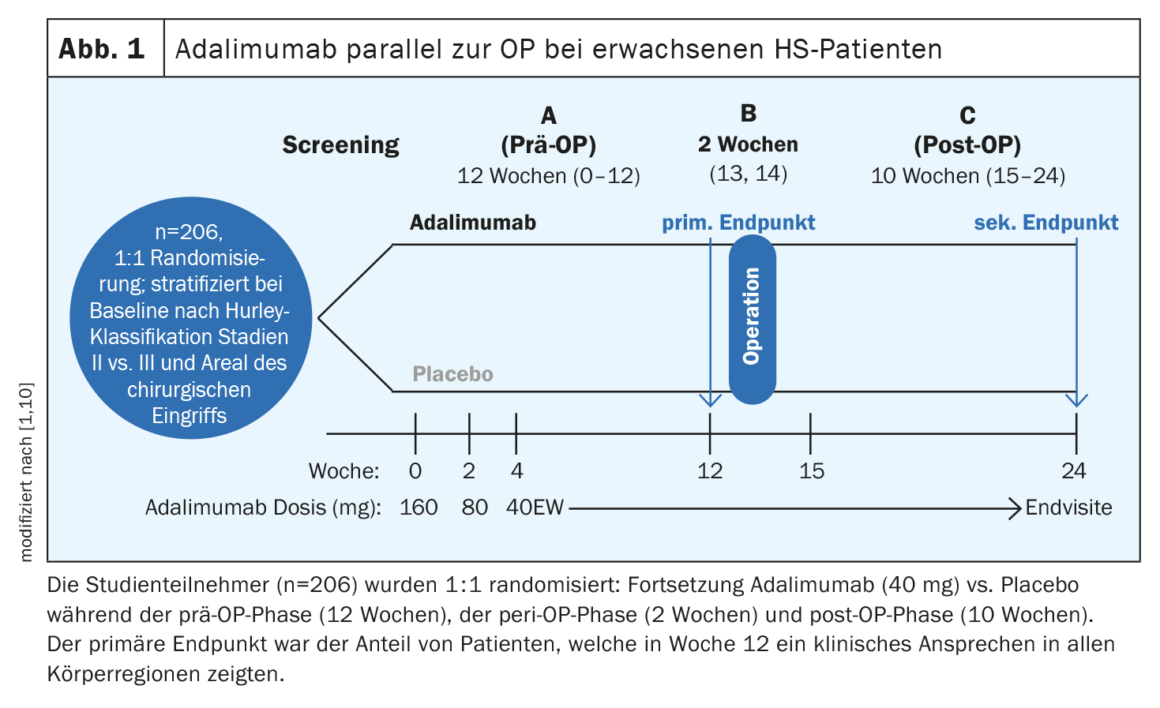
L’adalimumab en parallèle à la chirurgie s’est révélé efficace et sûr
A l’exception de l’adalimumab, aucun autre médicament biologique n’a encore franchi les obstacles de l’autorisation de mise sur le marché. “Nous avons une préparation qui fonctionne et nous travaillons avec elle, mais il y a beaucoup de marge de progression”, a résumé l’orateur [1]. Dans les études PIONEER I et II, l’adalimumab a obtenu des taux de réponse HiSCR50 de 42% et 59% respectivement, contre 26% et 28% pour le placebo [5]. Avant une intervention chirurgicale, la question se pose souvent de savoir s’il faut arrêter ou non le médicament biologique. Une étude publiée en 2021 a montré que l’adalimumab était efficace en association avec une chirurgie à grande échelle suivie d’une guérison secondaire, sans qu’il soit nécessaire d’interrompre le traitement avant la chirurgie [10]. L’étude SHARPS (Safety and Efficacy of Adalimumab for Hidradenitis Suppurativa Peri-Surgically) était une étude de phase IV randomisée, en double aveugle et contrôlée par placebo sur l’adalimumab associé à la chirurgie (figure 1). Au total, 103 patients ont été randomisés pour recevoir l’adalimumab ou un placebo. L’âge moyen (DS) était de 37,6 (11,3) ans, 51% des participants étaient des femmes. Une réponse clinique à l’HS dans toutes les régions du corps a été obtenue à la semaine 12 chez 48% des participants à l’étude sous adalimumab et 34% sous placebo (p=0,049). Des événements indésirables liés au traitement ont été rapportés dans 72% des cas dans le bras adalimumab et dans 69% des cas dans le bras placebo. Aucune augmentation du risque d’infection de plaie postopératoire, de complications ou d’hémorragie n’a été observée sous adalimumab par rapport au placebo.
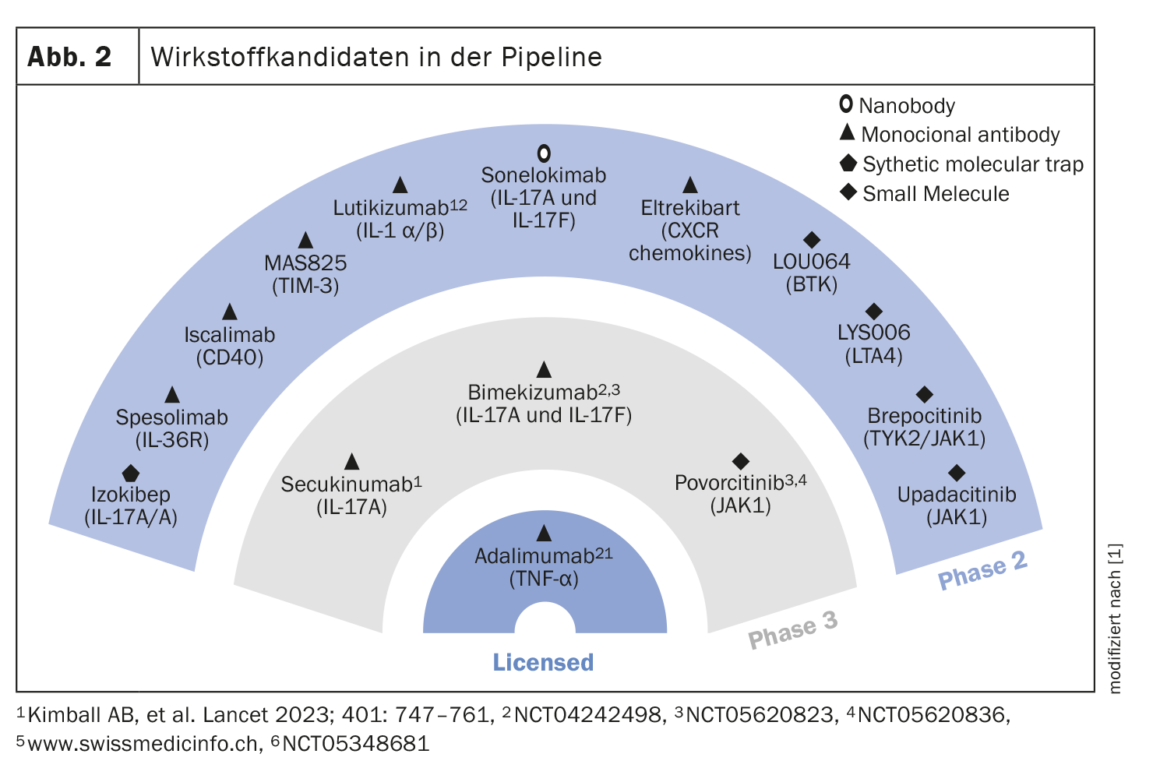
D’autres candidats médicaments dans le pipeline
Les molécules candidates actuellement en phase II et III sont présentées dans la figure 2. Deux études cliniques ont montré que le sécukinumab, un inhibiteur de l’IL17A, administré à deux doses (300 mg toutes les 2 semaines et toutes les 4 semaines), présentait des taux de réponse stables jusqu’à la semaine 52, avec respectivement 54,8% et 55,3% dans SUNSHINE et 63,4% et 58,6% dans SUNRISE [6]. Le bimekizumab, un double inhibiteur de l’IL17A/F (320 mg q2w), a atteint le critère d’évaluation primaire du HiSCR50 dans l’étude BE HEARD I par rapport au placebo et a également atteint le niveau de signification dans BE HEARD II. Le spesolimab est un anticorps monoclonal qui cible l’IL36R [7]. Dans une étude de preuve de concept, le spesolimab s’est révélé très efficace à la semaine 12, notamment en ce qui concerne les fistules drainantes. La dose de charge était de 1200 mg (i.v.) aux semaines 0,1 et 2. En traitement d’entretien, la même dose a été administrée aux semaines 4,6,8 et 10. L’izokibep est un autre candidat médicament qui fait l’objet de recherches pour une utilisation dans l’HS. Sa cible est l’homodimère IL17A. La petite taille des molécules permet une meilleure pénétration dans les tissus. Dans une étude non contrôlée par placebo menée en open-label auprès de 30 patients, 71% d’entre eux ont obtenu une réponse HiSCR50 à la semaine 12 sous izokibep 160 mg [8]. Le povorcitinib est un inhibiteur sélectif de JAK1 pour lequel des données de phase II sont disponibles dans le domaine d’indication HS. A la dose la plus élevée (90 mg), plus de 80% des 9 patients ont atteint le HiSCR50 à la semaine 8 [9].
Congrès : réunion annuelle de la DDG
Littérature :
- «Acne inversa: Medikamente, Messer, Mischung», Prof. Dr. med. Falk Bechara, DDG-Jahrestagung, 26.–29.04.2023.
- Johnston LA, et al.: Practical Guidelines for Managing Patients With Hidradenitis Suppurativa: An Update. J Cutan Med Surg 2022; 26(2_suppl): 2S–24S.
- Daxhelet M, et al.: Proposed definitions of typical lesions in hidradenitis suppurativa. Dermatology 2020; 236(5): 431–438.
- Revuz JE, Jemec GBE: Diagnosing hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 1–5.
- Kimball AB, et al.: Two Phase 3 Trials of Adalimumab for Hidradenitis Suppurativa. NEJM 2016; 375: 422–434.
- Kimball AB, et al.: Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023; 401(10378): 747–761.
- Alavi et al. Spesolimab for Hidradenitis Suppurativa: a proof-of-concept study in patients with Hidradenitis suppurativa. AAD 2023; Poster 43019
- Papp K, et al.: Izokibep, a novel IL17A-inhibitor demnstrates HiSCR100 Responses in moderate-to-severe Hidradenitis suppurativa: week 12 results of open-label par A of a Phase 2b/3-study. AAD 2023; Late-breaking oral.
- Alavi A, et al.: Janus kinase 1 inhibitor INCB054707 for patients with moderate-to-severe hidradenitis suppurativa: results from two phase II studies. Br J Dermatol 2022; 186(5): 803–813.
- Bechara FG, et al.: Efficacy and Safety of Adalimumab in Conjunction With Surgery in Moderate to Severe Hidradenitis Suppurativa: The SHARPS Randomized Clinical Trial. JAMA Surg 2021; 156(11): 1001–1009.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Akt Dermatol 2019; 45: 277–287.
- Melendez Gonzalez MDM, Sayed CJ. Surgery is an essential aspect of managing patients with hidradenitis suppurativa. J Am Acad Dermatol 2020; 83(3): 979–980.
- Janse I, et al.: Surgical procedures in hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 97109.
DERMATOLOGIE PRAXIS 2023; 33(3): 28–29