Les kératoses actiniques (KA) sont associées aux carcinomes épidermoïdes, mais on sait encore peu de choses sur le risque de progression de certaines lésions. La carcinogénèse sur le terrain ou un nombre plus élevé de lésions et le degré d’hyperprolifération des cellules kératinocytaires atypiques semblent toutefois être des facteurs pertinents. Le score AKASI est un bon outil pratique pour évaluer la sévérité de l’AK et le succès du traitement. Le diagnostic de l’AK peut aujourd’hui être confirmé par des méthodes modernes non invasives.
Les kératoses actiniques (KA) sont l’une des dermatoses les plus fréquentes sur les peaux chroniquement endommagées par le soleil. Il s’agit de lésions cutanées précancéreuses résultant de la prolifération de kératinocytes atypiques sur une peau endommagée par les UV, touchant en particulier le visage, le cuir chevelu sans cheveux et les extrémités. Selon les données épidémiologiques, la prévalence de l’AK chez les personnes de plus de 60 ans est comprise entre 20 et 35% [1–3].
L’AK est une maladie précancéreuse facultative
Une étude de cohorte avec un suivi de 5 ans a montré que 65% des carcinomes épidermoïdes (SCC) se développaient à partir de lésions AK préexistantes [4]. Dans une autre étude, la probabilité d’une progression vers un CCS dans les 10 ans a été estimée à environ 10% chez les patients ayant une moyenne de 7,7 CA [19].
“Les études de séquençage du génome confirment que les kératoses actiniques sont des lésions précancéreuses”, a déclaré le professeur Nicole Kelleners-Smeets du Maastricht University Medical Center (NL) [5]. La conclusion d’une grande étude de génétique moléculaire utilisant le séquençage de l’exome est que les AK sont caractérisés par des altérations génomiques que l’on retrouve également dans les SCC, y compris des anomalies dans la voie de transduction du signal du TGF-β [6]. En accord avec d’autres études, des mutations dans TP53 et NOTCH ont également été détectées. Une inactivation précoce de NOTCH1 due à la mutation dans les AK facilite éventuellement la progression de l’AK vers le SCC [6]. TP53 est un gène suppresseur de tumeur dont le produit génique (la protéine p53) agit comme un facteur de transcription. Il est activé par le stress cellulaire, par exemple les dommages à l’ADN induits par les UV. Bien que l’on dispose de plus en plus de connaissances sur les facteurs favorisant la progression vers le SCC, il reste difficile d’évaluer quelles lésions AK présentent un risque élevé et quelles lésions régresseront. Le fait que le traitement de la maladie d’Alzheimer puisse prévenir le développement d’un SCC est désormais bien établi, a souligné l’oratrice.
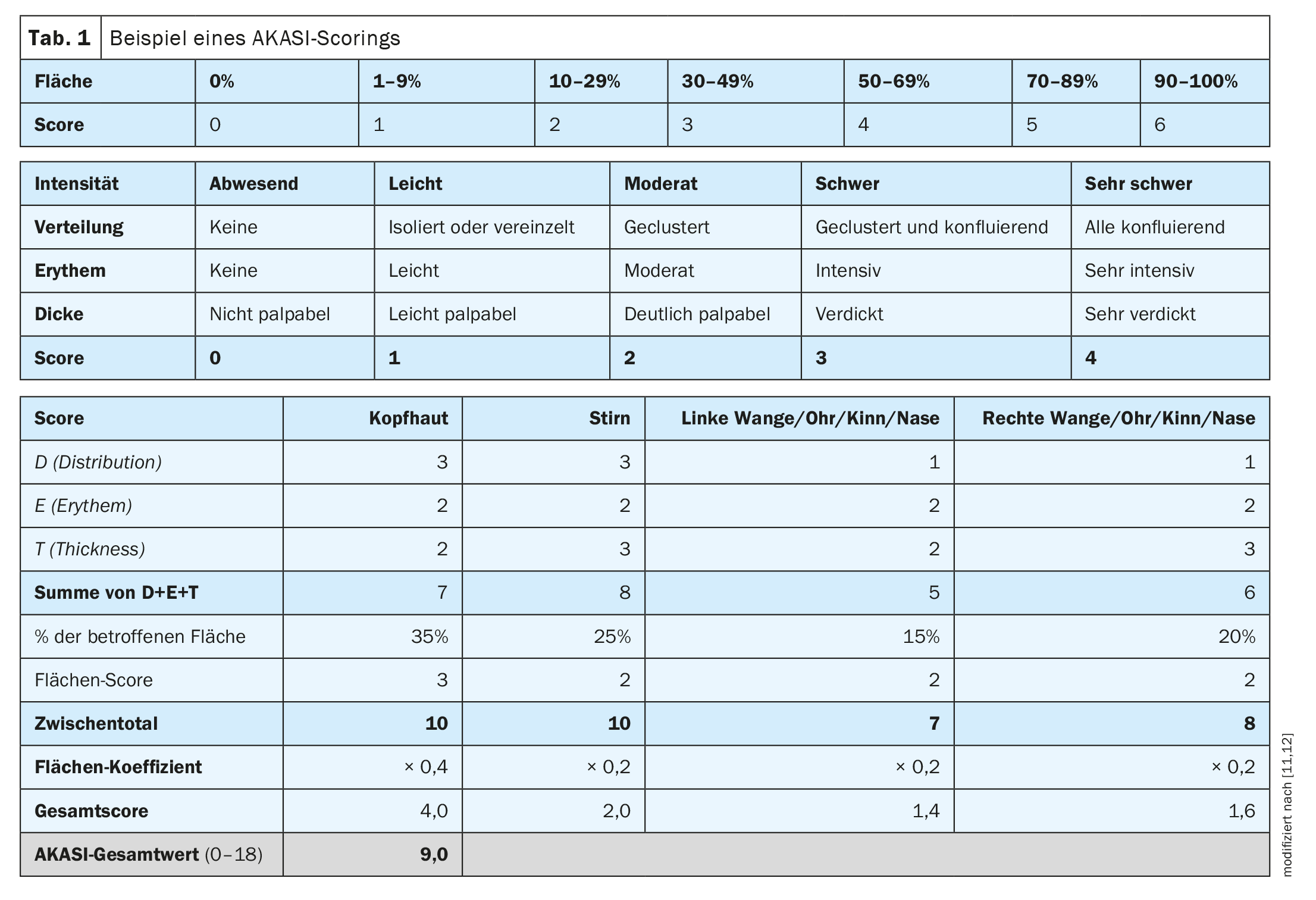
| On estime que le risque de progression de l’AK vers le SCC est de 0,025% à 16% pour une seule lésion par an. Selon ces données, les taux de transformation pour un patient présentant 6 à 8 lésions sont de 0,15 à 80% par an [9]. Actuellement, les preuves concernant les facteurs pronostiques déterminant le passage de l’AK au SCC restent insuffisantes [9]. Des études récentes indiquent que la classification actuelle des AK et l’estimation du risque de progression devraient être reconsidérées [13,14]. Dans le contexte de l’apparition de l’AK dans le cadre d’une cancérologie de terrain et d’une corrélation positive entre le nombre de lésions et la probabilité de progression, de nouveaux critères d’évaluation des stades de l’AK sont proposés [9]. L’AKASI (actinic keratosis area and severity index) est actuellement un outil pertinent pour évaluer la sévérité de l’AK, mais aussi pour évaluer le succès du traitement [12]. |
Utiliser des méthodes non invasives pour diagnostiquer les AK
Selon les directives S3 actuelles, l’indication au traitement de la CA doit être posée en tenant compte du tableau clinique et des facteurs de risque (par ex. immunosuppression, exposition cumulative aux UV, nombre de lésions) [9]. Histologiquement, l’une des caractéristiques des AK est l’accumulation de kératinocytes atypiques dans le stratum basale de l’épiderme, d’où ils peuvent, au fil du temps, pénétrer dans le stratum granulosum et la couche cornée [16,17]. Les kératinocytes altérés de l’AK présentent des noyaux hyperchromatiques, pléomorphes et agrandis, ainsi qu’une relation noyau-cytoplasme élevée [9]. Alors que les examens histopathologiques étaient autrefois nécessaires pour identifier les lésions précancéreuses de la peau, plusieurs techniques de diagnostic non invasives sont aujourd’hui disponibles, notamment la dermatoscopie, la microscopie confocale à réflexion (RCM) et la tomographie par cohérence optique (OCT) ou Line-Field-OCT, a expliqué le professeur Giuseppe Micali, de l’université de Catane (I) [7]. La dermatoscopie a une sensibilité (environ 98%) et une spécificité (environ 95%) élevées pour la détection des AK, selon l’orateur [7]. Cependant, les AK pigmentées seraient parfois difficiles à différencier cliniquement et dermatoscopiquement d’autres lésions cutanées, comme le lentigo malin. Outre la dermatoscopie, une autre technique de diagnostic non invasive est disponible avec la MRC. La RCM permet de visualiser le substrat cytomorphologique des structures dermatoscopiques suspectes au niveau cellulaire [8]. Dans une carcinose de terrain, la peau endommagée par la lumière présente souvent un motif atypique en nid d’abeille, signe d’une AK subclinique [9]. Une nouvelle technique d’imagerie non invasive est la LC-OCT. En visualisant les cellules individuelles avec une haute résolution et une profondeur de pénétration allant jusqu’à 500 μm, la précision du diagnostic peut être considérablement augmentée.
AKASI comme outil d’évaluation de la gravité
Dans la pratique clinique quotidienne, il s’agit également d’évaluer la gravité des kératoses actiniques comme base pour les décisions thérapeutiques, selon le Dr Girish Gupta, dermatologue et maître de conférences clinique, Université d’Edimbourg (Royaume-Uni) [10]. “Nous savons que les carcinomes épidermoïdes sont associés aux AK”, a expliqué le conférencier [10]. L’AKASI (“Actinic keratoses activity and severity index”) a été développé pour évaluer et surveiller la sévérité [12]. “Nous pourrions peut-être utiliser le score AKASI pour évaluer les risques”, a déclaré le Dr Gupta. Le fait que l’AKASI soit un très bon outil pour évaluer objectivement la gravité de l’AK correspond également à l’avis du Prof. Dr Thomas Dirschka, Centroderm Klinik Wuppertal (D) [11,12]. Selon lui, l’AKASI permet de quantifier facilement les lésions (tableau 1) [11,12]. Dans une étude publiée en 2018 par Schmitz et al. a cherché à savoir si et comment le score AKASI était associé aux tumeurs kératinocytaires [18]. La conclusion était que les patients ayant un score AKASI >7 avaient probablement un risque plus élevé de développer un SCC invasif par rapport aux patients AK ayant un score inférieur.
En ce qui concerne les méthodes non invasives décrites, le professeur Dirschka a souligné que la LC-OCT était une très bonne méthode de diagnostic pour détecter les lésions potentiellement dangereuses. Les coupes horizontales et verticales ainsi que les aspects histologiques sont affichés en temps réel.
Le risque de transformation maligne est corrélé au nombre de lésions
“L’objectif le plus important est de prévenir la progression vers le SCC”, a déclaré le professeur Dirschka, ajoutant : “Nous avons besoin de thérapies pour les patients à risque” [11]. Plus le nombre de lésions est élevé, plus le risque que l’une d’entre elles évolue en SCC est important. C’est pourquoi le nombre de lésions et la cancérogenèse de terrain jouent un rôle important dans le risque de progression, a déclaré l’orateur. Dans ce contexte, il s’interroge sur la limitation de la surface à traiter (25 cm2). Les données relatives au risque de développement d’un SCC à partir d’un seul AK en l’espace d’un an sont estimées dans la littérature spécialisée entre 0,025 et 16%, bien que le risque de progression soit encore peu connu à l’heure actuelle [9]. Mais le risque est plus élevé lorsque le nombre de lésions est plus important, selon le professeur Dirschka. En supposant que le risque de progression d’une seule lésion AK soit de 16% par an, cela signifie qu’avec 40 lésions, le risque correspondant est supérieur à 99% [11].
Approche pragmatique – quels sont les objectifs thérapeutiques visés ?
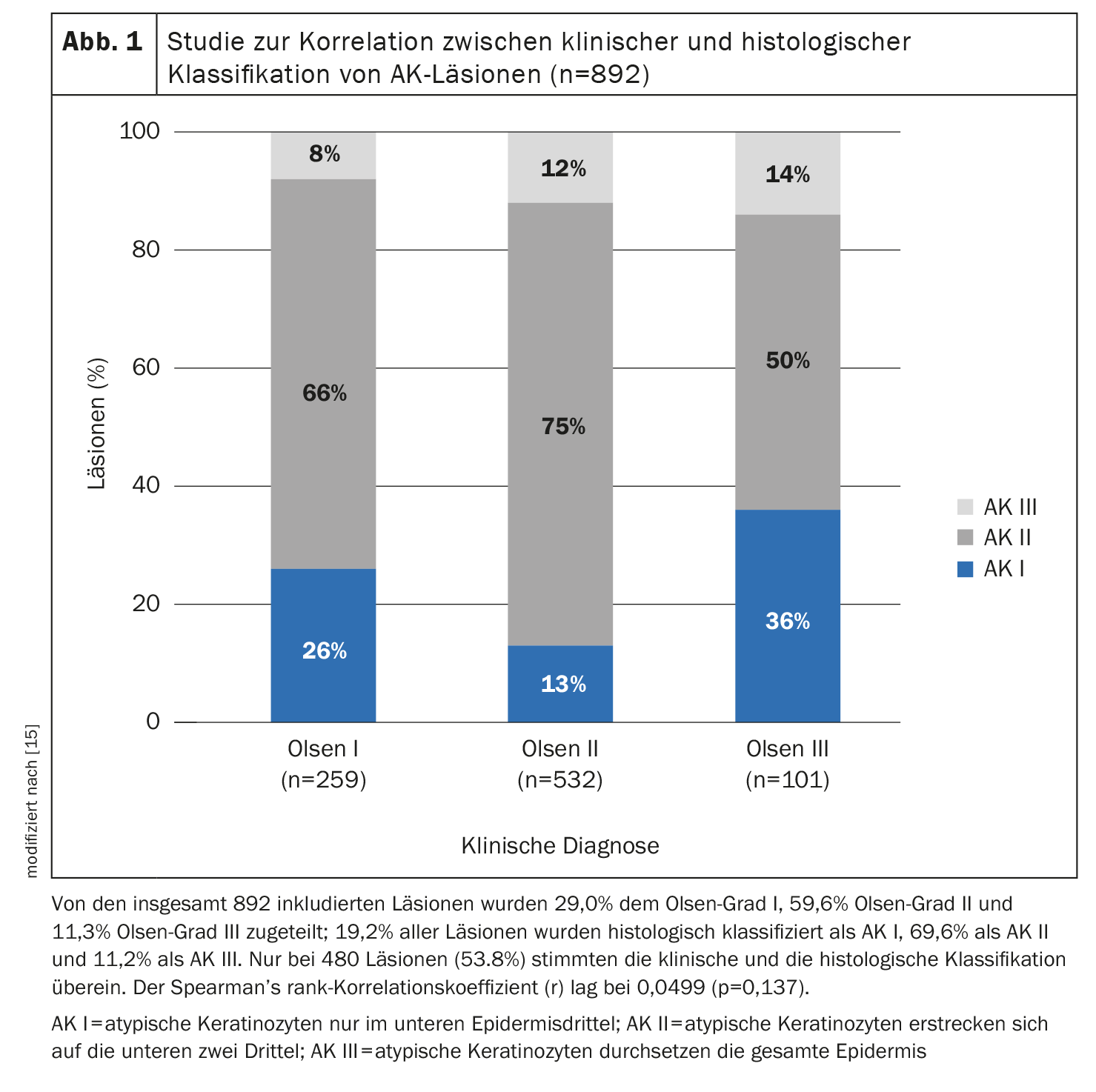
L’ampleur de la prolifération basale des cellules kératinocytaires atypiques est un critère important, selon le professeur Dirschka [11]. Il considère que les restrictions de traitement basées sur la classification d’Olsen, qui ont été introduites dans le contexte d’études cliniques, n’ont pas de sens dans la pratique clinique quotidienne. D’une part, dans une étude, la classification d’Olsen n’était que relativement peu corrélée à la classification histopathologique des lésions AK (épaisseur des lésions) (figure 1) et, d’autre part, il y aurait des lésions Olsen I avec beaucoup d’hyperprolifération et des lésions Olsen III avec peu d’hyperprolifération. Il estime également qu’il est dépassé de limiter la localisation des zones. Il est important de ne pas se focaliser exclusivement sur le visage et le cuir chevelu, mais aussi sur les extrémités, a-t-il ajouté. En conclusion, l’orateur indique que l’absence totale de lésion est un objectif de traitement plutôt irréaliste en cas de carcinose de terrain et qu’il est préférable de viser une réduction du score AKASI. En outre, les lésions résistantes au traitement doivent faire l’objet d’une attention particulière car elles sont potentiellement dangereuses.
Littérature :
- Ferrándiz C, et al.: EPIQA Study Group; Prevalence of actinic keratosis among dermatology outpatients in Spain. Actas Dermosifiliogr 2016; 107(8): 674–680.
- Flohil SPC, et al.: Prevalence of actinic keratosis and its risk factors in the general population: the Rotterdam Study. J Invest Dermatol 2013; 133(8): 1971–1978
- Eder J, et al.: Prevalence of actinic keratosis among dermatology outpatients in Austria. Br J Dermatol 2014; 171(6): 1415–1421.
- Criscione VD, et al : Actinic keratoses : natural history and risk of malignant transformation in the veterans affairs topical tretinoin chemoprevention trial. Cancer 2009 ; 115(11) : 2523-2530.
- «Biology of AK», Symposium 8: Management of actinic keratosis and field cancerization, Prof. Dr. Nicole Kelleners-Smeets, EADO Annual Meeting, 20–22 April 2023.
- Thomson J, et al.: The Genomic Landscape of Actinic Keratosis. J Invest Dermatol 2021; 141(7): 1664–1674.e7.
- «Imaging technologies as diagnostic tools for AK», Symposium 8: Management of actinic keratosis and field cancerization, Dr. Giuseppe Micali, EADO Annual Meeting, 20–22 April 2023.
- Ahlgrimm-Siess V, et al.: Diagnostischer Nutzen der Konfokalmikroskopie als weiterführende Untersuchungsmethode von Gesichtsläsionen. JDDG 2019; 17(3): 266–274.
- AWMF: S3-Leitlinie Aktinische Keratose und Plattenepithelkarzinom der Haut. Register-Nr. 032-022OL, Version 2.0: https://register.awmf.org, (letzter Abruf 04.07.2023)
- «Treatment Update – AK», Dr. Girish Gupta, Symposium 8: Management of actinic keratosis and field cancerization, EADO Annual Meeting, 20–22 April 2023.
- «New approaches to study design in AK», Prof. Dr. Thomas Dirschka, Symposium 8: Management of actinic keratosis and field cancerization, EADO Annual Meeting, 20–22 April 2023.
- Dirschka T, et al; Athens AK Study Group: A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index. J Eur Acad Dermatol Venereol 2017; 31(8): 1295–1302.
- Dirschka T, et al.: A proposed scoring system for assessing the severity of actinic keratosis on the head: actinic keratosis area and severity index. J Eur Acad Dermatol Venereol 2017; 31(8): 1295–1302.
- Dreno B, et al.: A Novel Actinic Keratosis Field Assessment Scale for Grading Actinic Keratosis Disease Severity. Acta dermato-venereologica 2017; 97(9): 1108–1113.
- Schmitz L, et al.: Actinic keratosis: correlation between clinical and histological classification systems. J Eur Acad Dermatol Venereol 2016; 30(8): 1303–1307.
- Babilas P, Landthaler M, Szeimies RM: Die aktinische Keratose. Hautarzt 2003; 54: 551–562.
- Fu W, Cockerell CJ: The actinic (solar) keratosis: a 21st-century perspective. Arch Dermatol 2003; 139: 66–70.
- Schmitz L, et al.: Actinic keratosis area and severity index (AKASI) is associated with the incidence of squamous cell carcinoma. J Eur Acad Dermatol Venereol 2018; 32(5): 752–756.
- Marks R, Rennie G, Selwood TS: Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet 1988; 1: 795–797.
DERMATOLOGIE PRAXIS 2023; 33(4): 28–30