Les cardiopathies ischémiques sont la conséquence d’un flux sanguin coronaire insuffisant. Bien que la mesure directe du débit sanguin absolu (mL/min) soit possible, elle n’est pas entrée dans la routine clinique de la plupart des laboratoires de cathétérisme. Récemment, une méthode CFD (Computational Fluid Dynamics) a été décrite pour prédire le flux en distinguant le flux d’entrée, de branche latérale et de sortie pendant l’angiographie. Une étude récente a évalué une nouvelle méthode qui régionalise le flux le long de la longueur de l’artère.
La cardiopathie ischémique (CI) est la première cause de mortalité dans le monde et résulte d’une insuffisance du flux sanguin coronaire (Q), généralement causée par une maladie coronarienne. Elle englobe un grand nombre de syndromes cliniques tels que l’ischémie symptomatique (angine de poitrine), l’infarctus du myocarde et l’insuffisance cardiaque. Les traitements interventionnels sont efficaces pour restaurer la Q, mais ne doivent cibler que les lésions qui entraînent une ischémie. Cependant, pour une utilisation clinique de routine en laboratoire de cathétérisme cardiaque, il n’existe aucune technique permettant de mesurer directement le Q. Pendant plusieurs décennies, les cardiologues se sont appuyés sur des marqueurs indirects de substitution, tels que le temps de transit moyen dérivé de la thermodilution, la vitesse de flux dérivée du Doppler et la réserve fractionnelle de flux (FFR) dérivée de la pression [2-4] et, plus récemment, la FFR “virtuelle” (vFFR) calculée à partir d’images angiographiques [5]. Toutes ces méthodes ont des points forts et des points faibles, mais aucune ne mesure le Q “absolu” en mL/min.
Deux méthodes ont été développées pour quantifier Q : La première, la thermodilution par perfusion continue (CIT), est la méthode la plus établie et la plus validée et utilise le cathéter de perfusion Rayflow™ [6,7]. La seconde, virtuQ™, dérive Q d’une simulation CFD basée sur l’anatomie 3D de l’angiographie et des mesures de fils de pression. Les deux méthodes quantifient également la résistance microvasculaire absolue (Rmicro), fournissant ainsi une évaluation complète de l’ensemble de la circulation coronaire. L’une des limites de la méthode CFD était que seul le vaisseau principal était pris en compte et que l’écoulement dans les branches latérales n’était pas pris en compte [8]. Si cela peut être acceptable pour le calcul du vFFR, qui n’interroge que sur les effets d’une lésion localisée, ce n’est pas le cas pour le calcul de Q, qui dépend de la lésion, des branches latérales et de la structure microvasculaire [9].
Une étude récente a décrit une méthode de simulation à paroi poreuse utilisant des lois d’échelle morphométriques établies et des connaissances spécifiques au cas par cas sur le rétrécissement artériel pour permettre la sortie du sang du vaisseau principal proportionnellement au flux des branches latérales [9]. L’une des limites de cette approche était que le flux des branches latérales était diffus sur toute la longueur du vaisseau principal. Cette approche n’a donc pas permis d’évaluer les effets hémodynamiques d’un volume important de perte de flux régionalisée dans les grosses branches latérales artérielles. Une étude récente décrit une nouvelle méthode qui tente de corréler les “fuites” dans les branches latérales avec les zones de bifurcations significatives, et qui représente donc le modèle d’écoulement fréquemment rencontré dans les artères coronaires réelles. L’objectif était de valider cette nouvelle méthode à l’aide de mesures CIT et de comparer les résultats avec ceux de la méthode CFD homogène [1].
Collecte de données cliniques
La FFR a été mesurée dans les artères d’intérêt avec une technique standard (PressureWire™) et une dérive maximale du signal tolérée de 2 mmHg [10], le cathéter de perfusion Rayflow™ et le système Coroventis™ [6,7] ont été utilisés pour quantifier Q (QCIT) et Rmicro (RmicroCIT). Les mesures de thermodilution ont été effectuées dans l’artère coronaire proximale, tandis que les mesures de pression sous hyperémie induite par le sel ont été prises à 6 cm distaux de l’extrémité du cathéter de perfusion [7].
Simulation du flux sanguin coronaire
Pour reconstruire l’anatomie de la coronaire, nous avons utilisé deux projections angiographiques du vaisseau d’intérêt, prises à une distance de ≥30° et pendant la diastole finale. La sélection des images et la correction du mouvement de la table entre les passages angiographiques ont été effectuées manuellement, tandis que le suivi de la ligne médiane et la détection des bords des vaisseaux ont été réalisés de manière semi-automatique à partir du gradient de contraste pour les deux images, avec une correction manuelle si nécessaire. Enfin, une géométrie 3D rigide et axisymétrique a été automatiquement créée pour représenter l’anatomie du patient. L’entrée des artères reconstruites correspondait au site de la mesure invasive du QCIT et de la Pa, tandis que la sortie correspondait au site de la Pd. Les mesures de pression invasives ont été utilisées pour définir les conditions marginales d’entrée et de sortie. La simulation CFD a été réalisée en utilisant des paramètres sanguins standard (densité 1056 kg/m3; viscosité 0,0035 Pa s), qui modélisent un écoulement laminaire continu d’un fluide newtonien [11,12].
Simulation du flux des branches latérales
Dans l’étude actuelle, le flux dans les branches latérales a été simulé en modélisant des reconstructions d’artères avec une limite de paroi poreuse. Cela a permis une perte de débit de la lumière du vaisseau principal. La taille des branches latérales a été déduite du rétrécissement du vaisseau principal en utilisant la loi de Murray [13], qui met en relation les diamètres (D) du vaisseau principal (PV) et des branches secondaires (DB) autour d’une bifurcation :
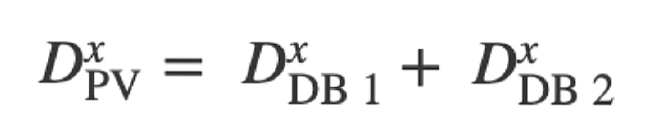
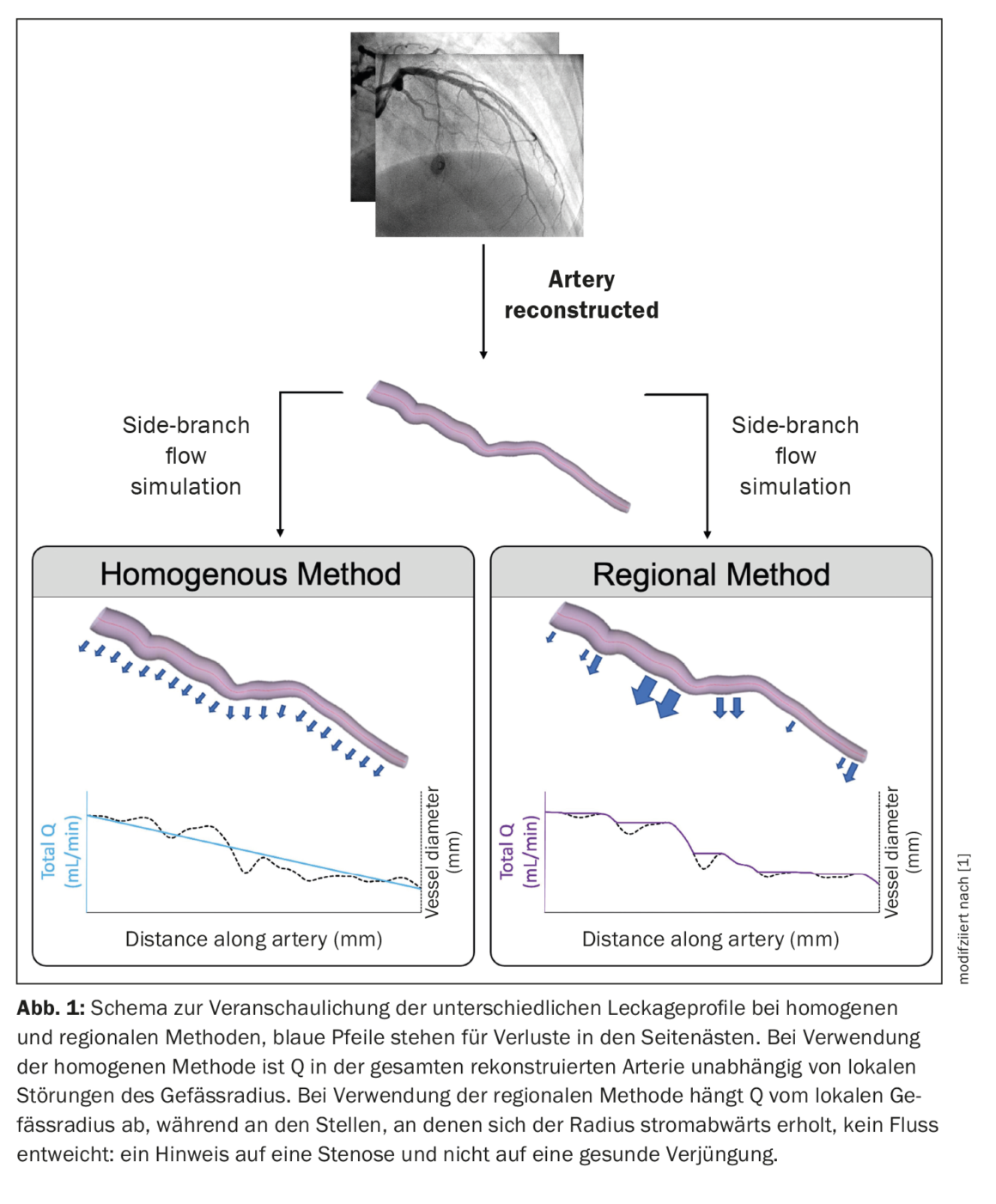
où “x” représente une constante dont la valeur varie entre 2,0 et 3,0 [14–16]. L’ampleur du flux des branches latérales dépendait de la valeur utilisée pour cette constante de proportionnalité et de la méthode utilisée pour répartir les pertes de charges latérales (homogène vs régionale). L’objectif était de comparer la précision des méthodes homogènes et régionales avec les masses dérivées de manière invasive. La méthode de la paroi poreuse homogène a réparti les pertes de branches latérales de manière uniforme sur toute la longueur du vaisseau reconstruit et n’a pas été affectée par un amincissement local. Dans la méthode de la paroi poreuse régionale, les pertes de flux des branches latérales ont été réparties proportionnellement au rétrécissement local du vaisseau sain. Ceci a été fait afin de mieux régionaliser Q. Dans les vaisseaux sains, le rajeunissement régional se produit aux points de ramification. Par conséquent, cette méthode devrait permettre de régionaliser plus précisément le flux sanguin dans l’artère in vivo. Afin de distinguer le rétrécissement des vaisseaux sains de la réduction de diamètre causée par les plaques d’athérosclérose, un filtre de détection des sténoses a été utilisé pour exclure les fuites poreuses de la paroi dans les sections où le diamètre des vaisseaux se rétablit en aval (Fig. 1) [1].
Cas cliniques
Sur les 48 cas initiaux, 27 cas de 20 patients ont fourni des enregistrements physiologiques complets. Sept patients (35%) étaient des hommes, l’âge moyen était de 62 (±10) ans et l’indice de masse corporelle (IMC) moyen était de 25,2 (±3,6) kg/m2. Les 27 cas concernaient l’artère descendante antérieure gauche (LAD) (n=18), l’artère circonflexe gauche (Cx) (n=7) et l’artère coronaire droite (RCA) (n=2). La QCIT moyenne était de 219 (±61) mL/min et la médiane de la RmicroCIT était de 360 [290–450] mmHg min/L. La majorité des cas inclus présentaient une maladie épicardique minimale, avec une FFR moyenne de 0,87 (±0,08) et seulement trois cas atteignant le seuil clinique de significativité de la FFR (≤0,80). La médiane du pourcentage de sténose déterminé par le chirurgien, l’ACQ 2D et l’ACQ 3D était respectivement de 10% [0–25%], 16% [0–31%] et 15% [0–33%]. Aucun des cas inclus ne présentait de maladie épicardique diffuse. En utilisant un seuil de 460 mmHg min/L25-27, cinq (25%) patients ont présenté une MVD cliniquement significative, évaluée par RmicroCIT.
La méthode de délimitation des parois poreuses homogènes
La méthode de confinement homogène de la paroi poreuse a donné un QCFD moyen de 219 (±86) mL/min. Il existait une corrélation statistiquement significative entre le QCFD et le QCIT (r=0,473, p=0,006), la régression de Passing et Bablok a révélé des différences constantes et proportionnelles entre les techniques (coefficient c -202, IC 95% -633 à -20 ; coefficient m 2,03, IC 95% 1,15 à 4,07), le delta moyen entre les techniques était nul et les limites de concordance de Bland-Altman à 95% étaient comprises entre -168 et +168 mL/min. Les différences proportionnelles entre QCFD et QCIT étaient caractérisées par une augmentation de la distorsion à des débits plus élevés, ce qui est représenté visuellement par l’analyse de Bland-Altman. Une corrélation significative entre RmicroCFD et RmicroCIT a également été observée (r=0,647, p=0,0001), des différences constantes et proportionnelles étaient présentes (coefficient c -400, IC 95% -950 à -90 ; coefficient m 2,07, IC 95% 1,15 à 3,67), le delta moyen entre les techniques était de +30 mmHg min/L et les limites de concordance de Bland-Altman à 95% étaient comprises entre -210 et +480 mmHg min/L.
La méthode de délimitation des parois poreuses régionales
La méthode de délimitation de la paroi poreuse régionale a donné un QCFD moyen de 219 (±96) mL/min. La corrélation entre le QCFD et le QCIT était significative (r=0,429, p=0,0127), la régression de Passing et Bablok a révélé des différences constantes et proportionnelles entre les techniques (coefficient c -220, IC 95% -687 à -16 ; coefficient m 2,12, IC 95% 1,18 à 4,19), le delta moyen entre les techniques était nul et les limites de concordance de Bland-Altman à 95% étaient comprises entre -175 et +175 mL/min. La concordance entre QCFD et QCIT n’était pas meilleure pour les techniques homogènes ou régionales (t=0,0023, p=0,998). Une corrélation significative entre RmicroCFD et RmicroCIT a également été observée (r=0,586, p=0,0006), des différences constantes et proportionnelles étaient présentes (coefficient c -400, IC à 95% -1030 à -60 ; coefficient m 2,09, IC à 95% 1,04 à 3,90), le delta moyen entre les techniques était de +37 mmHg min/L et les limites de concordance de Bland-Altman à 95% étaient de -220 à +540 mmHg min/L. La concordance entre le RmicroCFD et le RmicroCIT n’était pas meilleure, ni pour les méthodes homogènes, ni pour les méthodes régionales (U=363, p=0,944). À un seuil de 460 mmHg min/L, sept (35%) patients présentaient une MVD cliniquement significative, évaluée par RmicroCFD. En utilisant le RmicroCIT comme mesure gold standard, la sensibilité, la spécificité, la valeur prédictive positive et la valeur prédictive négative de la technique CFD étaient respectivement de 80%, 80%, 57% et 92%.
Déterminants de la conformité
Certaines caractéristiques des patients et des vaisseaux semblaient influencer la concordance entre la CFD et les mesures invasives. Pour les méthodes homogènes ou méthodes de limites de parois poreuses régionales, la concordance Q était significativement corrélée à la chute de pression transversale (Pa-Pd) (r=0,449, p=0,0094 ; r=0,391, p=0,0217), FFR (r=-0,399, p=0,0196 ; r= -0,334, p=0,0441) et le pourcentage de sténose déterminé par QCA 2D (r=0,355, p=0,0345 ; r=0,472, p=0,0065) et 3D (r=0,369, p=0,0292 ; r=0,489, p=0,0048). Cela signifiait, tant pour la méthode homogène que pour la méthode régionale, que la concordance entre QCFD et QCIT s’améliorait pour les cas avec une charge de morbidité plus importante, identifiés par des études de fil de pression, 2D-QCA et 3D-QCA. Pour la méthode régionale, la concordance Q était également corrélée à la sténose évaluée visuellement (r=0,371, p=0,0282).
Pour la méthode Rmicro, les méthodes homogène et régionale étaient toutes deux corrélées avec la chute de pression transversale (r=0,359, p=0,0330 ; r=0,340, p=0,0415) et la FFR (r=-0,368, p=0,0295 ; r=-0,364, p=0,0310), mais aucun effet n’a été observé pour l’évaluation de la sténose. Cela signifiait, tant pour la technique homogène que pour la technique régionale, que la concordance entre le RmicroCFD et le RmicroCIT s’améliorait dans les cas où la charge de morbidité évaluée par les examens au fil de pression était plus importante, alors que la charge de morbidité évaluée par le pourcentage de sténose n’était pas associée à la concordance.
Variabilité intra-opérateur
Pour les méthodes de confinement de parois poreuses homogènes et régionales, la variabilité du QCFD était respectivement de 7,8% (±4,2%) et de 5,6% (±2,7%). Pour le RmicroCFD, il était respectivement de 2,6% [4,6–6,1%] et 3,2% [1,9–10,2%]. La variabilité intra-observateur n’était pas différente entre les techniques homogènes et régionales pour le QCFD (U=33, p=0,218) ou le RmicroCFD (U=45, p=0,739).
Débit coronaire régionalisable à l’entrée, à la sortie et sur les branches latérales
L’étude rétrospective a validé une méthode de limite de paroi poreuse régionalisée pour simuler le Q de bras latéral et a comparé les résultats avec ceux de la méthode homogène initiale [15]. L’objectif principal était de régionaliser le flux des bras latéraux et des bras principaux. Ce résultat a été obtenu sans que l’écoulement global dans le bras latéral ne soit sensiblement modifié par rapport à la méthode homogène. La nouvelle méthode régionalisée a été corrélée avec les mesures CIT avec un écart nul et une limite de concordance de 95% de ±175 mL/min. La concordance avec les mesures cliniques invasives était sous-optimale, ce qui pourrait être dû à l’inclusion de plusieurs cas INOCA présentant une sténose et un gradient de pression minimaux.
Pendant l’angiographie et l’évaluation du fil de pression, le flux coronaire peut maintenant être régionalisé et distingué à l’entrée, à la sortie et aux branches latérales. L’impact de la maladie épicardique sur la concordance suggère que le modèle est le mieux adapté aux cas de sténose à proximité des branches latérales.
Littérature :
- Taylor DJ MA, et al.: Validation of a novel numerical model to predict regionalized blood flow in the coronary arteries. EurHeartJ 2023.
https://doi.org/10.1093/ehjdh/ztac077 - Gould KL, Lipscomb K, Hamilton GW: Physiologic basis for assessing critical coronary stenosis. Instantaneous flow response and regional distribution during coronary hyperemia as measures of coronary flow reserve. Am J Cardiol 1974;33: 87–94.
- De Bruyne B, Paulus WJ, Vantrimpont PJ, et al.: Transstenotic coronary pressure gradient measurement in humans: in vitro and in vivo evaluation of a new pressure monitoring angioplasty guide wire. J Am Coll Cardiol 1993;22: 119–126.
- Fearon WF, Balsam LB, Farouque HM, et al.: Novel index for invasively assessing the coronary microcirculation. Circulation 2003;107: 3129–3132.
- Ghobrial M, Haley HA, Gosling R, et al.: The new role of diagnostic angiography in coronary physiological assessment. Heart 2021;107: 783–789.
- Aarnoudse W, Van’t Veer M, Pijls NH, et al.: Direct volumetric blood flow measurement in coronary arteries by thermodilution. J Am Coll Cardiol 2007;50: 2294–2304.
- van’t Veer M, Adjedj J, Wijnbergen I, et al.: Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention 2016;12: 701–707.
- Morris PD, Gosling R, Zwierzak I, et al.: A novel method for measuring absolute coronary blood flow & microvascular resistance in patients with ischaemic heart disease. Cardiovasc Res 2020;117: 1567–1577.
- Gosling RC, Sturdy J, Morris PD, et al.: Effect of side branch flow upon physiological indices in coronary artery disease. J Biomech 2020;103: 109698.
- Pijls NH, van Son JA, Kirkeeide RL, et al.: Experimental basis of determining maximum coronary, myocardial, and collateral blood flow by pressure measurements for assessing functional stenosis severity before and after percutaneous transluminal coronary angioplasty. Circulation 1993;87: 1354–1367.
- Morris PD: Computational fluid dynamics modelling of coronary artery disease. PhD thesis. University of Sheffield 2015. https://etheses.whiterose.ac.uk/11772/1/CFD Modelling of CAD Morris_
submitted.pdf - Brown AG, Shi Y, Marzo A, et al.: Accuracy vs. computational time: translating aortic simulations to the clinic. J Biomech 2012;45: 516–523.
- Murray CD: The physiological principle of minimum work: I. The vascular system and the cost of blood volume. Proc Natl Acad Sci USA 1926;12: 207.
- Huo Y, Kassab GS: Intraspecific scaling laws of vascular trees. J R Soc Interface 2012;9: 190–200.
- Kamiya A, Togawa T: Optimal branching structure of the vascular tree. Bull Math Biophys 1972;34: 431–438.
- Murray CD: The physiological principle of minimum work: I. The vascular system and the cost of blood volume. Proc Natl Acad Sci U S A 1926;12: 207–214.
CARDIOVASC 2023; 22(1): 32–34











