L’accompagnement par le médecin généraliste du patient et de ses proches/aidants est essentiel pour que la maladie évolue le mieux possible. La pharmacothérapie n’est qu’un élément de la prise en charge intégrale et multifactorielle de la démence. Les facteurs de polymédication et les profils de risque/bénéfice individuels doivent toujours être pris en compte dans le concept de traitement. L’utilisation d’antidépresseurs traditionnels et modernes tels que les inhibiteurs de la cholinestérase, la mémantine ou l’extrait de ginkgo a fait l’objet de nouvelles recherches.
Malgré les énormes investissements financiers de l’industrie pharmaceutique, aucun traitement curatif de la démence n’est encore en vue. Après les nombreux revers essuyés dans le développement de traitements dans le domaine de l’amyloïde, il fallait ouvrir davantage l’éventail des pistes de recherche. Outre l’immunothérapie à l’aide d’anticorps anti-tau (le tau est le deuxième dépôt typique, avec l’amyloïde, de la démence d’Alzheimer), d’autres approches innovantes, telles qu’un traitement anti-inflammatoire via une modification ciblée de la flore intestinale, font l’objet d’essais scientifiques.
Les troubles cognitifs chez les personnes âgées sont fréquents et, s’ils sont diagnostiqués tôt et correctement, les mesures médicamenteuses et non médicamenteuses disponibles aujourd’hui ne permettent sans doute pas de les guérir, mais elles peuvent avoir une influence positive décisive. L’évaluation et le traitement sont adaptés à chaque patient et dépendent essentiellement du consentement, de l’état de santé et des conditions de vie sociale du patient.
Introduction
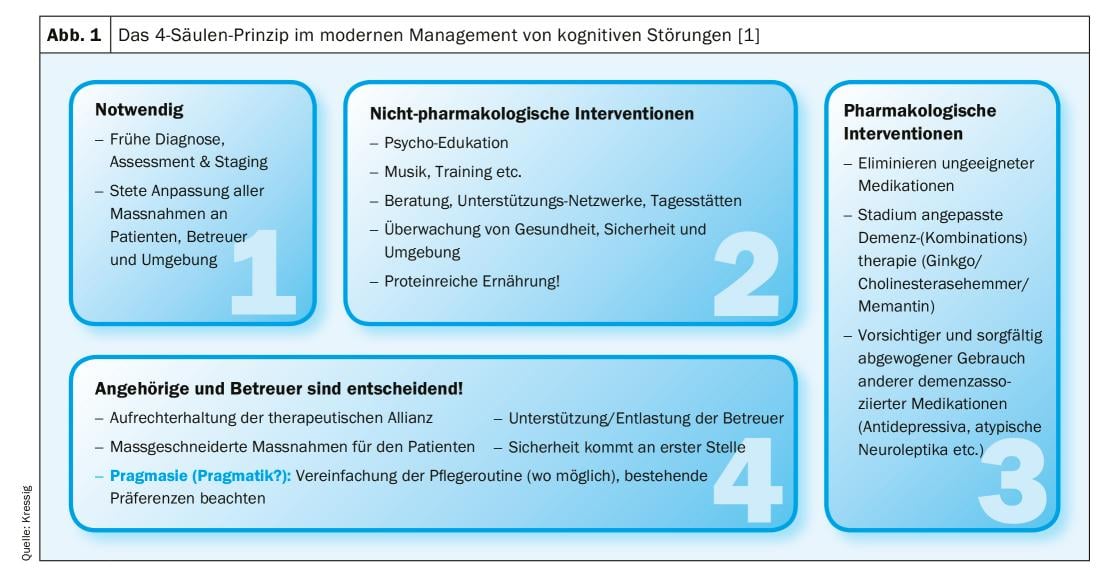
Nous pouvons faire face aux plaintes des patients concernant les troubles cognitifs chez les jeunes adultes, mais plus particulièrement chez les enfants. 3. et 4e âge. Dans tous les cas, ces plaintes doivent être prises au sérieux, car un diagnostic correct et la mise en place précoce de mesures thérapeutiques peuvent modifier considérablement l’évolution ultérieure. Bien que le terme “démence” n’existe plus vraiment depuis l’introduction du DSM-5 et que l’on ne parle désormais plus que de “troubles neurocognitifs sévères”, cette pathologie fréquente chez les personnes âgées (une personne sur trois de plus de 85 ans est concernée !) n’a évidemment pas disparu. Bien que l’incidence de la démence ait diminué jusqu’à 50% au cours des 20 dernières années en raison de l’amélioration significative du traitement des facteurs de risque vasculaires, les changements démographiques ont pratiquement neutralisé ces progrès médicaux en termes de chiffres. La prise en charge moderne des troubles cognitifs dans le développement de la démence repose sur 4 piliers (Fig. 1) : Un diagnostic précoce et précis, un traitement médicamenteux, des mesures thérapeutiques non médicamenteuses et un soutien/accompagnement ciblé des proches et des soignants [1].
Existe-t-il des troubles cognitifs “normaux” chez les personnes âgées ?
Les patients – comme nous les médecins – ont tendance à blâmer le vieillissement ou l’âge en général en cas d’augmentation des oublis et autres “petits” dysfonctionnements cérébraux. Le fait est différent. Le vieillissement cérébral normal est très bien étudié scientifiquement et n’est associé qu’à un discret ralentissement des processus de pensée et de réaction. Ainsi, si un nom ne peut pas être mémorisé immédiatement, mais après un certain temps, cela est encore “normal”. Si vous avez toujours eu une mauvaise mémoire des noms, ne vous attendez pas à ce qu’elle s’améliore avec l’âge ! Mais si l’oubli est récent et que la souffrance subjective qu’il provoque chez les patients est présente (même en cas d’examen neuropsychologique avec des résultats normaux), les dernières connaissances indiquent qu’il s’agit d’un “Subjective Cognitive Decline”, qui conduit à une démence dans 25% des cas dans les 6 ans [2]. Malheureusement, beaucoup réduisent encore les troubles cérébraux à la mémoire et à l’oubli. Mais notre cerveau fait bien plus que cela ! De nombreux processus démentiels commencent dans d’autres zones du cerveau, où la détérioration (alors que la mémoire est préservée) se manifeste en premier lieu par un comportement différent (par exemple, plus de problèmes avec des tâches complexes comme la gestion des affaires financières ou même la préparation de menus plus compliqués ! De tels changements ne sont pas normaux et doivent être clarifiés !
Délimitation entre “normal” et “pathologique”.
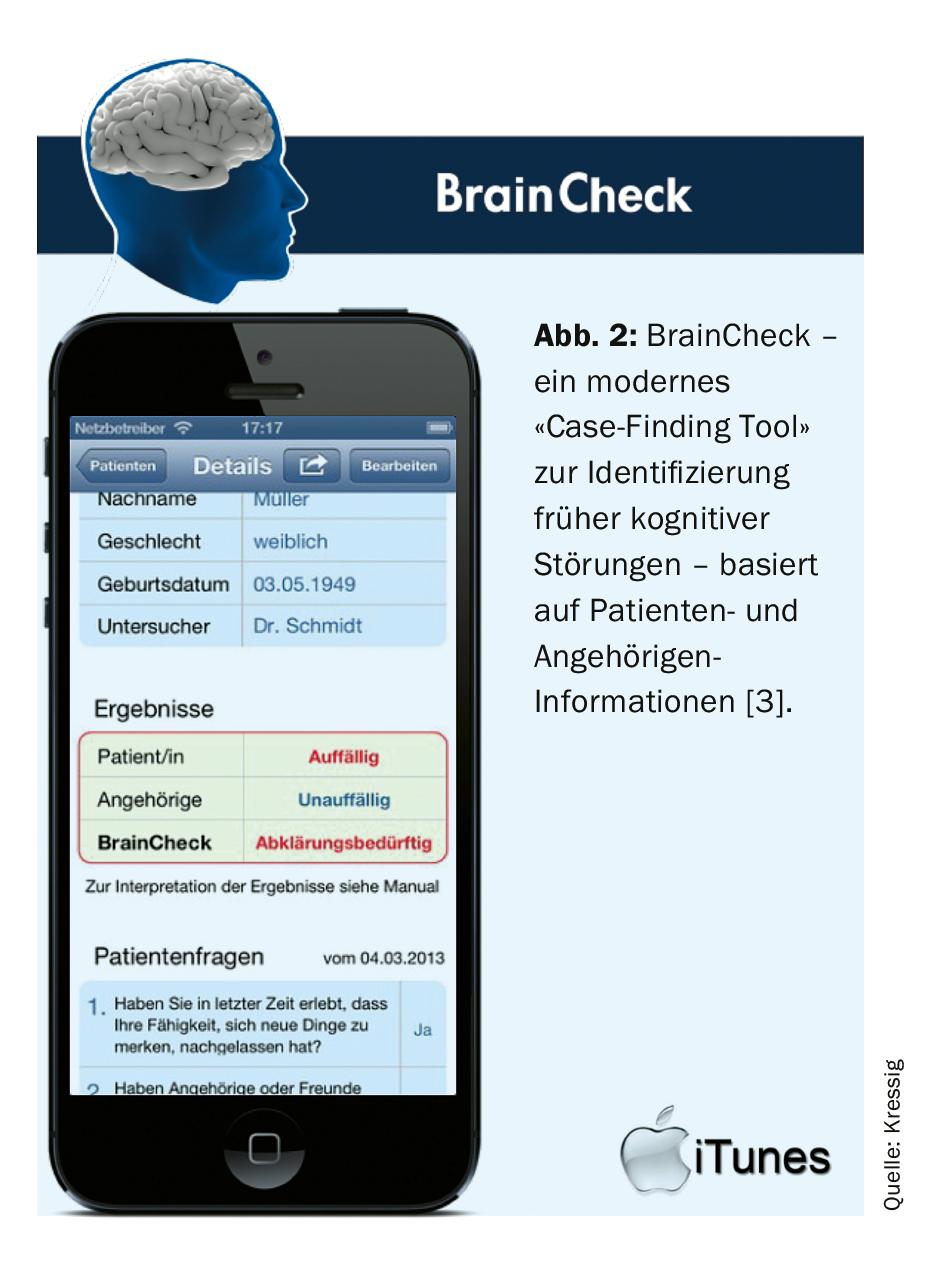
Dans la pratique quotidienne, il doit être possible de décider rapidement et en peu de temps si les troubles cognitifs doivent être examinés plus avant, s’il faut continuer à observer ou s’il n’y a pas lieu d’agir davantage ! L’ancien dépistage (long) des troubles cognitifs au moyen du MMSE et du test de l’horloge a été remplacé ces dernières années par un “case finding” plus sensible et ciblé au moyen d’une “application”. (Fig. 2). L’application payante “BrainCheck”, développée par les “Swiss Memory Clinics” et des médecins généralistes suisses, sépare en quelques minutes le “normal” du “pathologique” avec une efficacité de séparation de 90% [3] ! Pour cela, le patient doit répondre à trois questions simples et passer un test d’horloge. Parallèlement, 7 courtes questions sont posées à son proche parent/partenaire. Tous les résultats peuvent être immédiatement saisis et évalués dans l’application. L’examen sommaire peut être facilement intégré au dossier médical électronique sous la forme d’un fichier PDF.
Outre les anomalies purement cognitives, d’autres symptômes cliniques tels que la perte de poids, les changements de comportement ou l’humeur dépressive peuvent renforcer la suspicion précoce d’une évolution démentielle.
Si des investigations supplémentaires sont nécessaires, il convient de décider avec le patient et ses proches de la manière dont le diagnostic doit être poursuivi. La première étape consiste certainement à exclure (simplement) les causes qui peuvent être traitées rapidement, ce qui est un “must” absolu. Un trouble de la thyroïde peut être exclu par le dosage de la TSH, une dépression par l’échelle de dépression gériatrique (GDS) et une situation de stress psychosocial (charge de stress) peut être détectée par une anamnèse minutieuse et, dans le cas d’un résultat positif, être abordée par des contre-mesures appropriées. En cas de suspicion justifiée par l’anamnèse , un statut vitaminique B et une sérologie de la lèpre peuvent également être utiles. Si l’on trouve des résultats dans les domaines mentionnés et que l’on entreprend une thérapie, il est recommandé de contrôler la cognition environ 6 mois plus tard à l’aide du BrainCheck.
Troubles cognitifs nécessitant une évaluation
Le type d’évaluation complémentaire des troubles cognitifs est très individuel et dépend du consentement, de l’état de santé/de l’espérance de vie et des conditions de vie sociale du patient. Pour les seniors plus jeunes et en meilleure forme, il convient toujours de procéder à une évaluation spécialisée auprès d’un spécialiste de la démence ou d’une clinique de la mémoire. Celle-ci comprend, outre un examen médical avec laboratoire et biomarqueurs, un bilan neuropsychologique avec imagerie cérébrale (IRM). Chez les patients très âgés et fragiles, il est également possible de procéder à une évaluation cognitive abrégée (par exemple au moyen du MoCa-Assessment [4]). Avec un peu d’expérience, celle-ci peut être réalisée dans le cadre de la pratique de la médecine générale et faire l’objet d’une évaluation diagnostique. Cela implique également une imagerie cérébrale (IRM ou scanner) afin de déterminer la cause neuropathologique la plus probable de l’évolution démentielle. Cela détermine le type de traitement à mettre en place.
Les troubles cognitifs : Options thérapeutiques
S’il s’agit de troubles cognitifs “légers” selon le DSM-5, ils se situent à l’intérieur de deux variations standard d’un résultat cognitif normal. Sur le plan thérapeutique, des médicaments (Ginkgo Biloba 240 mg/d et de vitamine D 24 000 unités par mois), l’accent est mis sur des mesures non médicamenteuses : une activité physique et sociale (cognitive) régulière, une alimentation saine adaptée à l’âge (régulière et suffisamment riche en protéines – au moins 1,2 g/kg de poids corporel par jour ; régime méditerranéen avec suffisamment d’acides oméga-3) et un bon contrôle des facteurs de risque vasculaire par le médecin généraliste (art. hypertension, diabète, hypercholestérolémie). Dans l’étude finlandaise FINGER [5], ces mesures de mode de vie seules ont permis d’obtenir des améliorations cognitives significatives après 2 ans.
Options médicamenteuses : Avant d’utiliser de nouveaux médicaments, il faut toujours vérifier qu’il n’y a pas de substances anticholinergiques affectant les fonctions cognitives dans la polypharmacie existante. S’il s’agit de troubles cognitifs “majeurs” (démence) selon le DSM-5, la neuropathologie sous-jacente au processus est déterminante pour définir le traitement médicamenteux. Pour ce faire, il est généralement impératif de recourir à une imagerie appropriée, avec ou sans biomarqueurs. S’il s’agit d’un processus neurodégénératif (maladie d’Alzheimer), le ginkgo, les inhibiteurs de la cholinestérase et la mémantine sont des médicaments de premier choix en fonction du stade (figure 3).
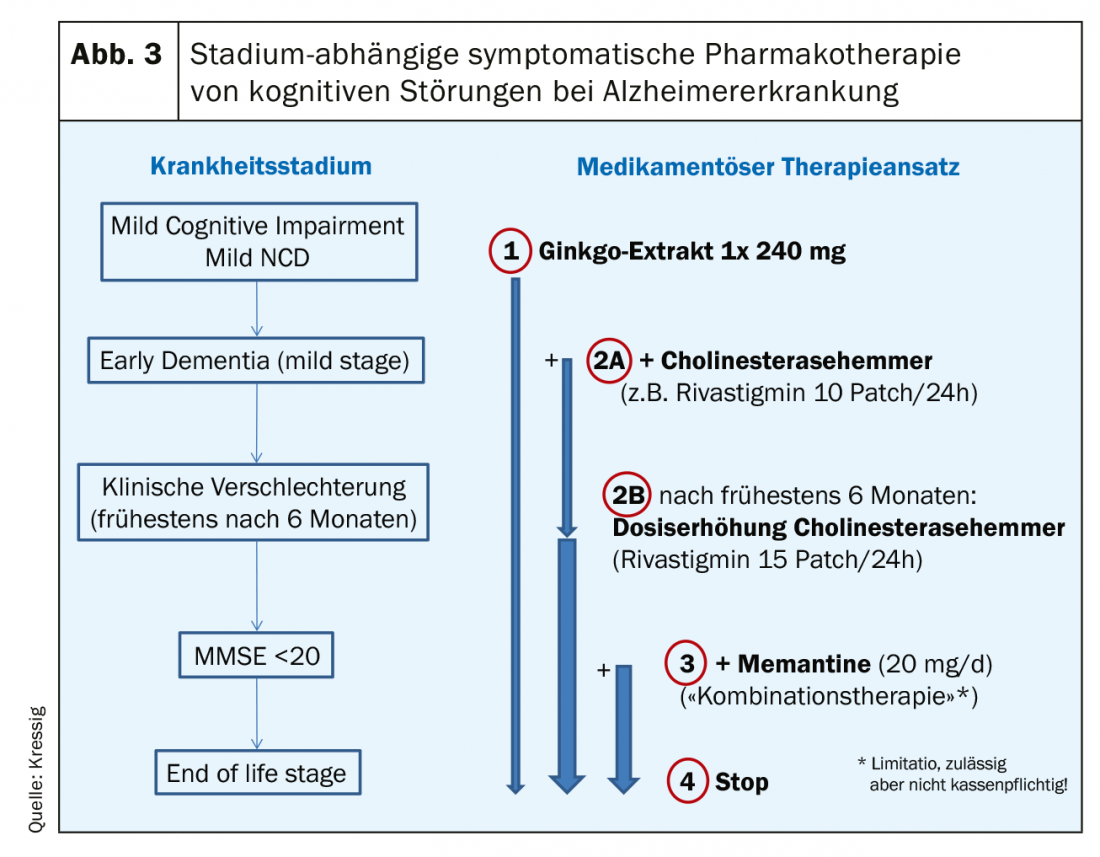
Après plus de 20 ans d’expérience avec ces options de traitement symptomatique, il est devenu clair que ce n’est pas l’amélioration des fonctions purement cognitives (par exemple la mémoire) qui fait ici la différence par rapport à l’absence de traitement médicamenteux. Ce traitement symptomatique améliore considérablement l’évolution de la maladie en termes de maintien de la fonctionnalité et de l’autonomie (s’il est commencé tôt). Ces médicaments ont une action extrêmement lente, mais sont dotés d’un taux de réponse élevé grâce à un “nombre de patients nécessaires au traitement” (NNT) inférieur à 10 (pour les trois classes de substances !). Par rapport aux populations de contrôle non traitées, les premières différences cliniquement perceptibles n’apparaissent toutefois qu’après un an de traitement ; celles-ci deviennent toutefois très pertinentes au cours des années suivantes, car le traitement entraîne une diminution impressionnante des admissions en maison de retraite (fig. 4) [6]. Le traitement combiné de la mémantine et de l’inhibiteur de la cholinestérase (pour le MMSE <20) s’est avéré très efficace. En Suisse, celle-ci n’est toutefois possible qu’en off-label et n’est pas entièrement prise en charge par l’assurance de base en raison d’une limitation. Néanmoins, de nombreux patients sont prêts à payer eux-mêmes les quelques centaines de francs par an (compte tenu de la forte baisse des prix des antidépresseurs) si cela leur permet d’économiser les coûts financiers beaucoup plus élevés d’une institutionnalisation. Outre le fait que les antidépresseurs permettent de conserver plus longtemps les fonctions quotidiennes, ce traitement réduit de manière significative les troubles du comportement associés à la démence (agressivité, cris, agitation motrice, etc.).
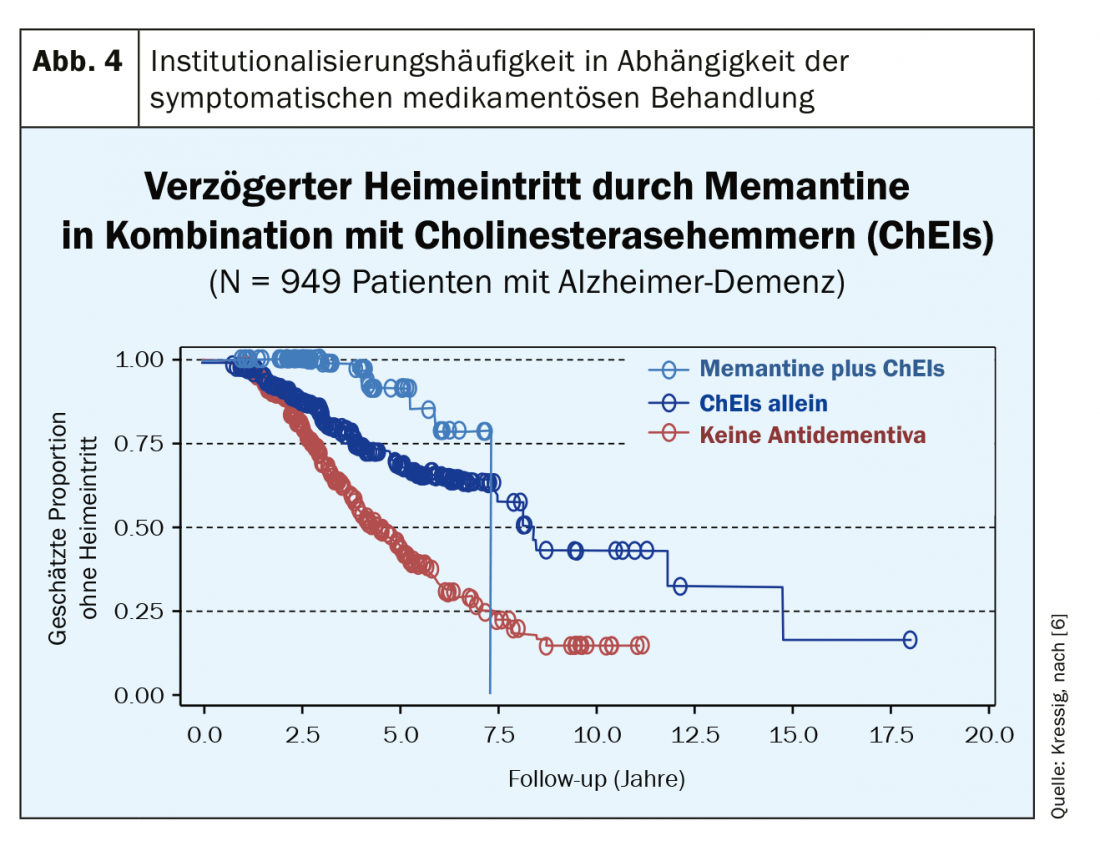
Si la pathologie sous-jacente à l’évolution démentielle est purement vasculaire, les antidépresseurs ci-dessus (sauf le ginkgo) ne sont pas efficaces et ne sont donc pas indiqués. Il s’agit ici de ralentir la progression de la maladie par tous les moyens, par des mesures de style de vie et par la maîtrise des facteurs de risque vasculaire. Dans les formes mixtes de démence vasculaire et neurodégénérative, des antidépresseurs peuvent être utilisés. Pour les pathologies démentielles plus rares, telles que la maladie de Lewis-Body, la maladie de Parkinson ou la démence fronto-temporale, il vaut la peine de consulter les spécialistes correspondants.
Options non médicamenteuses : Les interventions non médicamenteuses chez les personnes atteintes de démence sont recommandées par les grandes sociétés savantes et les groupes d’experts – sauf dans les situations d’urgence – en premier lieu et comme approche primaire pour les troubles psycho-socio-comportementaux associés à la démence (TCSP) [7]. Selon Cohen-Mansfield [8], la plupart des médecins sont formés pour prescrire des médicaments dans le cadre de l’ESPT, mais peu d’entre eux connaissent les mesures thérapeutiques non médicamenteuses et leur efficacité. En conséquence, les médicaments antipsychotiques sont souvent utilisés avant que des interventions non médicamenteuses ne soient tentées.
Contrairement aux capacités cognitives qui sont réduites ou perdues très tôt dans la démence, les compétences émotionnelles et psychosociales sont souvent beaucoup moins affectées par le déclin jusqu’aux stades tardifs de la démence. C’est là que les interventions non médicamenteuses interviennent, en s’éloignant de la focalisation sur les déficits pour accéder aux ressources cérébrales existantes, les utiliser de manière ciblée et les stimuler. L’activité physique, les activités basées sur la musique et une alimentation riche en protéines et complétée par de la vitamine D pour maintenir la santé musculaire dans la démence se sont avérées les plus efficaces [9]. L’effet sur le cerveau des activités physiques combinées à la musique, comme la danse et la rythmique, est passionnant et fait régulièrement l’objet de recherches. Dans l’étude de cohorte “Einstein-Aging”, la pratique régulière de la danse comme activité de loisir a été associée à une réduction de 80% du risque de démence ultérieure [10]. Une étude d’intervention utilisant la rythmique de Dalcroze a permis d’améliorer les capacités motrices et cognitives à double tâche des seniors vivant à domicile et de réduire le risque de chute de plus de 50% [11]. Dans les stades avancés de la démence, le rythme de Dalcroze, en plus d’influencer positivement les symptômes de SCPD, semble surtout favoriser les capacités linguistiques [12].
Les interventions non pharmacologiques auprès des personnes atteintes de démence sont un élément essentiel de la gestion moderne des quatre piliers de la démence. Le principal effet attendu de telles mesures est d’influencer positivement et sans effets secondaires les SCPD. Les programmes d’activité physique présentent des avantages supplémentaires pour la fonctionnalité quotidienne, qui peut être maintenue beaucoup plus longtemps, en particulier si une alimentation riche en protéines et une supplémentation en vitamine D sont associées. Les besoins quotidiens en protéines d’au moins 1,2 g de protéines par kg de poids corporel pour maintenir la santé musculaire des personnes atteintes de démence ne peuvent souvent être atteints qu’en utilisant des suppléments de protéines à boire. Ils sont pris en charge par l’assurance de base sur la base d’une garantie de paiement (http://geskes.ch, “Home Care”) et peuvent être livrés à domicile. La musique et les programmes d’activité physique basés sur la musique, comme la danse et la rythmique, semblent particulièrement adaptés pour mobiliser les réserves cérébrales et améliorer ainsi la cognition de manière significative.
Conclusion pour la pratique
Le traitement symptomatique non médicamenteux et médicamenteux des troubles cognitifs n’est qu’un élément de la gestion multifactorielle des quatre piliers de la démence. Les approches non médicamenteuses ont des effets cognitifs marginaux voire indétectables, mais sont efficaces pour les troubles du comportement, les symptômes psychiatriques et la charge de l’aidant. En ce qui concerne le traitement pharmacologique, il s’agit de réduire autant que possible la polymédication existante et d’arrêter les substances potentiellement nocives (liste de Priscus). A l’heure actuelle, il n’existe aucune raison rationnelle de ne pas utiliser les antidémentiels à action symptomatique actuellement disponibles (inhibiteurs de la cholinestérase, mémantine et extrait de ginkgo). Si les effets cliniques immédiats au début du traitement sont relativement faibles, ce sont surtout les avantages à long terme (institutionnalisation retardée de plusieurs années, réduction significative des troubles du comportement) qui sont mis en avant.
Messages Take-Home
- La pharmacopée n’est qu’un élément de la gestion intégrale et multifactorielle de la démence.
- Outre le diagnostic précoce, l’accompagnement du patient et de sa famille/des personnes qui s’en occupent par le médecin généraliste est essentiel pour que la maladie évolue le mieux possible.
- En ce qui concerne le traitement pharmacologique, il s’agit en premier lieu de réduire la polymédication existante et d’arrêter les substances (anticholinergiques) potentiellement nocives (liste de Priscus).
- À l’heure actuelle, il n’existe aucune raison rationnelle de ne pas utiliser les antidémentiels à action symptomatique disponibles depuis des années (inhibiteurs de la cholinestérase, mémantine et extrait de ginkgo standardisé).
- Au niveau international, l’association d’un inhibiteur de la cholinestérase et de la mémantine dans la gamme MMSE autorisée ainsi qu’un traitement concomitant au ginkgo biloba constituent aujourd’hui l’état de l’art du traitement de la démence d’Alzheimer.
- Le traitement combiné (inhibiteur de la cholinestérase + mémantine), qui ne peut être prescrit que hors indication en Suisse, a permis de retarder l’institutionnalisation de plusieurs années et de réduire significativement les troubles du comportement dans des études à long terme.
Littérature :
- Kressig RW : Démence de type Alzheimer : traitement non médicamenteux et médicamenteux. Ther Umsch 2015 ; 72(4) : 233-238.
- Wolfsgruber S, et al : Risque différentiel de démence par incident de la maladie d’Alzheimer dans les schémas stables ou instables de déclin cognitif subjectif. J Alzheimers Dis 2016 ; 54 : 1135-1146.
- Ehrensperger M, et al : BrainCheck – a very brief tool to detect incipient cognitive decline : optimized case-finding combining patient- and informant-based data. Alz Res Ther 2014 ; 6 : 69.
- Nasreddine, et al : The Montreal Cognitive Assessment, MoCA : a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005 ; 53 : 695-699.
- Kivipelto M, et al : The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER) : study design and progress. Alzheimer & démence 2013 ; 9 : 657-665.
- Lopez OL, et al : Effets à long terme de l’utilisation concomitante de la mémantine avec l’inhibition de la cholinestérase dans la maladie d’Alzheimer. J Neurol Neurosurg Psychiatry 2009 ; 80 : 600-607.
- Savaskan E, et al. : Recommandations pour le diagnostic et le traitement des symptômes comportementaux et psychologiques dans la démence (BPSD). Praxis (Berne 1994) 2014 ; 103(3) : 135-148.
- Cohen-Mansfield J : Nonpharmacologic interventions for inappropriate behaviors in dementia : a review, summary, and critique. Am J Geriatr Psychiatry 2001 ; 9 : 361-381.
- Kressig RW : Options de traitement non médicamenteux de la démence. Pratique de la médecine interne 2017 ; 58 : 1-7.
- Verghese J, et al : Leisure activities and the risk of dementia in the elderly. N Engl J Med 2003 ; 348 : 2508-2516.
- Trombetti A, et al : Effect of music-based multitask training on gait, balance, and fall risk in elderly people : a randomized controlled trial. Arch Intern Med 2011 ; 171(6) : 525-533.
- Winkelmann A, et al. : La rythmique Jaques-Dalcroze : Une activité physique novatrice pour les personnes âgées. GÉRIATRIE PRATIQUE 2005 ; 3 : 1-5.
PRATIQUE DU MÉDECIN DE FAMILLE 2020 : 15(5) : 16-19