Lors de la semaine européenne unie de gastroentérologie (UEGW), qui s’est tenue du 14 au 17 octobre 2023, les données de l’étude SEQUENCE actuelle ont été présentées et publiées entre-temps. [1,2]. In der randomisierten Phase-III-Head-to-Head-Studie wurde Risankizumab (SKYRIZI®) mit Ustekinumab zur Behandlung erwachsener Patient:innen mit mittelschwerem bis schwerem aktivem Morbus Crohn (CD, Crohn’s Disease) verglichen, bei denen eine oder mehrere Anti-TNF-Therapien versagt hatten [1]. Le risankizumab a satisfait à tous les critères d’évaluation primaires et secondaires et a démontré sa supériorité par rapport à l’ustékinumab [1]. SEQUENCE est donc la seule étude en tête-à-tête dans la maladie de Crohn qui démontre la supériorité d’un médicament biologique par rapport à un autre médicament biologique.
La maladie de Crohn est très invalidante pour les personnes concernées : l’inflammation sous-jacente peut provoquer des lésions intestinales durables et réduire considérablement la qualité de vie des personnes concernées [3, 4]. Pour le traitement de la maladie de Crohn, il existe en Suisse deux inhibiteurs autorisés de l’interleukine (IL)-23 et de l’IL-12/-23, le risankizumab et l’ustékinumab [5, 6]. Le risankizumab est autorisé en Suisse depuis le 14.09.2023 pour le traitement des patients adultes atteints de la maladie de Crohn active modérée à sévère qui ont répondu de manière insuffisante à un traitement conventionnel ou à un médicament biologique, qui n’y répondent plus ou qui ne les ont pas tolérés [5]. Le risankizumab permet d’obtenir une rémission clinique et endoscopique significative et peut donc contribuer à la guérison de la mucite. Il s’agit donc d’une étape importante dans le paysage thérapeutique de la maladie de Crohn [7, 8].
L’étude SEQUENCE en détail [1]
Plus de 500 patients ayant échoué à un ou plusieurs inhibiteurs du TNF ont été randomisés et traités pendant 48 semaines soit par risankizumab (N=255, 3x 600 mg i.v. aux semaines 0, 4 et 8 ; 5x 360 mg s.c. aux semaines 12, 20, 28, 36 et 44) soit par ustekinumab (N=265, 1x 260/390/520 mg i.v. à la semaine 0 ; 5x 90 mg s.c. aux semaines 8, 16, 24, 32 et 40) en open-label [1]. Le premier critère d’évaluation primaire était la rémission clinique selon l’indice d’activité de la maladie de Crohn (CDAI), défini comme CDAI < 150 après 24 semaines, testé pour la non-infériorité. Le deuxième critère d’évaluation primaire était la rémission endoscopique selon le Simple Endoscopic Score for Crohn’s Disease (SES-CD), défini comme SES-CD ≤ 4 et au moins 2 points de moins que la valeur initiale après 48 semaines, testé ici pour la supériorité. Les résultats endoscopiques ont été évalués en “lecture centrale” en aveugle. La situation démographique initiale était équilibrée dans les deux bras de traitement [1].
Le risankizumab a atteint les deux critères d’évaluation primaires [1].
Au point de lecture à 48 semaines, 90,2 % des patients sous risankizumab participaient encore à l’étude, contre 72,8 % des patients sous ustekinumab. L’une des principales raisons de l’arrêt prématuré dans le bras ustékinumab était le manque d’efficacité chez 13,2 % des patients, alors que seulement 2,0 % des patients risankizumab ont quitté l’étude pour cette raison [1]. Les deux critères d’évaluation primaires de l’étude ont été atteints (Fig. 1). Après 24 semaines, 58,6 % des patients du groupe risankizumab ont obtenu une rémission clinique, contre 39,5 % des patients ustekinumab, démontrant ainsi la non-infériorité du risankizumab par rapport à l’ustekinumab avec une marge de non-infériorité de 10 % [1]. De plus, le risankizumab a montré une supériorité sur l’ustékinumab dès 24 semaines (p < 0,01, analyse post-hoc pour la supériorité) [2]. Pour le deuxième critère d’évaluation coprimaire, la rémission endoscopique, une supériorité du risankizumab sur l’ustékinumab a été observée à 48 semaines. Presque deux fois plus de patients sous risankizumab ont obtenu une rémission endoscopique par rapport à l’ustékinumab (31,8 % contre 16,2 %, p < 0,0001) [1].
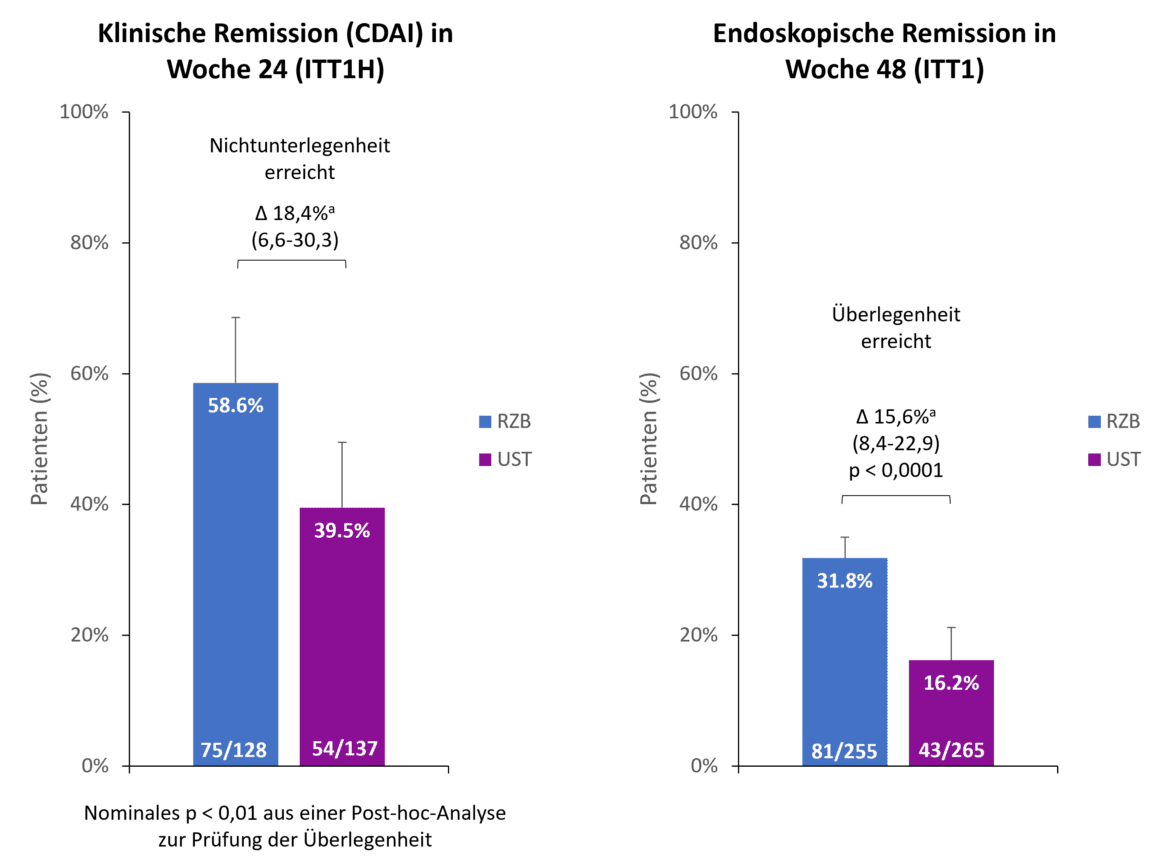
Fig. 1. Critères d’évaluation primaires : Risankizumab (RZB) a démontré une non-infériorité par rapport à l’ustékinumab (UST) pour l’obtention d’une rémission clinique à la semaine 24 et une supériorité par rapport à l’UST pour l’obtention d’une rémission endoscopique à la semaine 48. a Les différences sont ajustées en fonction des facteurs de stratification (nombre de traitements anti-TNF antérieurs sans succès [≤ 1, > 1] et utilisation de stéroïdes au début de l’étude [oui, non]). ITT1H : patients randomisés et traités depuis au moins 24 semaines au moment de l’analyse (analyse intérimaire à la semaine 24) ; ITT1 : patients randomisés qui ont reçu au moins 1 dose de RZB ou d’UST. UST ; CDAI : Crohn’s Disease Activity Index ; RZB : Risankizumab ; UST : Ustekinumab. Adapté de [1, 2].
Le risankizumab a montré une supériorité par rapport à l’ustékinumab sur tous les critères d’évaluation secondaires [1].
Le risankizumab a également montré une supériorité par rapport à l’ustékinumab pour les critères d’évaluation secondaires de l’étude SEQUENCE, à savoir la rémission clinique à 48 semaines, la réponse endoscopique à 24 et 48 semaines et la rémission endoscopique et clinique sans stéroïdes à 48 semaines (figure 2). Par exemple, 60,8 % des patients sous risankizumab étaient en rémission clinique à 48 semaines, contre 40,8 % des patients sous ustékinumab (p<0,0001). La différence de réponse endoscopique entre le risankizumab et l’ustékinumab était encore plus marquée à 48 semaines qu’à 24 semaines (45,1 % contre 21,9 %, p<0,0001) [1].
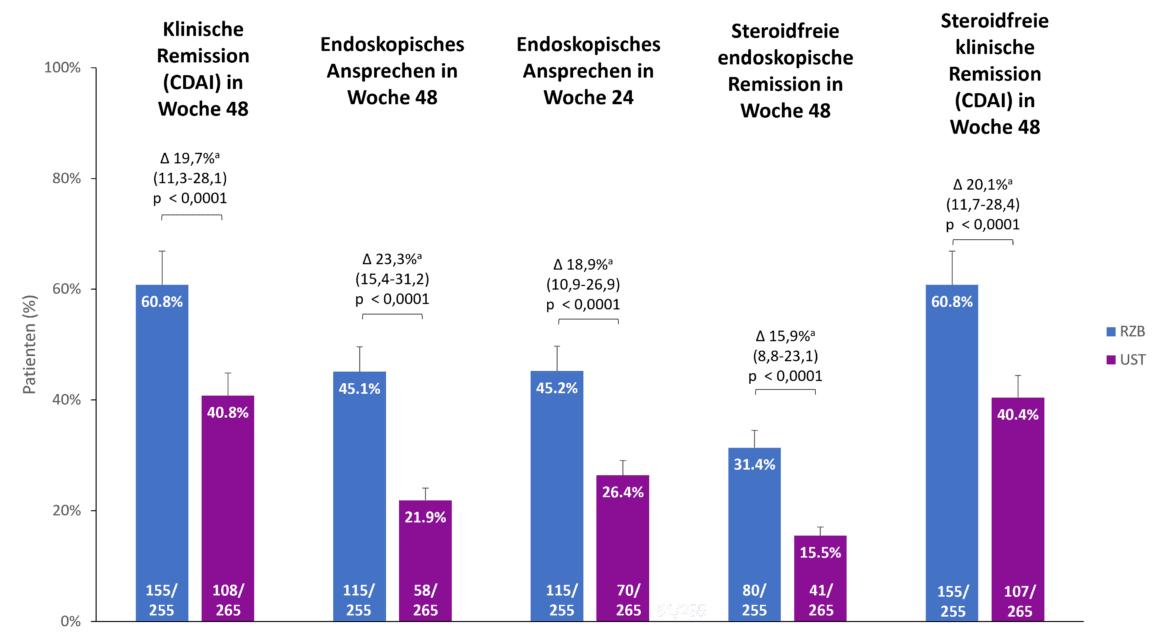
Fig. 2. Le risankizumab (RZB) a montré une supériorité par rapport à l’ustékinumab (UST) pour tous les critères d’évaluation secondaires. a Les différences sont ajustées en fonction des facteurs de stratification (nombre de traitements anti-TNF antérieurs sans succès [≤ 1, > 1] et utilisation de stéroïdes au début de l’étude [oui, non]). CDAI : Indice d’activité de la maladie de Crohn ; RZB : Risankizumab ; UST : Ustekinumab. Adapté de [1, 2].
Profil de sécurité du risankizumab
L’incidence globale des événements indésirables liés au traitement (TEAE) était faible pour le risankizumab et l’ustékinumab (27,9% contre 21,9%). 16,0% des patients du bras risankizumab ont présenté des effets indésirables graves, contre 19,2% dans le bras ustékinumab. Dans les deux bras de traitement, peu de TEAE ont entraîné l’arrêt du médicament à l’étude (3,8% pour le risankizumab contre 4,9% pour l’ustékinumab) [1]. Aucun nouveau signal de sécurité n’a été identifié sous risankizumab par rapport aux études pivots [1, 7, 8].
Conclusion
Les données actuelles de l’étude SEQUENCE confirment que le risankizumab, un médicament biologique récemment approuvé, est une option de traitement efficace pour les patients atteints de la maladie de Crohn. Comparé à l’ustekinumab chez des patients réfractaires aux anti-TNF, le risankizumab s’est révélé supérieur et tous les critères d’évaluation primaires et secondaires ont été atteints [1]. Les patients atteints de la maladie de Crohn peuvent espérer une diminution de l’activité de la maladie et se réjouir d’un nouveau traitement prometteur.
Information technique succincte SKYRIZI®.
Références
- Peyrin-Biroulet, L., et al. Risankizumab versus Ustekinumab for Moderate-to-Severe Crohn’s Disease. N Engl J Med, 2024. 391(3) : p. 213-223.
- Peyrin-Biroulet, L., et al. Risankizumab Versus Ustekinumab pour les patients atteints de la maladie de Crohn modérée à sévère : Résultats de la phase 3b de l’étude SEQUENCE. UEGW ; Copenhague, Oct 14-16, 2023.
- Jairath, V. et B.G. Feagan, Poids global de la maladie inflammatoire du côlon. Lancet Gastroenterol Hepatol, 2020. 5(1) : p. 2-3.
- The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990-2017 : a systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol, 2020. 5(1) : p. 17-30.
- Information professionnelle actuelle de SKYRIZI® (risankizumab) Maladie de Crohn sur www.swissmedicinfo.ch.
- Information professionnelle actuelle de l’ustékinumab sur www.swissmedicinfo.ch.
- D’Haens, G., et al, Risankizumab as induction therapy for Crohn’s disease : results from the phase 3 ADVANCE and MOTIVATE induction trials. Lancet, 2022. 399(10340) : p. 2015-2030.
- Ferrante, M., et al., Risankizumab as maintenance therapy for moderately to severely active Crohn’s disease : results from the multicentre, randomised, double-blind, placebo-controlled, withdrawal phase 3 FORTIFY maintenance trial.Lancet, 2022. 399(10340) : p. 2031-2046.
Les références peuvent être demandées par les professionnels à medinfo.ch@abbvie.com.
Rapport : Dr. sc. nat. Stefanie Jovanovic
Cet article a bénéficié du soutien financier d’AbbVie SA, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240059 09/2024
Cet article a été publié en allemand.











