Los datos del actual estudio SEQUENCE se presentaron en la Semana Europea Unida de Gastroenterología (UEGW), que tuvo lugar del 14 al 17 de octubre de 2023, y desde entonces se han publicado [1,2]. In der randomisierten Phase-III-Head-to-Head-Studie wurde Risankizumab (SKYRIZI®) mit Ustekinumab zur Behandlung erwachsener Patient:innen mit mittelschwerem bis schwerem aktivem Morbus Crohn (CD, Crohn’s Disease) verglichen, bei denen eine oder mehrere Anti-TNF-Therapien versagt hatten [1]. Risankizumab alcanzó todos los criterios de valoración primarios y secundarios en comparación con ustekinumab y demostró superioridad [1]. SEQUENCE es, por tanto, el único estudio cara a cara en la enfermedad de Crohn que demuestra la superioridad de un biológico sobre otro biológico.
La enfermedad de Crohn es extremadamente estresante para los afectados: la inflamación subyacente puede causar daños intestinales permanentes y restringir significativamente la calidad de vida de los afectados [3, 4]. En Suiza se dispone de dos inhibidores aprobados de la interleucina (IL)-23 y la IL-12/-23, el risankizumab y el ustekinumab, respectivamente, para el tratamiento de la enfermedad de Crohn [5, 6]. El risankizumab está aprobado en Suiza desde el 14.09.2023 para el tratamiento de pacientes adultos con enfermedad de Crohn activa de moderada a grave que hayan respondido de forma inadecuada a la terapia convencional o a un biológico, hayan dejado de responder o no lo hayan tolerado [5]. Dado que el risankizumab conduce a una remisión clínica y endoscópica significativa y, por tanto, puede contribuir a la curación de la mucosa, constituye un hito importante en el panorama terapéutico de la enfermedad de Crohn [7, 8].
El estudio SEQUENCE en detalle [1]
Más de 500 pacientes que no habían respondido a uno o más inhibidores del TNF fueron asignados aleatoriamente a 48 semanas de tratamiento abierto con risankizumab (N=255, 3x 600 mg i.v. en las semanas 0, 4 y 8; 5x 360 mg s.c. en las semanas 12, 20, 28, 36 y 44) o ustekinumab (N=265, 1x 260/390/520 mg i.v. en la semana 0; 5x 90 mg s.c. en las semanas 8, 16, 24, 32 y 40) [1]. El primer criterio de valoración primario fue la remisión clínica según el índice de actividad de la enfermedad de Crohn < (CDAI), definido como CDAI 150 después de 24 semanas, se comprobó la no inferioridad. El segundo criterio de valoración primario fue la remisión endoscópica según la puntuación endoscópica simple para la enfermedad de Crohn (SES-CD), definida como SES-CD ≤ 4 y al menos 2 puntos inferior al valor basal después de 48 semanas, sometida a una prueba de superioridad. Los resultados endoscópicos se analizaron en una lectura central ciega. Los datos demográficos basales estaban equilibrados en ambos brazos de tratamiento [1].
Risankizumab cumplió los dos criterios de valoración primarios [1].
Hasta el punto de lectura de 48 semanas, el 90,2% de los pacientes con risankizumab seguían participando en el estudio, en comparación con el 72,8% de los pacientes con ustekinumab. Uno de los principales motivos de interrupción precoz en el brazo de ustekinumab fue la falta de eficacia en el 13,2% de los pacientes, mientras que sólo el 2,0% de los pacientes de risankizumab abandonaron el estudio por este motivo [1]. Se cumplieron los dos criterios de valoración primarios del estudio (Fig. 1). Después de 24 semanas, el 58,6 % de los pacientes del grupo de risankizumab alcanzaron la remisión clínica en comparación con el 39,5 % de los pacientes de ustekinumab, lo que demostró la no inferioridad de risankizumab frente a ustekinumab con un margen de no inferioridad del 10 % [1]. < Además, el risankizumab ya mostró un indicio de superioridad sobre el ustekinumab después de 24 semanas (p 0,01, análisis post-hoc de superioridad) [2]. En el segundo criterio de valoración coprimario, la remisión endoscópica, se observó que risankizumab era superior a ustekinumab después de 48 semanas. < Casi el doble de pacientes que recibieron risankizumab alcanzaron la remisión endoscópica en comparación con ustekinumab (31,8 % frente a 16,2 %, p 0,0001) [1].
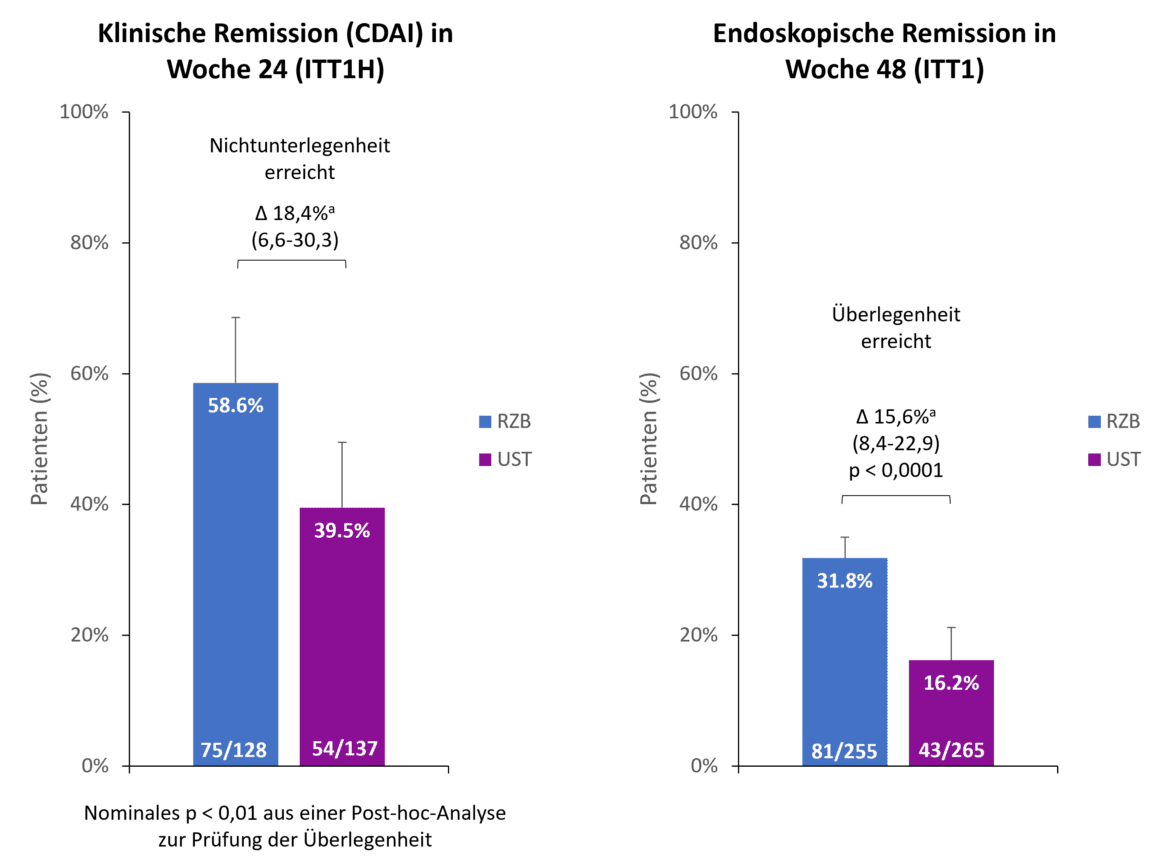
Fig. 1. Criterios de valoración primarios: > Risankizumab (RZB) demostró su no inferioridad frente a ustekinumab (UST) en la consecución de la remisión clínica en la semana 24 y su superioridad frente a UST en la consecución de la remisión endoscópica en la semana 48. a Las diferencias se ajustan en función de los factores de estratificación (número de terapias anti-TNF previas sin éxito [≤ 1, 1] y uso de esteroides al inicio [sí, no]). ITT1H: pacientes aleatorizados y tratados durante al menos 24 semanas en el momento del análisis (análisis intermedio en la semana 24); ITT1: pacientes aleatorizados que recibieron al menos 1 dosis de RZB resp. UST; CDAI: índice de actividad de la enfermedad de Crohn; RZB: risankizumab; UST: ustekinumab. Adaptado de [1, 2].
Risankizumab mostró superioridad sobre ustekinumab en todos los criterios de valoración secundarios [1].
Risankizumab también mostró superioridad en comparación con ustekinumab en los criterios de valoración secundarios del estudio SEQUENCE, la remisión clínica a las 48 semanas, la respuesta endoscópica a las 24 y 48 semanas y la remisión endoscópica y clínica sin esteroides a las 48 semanas (Fig. 2). <Por ejemplo, el 60,8 % de los pacientes con risankizumab estaban en remisión clínica a las 48 semanas, frente al 40,8 % de los pacientes con ustekinumab (p 0,0001). <La diferencia en la respuesta endoscópica entre risankizumab y ustekinumab fue aún más pronunciada a las 48 semanas que a las 24 semanas (45,1 % frente a 21,9 %, p 0,0001) [1].
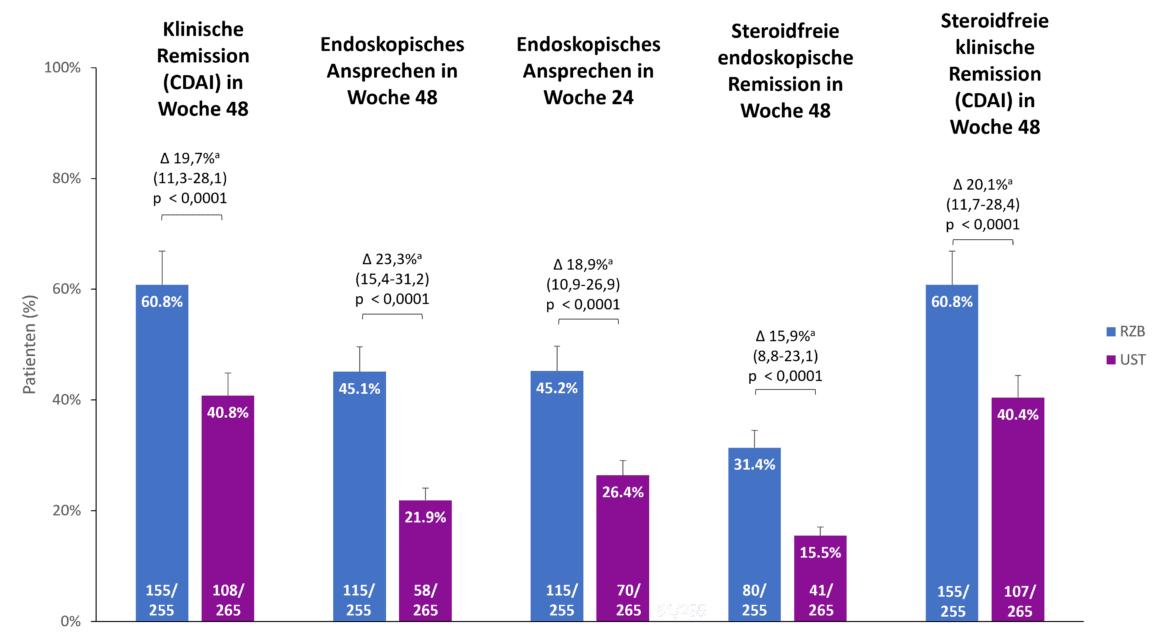
Fig. 2. > Risankizumab (RZB) mostró superioridad sobre ustekinumab (UST) en todos los criterios de valoración secundarios. a Las diferencias se ajustan utilizando los factores de estratificación (número de terapias anti-TNF previas sin éxito [≤ 1, 1] y uso de esteroides al inicio del estudio [sí, no]). CDAI: índice de actividad de la enfermedad de Crohn; RZB: risankizumab; UST: ustekinumab. Adaptado de [1, 2].
Perfil de seguridad del risankizumab
La incidencia global de acontecimientos adversos emergentes del tratamiento (AETT) fue baja para risankizumab y ustekinumab (27,9% frente a 21,9%). El 16,0% de los pacientes del brazo de risankizumab presentaron acontecimientos adversos graves, frente al 19,2% del brazo de ustekinumab. En ambos brazos de tratamiento, se produjeron pocos EAET que condujeran a la interrupción del fármaco del estudio (risankizumab 3,8% frente a ustekinumab 4,9%) [1]. En comparación con los estudios pivotales, no se identificaron nuevas señales de seguridad con risankizumab [1, 7, 8].
Conclusión
Los últimos datos del estudio SEQUENCE confirman que el fármaco biológico risankizumab, recientemente aprobado, es una opción terapéutica eficaz para los pacientes con enfermedad de Crohn. En una comparación directa con ustekinumab en pacientes refractarios al anti-TNF, risankizumab demostró ser superior y se cumplieron todos los criterios de valoración primarios y secundarios [1]. Así pues, la remisión clínica y endoscópica y la curación de la mucosa como objetivos terapéuticos están cada vez más cerca y los pacientes con enfermedad de Crohn pueden esperar una menor actividad de la enfermedad y contar con una nueva terapia prometedora.
Breve información técnica SKYRIZI
Literatura
- Peyrin-Biroulet, L., et al. Risankizumab frente a ustekinumab para la enfermedad de Crohn de moderada a grave. N Engl J Med, 2024. 391(3): p. 213-223.
- Peyrin-Biroulet, L., et al. Risankizumab frente a ustekinumab para pacientes con enfermedad de Crohn de moderada a grave: resultados del estudio de fase 3b SEQUENCE. UEGW; Copenhague, 14-16 de octubre de 2023.
- Jairath, V. y B.G. Feagan, Carga mundial de la enfermedad inflamatoria intestinal. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 2-3.
- La carga mundial, regional y nacional de la enfermedad inflamatoria intestinal en 195 países y territorios, 1990-2017: un análisis sistemático para el Estudio de la Carga Mundial de Enfermedad 2017. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 17-30.
- Resumen actual de las características del producto SKYRIZI® (risankizumab) para la enfermedad de Crohn en www.swissmedicinfo.ch.
- Resumen actual de las características del producto ustekinumab en www.swissmedicinfo.ch.
- D’Haens, G., et al, Risankizumab como terapia de inducción para la enfermedad de Crohn: resultados de los ensayos de inducción de fase 3 ADVANCE y MOTIVATE. Lancet, 2022. 399(10340): p. 2015-2030.
- Ferrante, M., et al, Risankizumab como terapia de mantenimiento para la enfermedad de Crohn de moderada a gravemente activa: resultados del ensayo de mantenimiento FORTIFY de fase 3, multicéntrico, aleatorizado, doble ciego, controlado con placebo y en fase de retirada.Lancet, 2022. 399(10340): p. 2031-2046.
Los especialistas pueden solicitar las referencias en medinfo.ch@abbvie.com.
Informe: Dr sc. nat. Stefanie Jovanovic
Este artículo ha sido elaborado con el apoyo financiero de AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240059 09/2024
Este artículo se ha publicado en alemán.