De nouvelles données de phase III des études DISCOVER-1 et DISCOVER-2 montrent une amélioration des symptômes articulaires et cutanés de l’arthrite psoriasique à la semaine 52. Une extension des indications du guselkumab est en cours d’examen. Il s’agirait d’une nouvelle avancée dans les possibilités de traitement de cette maladie auto-immune éprouvante.
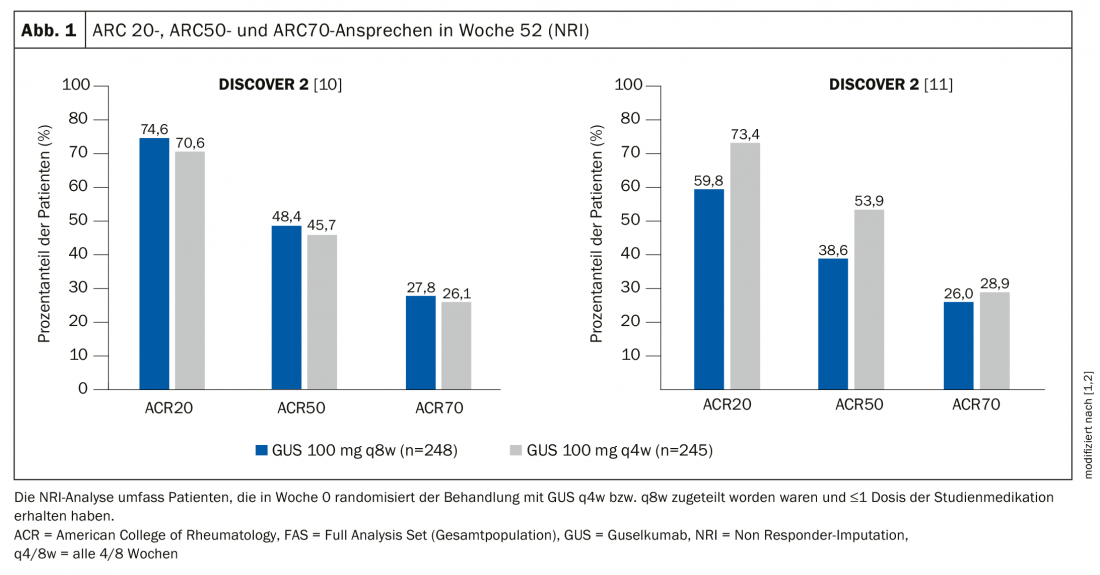
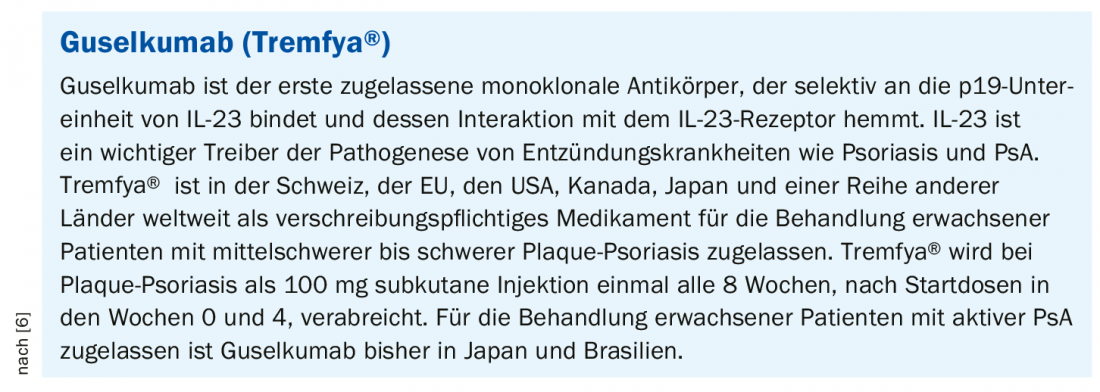
Les données des deux études du programme DISCOVER ont servi de base à la demande d’autorisation de mise sur le marché de Tremfya® pour le traitement de patients adultes atteints de PsA active. Environ 75% des patients traités par Tremfya® ont obtenu une réponse ACR-20 dans les études DISCOVER-1 et DISCOVER-2 [1,2]. Il s’agit des premiers résultats de phase III à 1 an évaluant l’inhibition spécifique de l’IL23p19 dans l’arthrite psoriasique active. Les données ont été présentées lors du E-Congrès 2020 de l’European League Against Rheumatism (EULAR) et publiées dans The Lancet [3–5]. Dans les deux études cliniques de phase III, le guselkumab (Tremfya®) a montré une amélioration de plusieurs critères cliniques chez des patients adultes atteints d’arthrite psoriasique active (PsA), notamment les symptômes articulaires et cutanés, l’inflammation des tissus mous, la capacité fonctionnelle physique et la réduction de la progression radiologique à la semaine 52 [1,2]. Tremfya® n’est actuellement pas autorisé pour le traitement de la PsA et est actuellement en cours d’évaluation par Swissmedic pour cette utilisation.
| Abréviations ACR = critère de réponse ACR MDA = Activité minimale de la maladie DAS-28 = score d’activité de la maladie 28 VLDA = Activité très faible de la maladie HAQ-DI = Indice d’invalidité du questionnaire d’évaluation de la santé SF-36 = Short Form 36 Health Survey Questionnaire (questionnaire court sur la santé) PCS = Résumé des composants physiques MCS = Résumé des Composantes Mentales |
DISCOVER-1 et DISCOVER-2 prouvent l’efficacité et la sécurité
Les patients inclus dans DISCOVER-1 étaient soit naïfs de tout traitement biologique, soit avaient reçu des traitements biologiques anti-TNF-α auparavant. Dans DISCOVER-2, seuls des patients naïfs de traitement biologique ont été inclus. DISCOVER-2 a également étudié la progression radiologique des lésions articulaires. Dans les deux études, les patients ont été randomisés sur une période d’un an en deux groupes de traitement par verum, Tremfya® 100 mg toutes les 4 semaines (q4w) ou toutes les 8 semaines (q8w), ainsi que des groupes placebo avec crossover à la semaine 24 vers Tremfya® q4w. Les résultats ont été présentés sous forme de poster lors du e-Congrès de l’EULAR de cette année [1,2]. Les études DISCOVER ont également montré des améliorations de plusieurs critères secondaires à la semaine 52 par rapport à la semaine 24, y compris la réponse ACR70, la résolution de l’inflammation des tissus mous (enthésites et dactylites) [7], le score d’activité de la maladie (DAS-28), la protéine C-réactive (CRP) [4], l’activité minimale de la maladie (MDA) [8], l’activité très faible de la maladie (VLDA) [9], l’amélioration du fonctionnement physique (HAQ-DI) [7], l’amélioration générale de l’état de santé (SF-36*, PCS**, MCS†).
Dans les deux études, Tremfya® a été bien toléré jusqu’à la fin de l’étude, et les événements indésirables observés étaient généralement cohérents avec les études antérieures sur Tremfya® et les informations de prescription actuelles [6]. Des effets indésirables graves et des infections graves sont survenus chez respectivement 4% et 1% des patients traités par Tremfya® dans DISCOVER-1 et DISCOVER-2. Aucun décès n’a été signalé chez les patients traités par Tremfya® et aucun patient traité par Tremfya n’a présenté de maladie inflammatoire de l’intestin, d’infection opportuniste, de tuberculose active ou de réaction anaphylactique ou de type maladie sérique [1,2].
Source : Janssen
*/** SF-36 est un questionnaire destiné aux patients qui mesure la santé fonctionnelle et le bien-être à partir des rapports des patients. Dans le cadre du SF-36, la sous-échelle PCS se compose de quatre échelles qui évaluent la fonction physique, les limitations causées par des problèmes physiques, les symptômes somatiques de la douleur et la santé générale.
† MCS se compose de quatre échelles qui évaluent la vitalité, l’impact émotionnel, le fonctionnement social et la santé mentale.
Littérature :
- Ritchlin C, et al. : Guselkumab, un inhibiteur de l’IL-23 qui se lie spécifiquement au sous-unité IL23p19, pour l’arthrite psoriasique active : Résultats à un an d’une étude de phase 3, randomisée, en double aveugle, contrôlée par placebo de patients qui étaient naïfs de traitement biologique ou expérimentés avec un inhibiteur du TNFα. SAT0397. Présenté au 2020 EULAR E-Congress June 3-6.
- McInnes I, et al. : Efficacité et sécurité du guselkumab, un anticorps monoclonal spécifique du sous-unité p19 de l’interleukine-23, au cours de la semaine 52 d’une étude de phase 3, randomisée, en double aveugle, contrôlée par placebo, menée chez des patients naïfs de traitement biologique atteints d’arthrite psoriasique active. SAT0402. Présenté au 2020 EULAR E-Congress June 3-6.
- Business Wire. Janssen annonce l’extension de l’utilisation de TREMFYA, www.businesswire.com/news/home/20191022006172/en/Janssen-Seeks-Expand-TREMFYAC2AEE296%BC-guselkumab-Treatment-Adults® (guselkumab) dans le traitement des adultes atteints de polyarthrite psoriasique active. dernière consultation 28.07.2020.
- Deodhar A, et al : Guselkumab chez les patients atteints d’arthrite psoriasique active qui étaient naïfs de traitement biologique ou qui avaient reçu précédemment un traitement par inhibiteur du TNFα (DISCOVER-1) : un essai de phase 3 en double aveugle, randomisé et contrôlé par placebo. The Lancet 2020 ; 395 : 1115-1125.
- Mease PJ, et al. : Guselkumab chez les patients naïfs de traitement biologique atteints d’arthrite psoriasique active (DISCOVER-2) : A Double-blind, Randomised, Placebo-controlled Phase 3 Trial. The Lancet 2020 ; 395 : 1126-1136.
- Information professionnelle TREMFYA®, version 09/2019 disponible sur www.swissmedicinfo.ch
- Clinicaltrials.gov : Une étude évaluant l’efficacité et la sécurité du guselkumab administré par voie sous-cutanée chez des participants souffrant d’arthrite psoriasique active, y compris ceux précédemment traités par des agents biologiques anti-facteur de nécrose tumorale (TNF) alpha (DISCOVER-1). Identifiant : NCT03162796. https://clinicaltrials.gov/ct2/show/NCT03162796, dernière consultation 28.07.2020.
- Gossec L, et al : L’activité minimale de la maladie comme cible de traitement dans l’arthrite psoriasique : une revue de la littérature. J Rheumatol 2018 ; 45 : 6-13.
- Coates L, et al : Abstract 2548. Présenté à la réunion annuelle 2017 de l’ACR/ARHP. Disponible sur : https://acrabstracts.org/abstract, dernière consultation 28.07.2020.
- McInnes, et al. : Présenté au E-Congrès de l’EULAR, juin 2020. Poster 0402.
- Ritchlin, et al. : Présenté au E-Congrès de l’EULAR, juin 2020, Poster 0397.
PRATIQUE DU MÉDECIN DE FAMILLE 2020, 15(8) : 36-37
DERMATOLOGIE PRATIQUE 2020 ; 30(4) : 28-29