Le traitement de la polyarthrite rhumatoïde (PR) a fait des progrès significatifs au cours des dernières années, mais il reste un défi pour de nombreux patients : jusqu’à 60% des patients ne répondent pas au traitement initial ou perdent leur réponse au traitement au fil du temps [2]. Les inhibiteurs du TNF (TNFi) sont encore souvent utilisés en première intention après les DMARD synthétiques (cs) conventionnels et, en cas de réponse insuffisante, les inhibiteurs du TNF sont utilisés en deuxième intention. à un deuxième TNFi, ce que l’on appelle le TNFi cycling [3]. Des données récentes suggèrent de reconsidérer cette pratique : au lieu d’un autre cycle de TNFi, le passage à des substances ayant un mécanisme d’action différent, comme les inhibiteurs de Janus kinase (JAKi), pourrait être bénéfique pour les patients [1].
Les recommandations actuelles de traitement par cible (T2T) pour la PR considèrent la rémission clinique comme l’objectif principal du traitement [4]. La rémission est d’une importance capitale pour les patients, car elle ralentit non seulement la progression des lésions articulaires, mais améliore aussi considérablement le bien-être psychologique et le fonctionnement physique des personnes concernées [5-7]. La rémission précoce, en particulier, est cruciale pour les effets à long terme de la maladie [8-10]. Les données des études et les résultats rapportés par les patients(PRO) montrent qu’une rémission précoce est associée à une rémission durable [8, 9]. Cependant, environ 30 à 40% des patients atteints de PR qui initient un traitement de première ligne par TNFi abandonnent le traitement en raison d’un échec primaire, d’une absence de réponse secondaire ou d’une intolérance [1]. Dans ces cas, il est particulièrement important de passer rapidement et conjointement à un traitement alternatif afin de préserver les chances de rémission durable et de ne pas perdre le contrôle de la maladie.
Cycling vs. Switching
L’American College of Rheumatology (ACR) recommande le passage à un bDMARD ou à un tsDMARD d’une autre classe de médicaments dans la PR après l’échec d’un premier traitement biologique ou spécifique de la cible (bDMARD ou tsDMARD), tandis que l’European Alliance of Associations for Rheumatology (EULAR) préconise le passage à un autre mécanisme d’action et le recyclage [4, 11]. Le cyclage du TNFi et le passage à un autre mécanisme d’action sont tous deux souvent utilisés en cas d’échec du traitement par TNFi [12]. Cependant, les données de l’étude montrent que les patients qui subissent plusieurs cycles de TNFi sont plus susceptibles d’échouer et de changer à nouveau de traitement [13]. Cependant, le passage à un autre mécanisme d’action serait associé à une augmentation des chances d’amélioration clinique et à une diminution du taux d’abandon [14,15].
Upadacitinib avantageux en cas de switching
Une étude multinationale analysant les données de registre de 503 patients atteints de PR après l’échec d’un traitement de première ligne par TNFi a examiné le succès de différents traitements de suivi [1]. Les patients ont été comparés au passage au JAKi upadacitinib (RINVOQ®, UPA, n=261), à un second TNFi (n=128) ou à un DMARD avec un autre mécanisme d’action (n=114) [1, 16]. Les patients qui sont passés d’un TNFi à l’UPA ont obtenu des résultats cliniques significativement meilleurs que ceux qui ont reçu un second TNFi. Par exemple, 67,7 % des patients sous UPA ont obtenu une rémission, contre 40,3 % de ceux qui ont reçu un second TNFi (p=0,002). L’absence de douleur était plus importante sous UPA (55,7 % contre 25,4 %, p=0,001) et l’adhérence était de 60 % contre 34,2 % chez les patients sous TNFi (p=0,005) (Fig. 1) [1]. L’UPA s’est également révélé supérieur à un DMARD ayant un mécanisme d’action différent sur ces trois points. De plus, les données à 5 ans de l’étude SELECT-COMPARE, récemment publiées, soulignent que le changement de mécanisme d’action semble être bénéfique pour les patients atteints de PR qui n’ont pas atteint leur objectif thérapeutique et que cet avantage peut être maintenu à long terme [17]. L’étude a montré des différences numériques, principalement en faveur des patients qui sont passés de l’ADA à l’UPA [17]. Cependant, non seulement dans la PR, mais aussi dans l’arthrite psoriasique (PsA) et la spondyloarthrite axiale (axSpA), les données de l’étude indiquent que les patients répondent moins bien à un deuxième ou troisième anti-TNF qu’au premier [12, 18, 19].
Upadacitinib également bénéfique en première ligne de traitement après un csDMARD
L’efficacité de l’UPA par rapport au TNFi en traitement de première ligne a été comparée dans les études tête-à-tête du programme SELECT-COMPARE [20, 21]. L’UPA + méthotrexate (MTX) a montré une efficacité significativement supérieure à celle de l’adalimumab (ADA) + MTX sur différents paramètres tels que le DAS28≤2,6, l’ACR50, la variation du HAQ-DI et le soulagement de la douleur dès 12 semaines [20, 21]. De même, une rémission durablement plus élevée a été démontrée sous UPA + MTX par rapport à ADA + MTX sur 5 ans [21]. Plusieurs études menées dans le monde réel ont également démontré la bonne efficacité et la longue durée de traitement de l’upadacitinib dans la pratique quotidienne [22, 23]. En outre, les données à 7,5 ans publiées lors de l’EULAR 2024 confirment le profil d’innocuité connu de l’UPA chez plus de 4 700 patients [24].
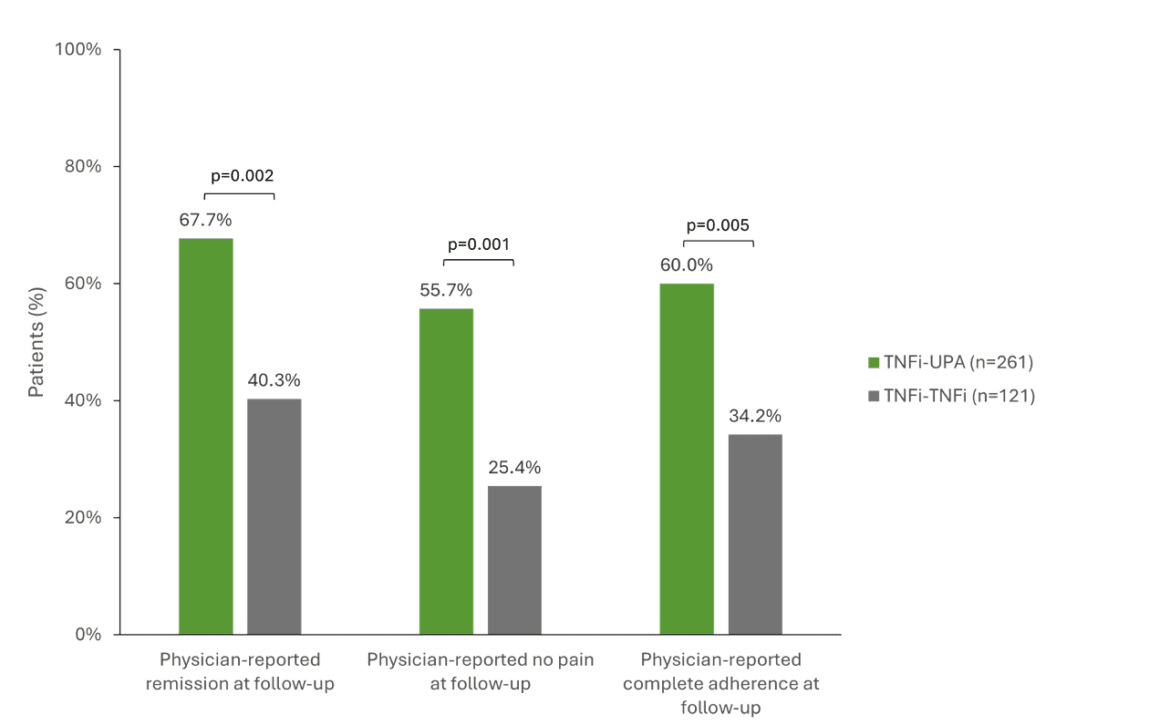
Fig. 1 : Résultats cliniques significativement meilleurs lors du passage à l’UPA (TNFi-UPA) par rapport à un deuxième TNFi (TNFi-TNFi). TNFi = inhibiteur du TNF, UPA = upadacitinib. Adapté de [1].
Conclusion
Les données disponibles indiquent que le passage du TNFi à l’UPA peut être une option thérapeutique avantageuse pour les patients atteints de PR qui n’ont pas suffisamment répondu à un premier traitement par TNFi ou qui ne l’ont pas toléré [1]. Comparé au recyclage du TNFi, le passage à l’UPA avec un mécanisme d’action alternatif offre de meilleures chances de rémission, d’absence de douleur et d’observance du traitement [1]. Ces résultats étayent la recommandation de passer rapidement à un mécanisme d’action alternatif afin d’améliorer les résultats thérapeutiques à long terme pour les patients atteints de PR et d’augmenter les chances de rémission durable.
Abréviations : ACR = American College of Rheumatology ; ACR50 = ACR response avec ≥50% d’amélioration ; ADA = adalimumab ; axSpA = spondyloarthrite axiale ; csDMARD = DMARD synthétique conventionnel ; DAS28 = Disease Activity Score 28; DMARD = Disease-modifying antirheumatic drugs; EULAR = European Alliance of Associations for Rheumatology; HAQ-DI = Health Assessment Questionnaire Disability Index; JAK = Janus kinase ; JAKi = inhibiteur de JAK ; MTX = méthotrexate ; PRO = Patient-reported outcome; PsA = polyarthrite psoriasique ; RA = polyarthrite rhumatoïde ; T2T = Treat-to-Target; TNF = facteur de nécrose tumorale ; TNFi = inhibiteur de TNF ; UPA = upadacitinib.
Information technique succincte RINVOQ

Cet article a été rédigé avec le soutien financier de AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Cet article a été publié en allemand.
Texte : Dr. sc. nat. Stefanie Jovanovic
CH-RNQ-240019 11/2024
Références
1 Caporali, R., et al, A Real-World Comparison of Clinical Effectiveness in Patients with Rheumatoid Arthritis Treated with Upadacitinib, Tumor Necrosis Factor Inhibitors, and Other Advanced Therapies After Switching from an Initial Tumor Necrosis Factor Inhibitor. Adv Ther, 2024. 41(9) : p. 3706-3721.
2 Vallejo-Yague, E., et al, Efficacité comparée des médicaments biologiques chez les patients atteints d’arthrite rhumatoïde stratifiée par indice de masse corporelle : une étude de cohorte dans un registre suisse. BMJ Open, 2024. 14(2) : p. e074864.
3. Edgerton, C., et al, Real-World Treatment and Care Patterns in Patients With Rheumatoid Arthritis Initiating First-Line Tumor Necrosis Factor Inhibitor Therapy in the United States. ACR Open Rheumatol, 2024. 6(4) : p. 179-188.
4 Smolen, J.S., et al, Recommandations EULAR pour la prise en charge de l’arthrite rhumatoïde avec des médicaments antirhumatismaux de synthèse et biologiques modifiant la maladie : mise à jour 2022. Ann Rheum Dis, 2023. 82(1) : p. 3-18.
5 Lillegraven, S., et al, Rémission et résultats radiographiques dans la polyarthrite rhumatoïde : application des critères de rémission ACR/EULAR 2011 dans une cohorte d’observation. Ann Rheum Dis, 2012. 71(5) : p. 681-6.
6. McInnes, I.B. et G. Schett, The pathogenesis of rheumatoid arthritis. N Engl J Med, 2011. 365(23) : p. 2205-19.
7 Einarsson, J.T., et al, La rémission prolongée améliore la fonction physique chez les patients atteints de polyarthrite rhumatoïde établie, et devrait être un objectif de traitement : une étude prospective de cohorte observationnelle du sud de la Suède. J Rheumatol, 2016. 43(6) : p. 1017-23.
8. Ten Klooster, P.M., et al, Résultats cliniques, fonctionnels et financiers à long terme pour les patients atteints de polyarthrite rhumatoïde précoce qui n’ont pas obtenu ou n’ont pas obtenu de rémission précoce dans le cadre d’une stratégie de traitement à la cible en vie réelle. Clin Rheumatol, 2019. 38(10) : p. 2727-2736.
9. Xie, W., J. Li, et Z. Zhang, The impact of different criteria sets on early remission and identifying its predictors in rheumatoid arthritis : results from an observational cohort (2009-2018). Clin Rheumatol, 2020. 39(2) : p. 381-389.
10. Snoeck Henkemans, S.V.J., et al, Patient-reported outcomes and radiographic progression in patients with rheumatoid arthritis in sustained remission versus low disease activity. RMD Open, 2024. 10(1).
11. Fraenkel, L., et al., 2021 American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken), 2021. 73(7) : p. 924-939.
12 Bogas, P., et al, Comparaison de l’efficacité à long terme entre les agents biologiques suite à l’échec de l’inhibiteur du facteur de nécrose tumorale chez les patients atteints de polyarthrite rhumatoïde : une étude de cohorte prospective. Ther Adv Musculoskelet Dis, 2021. 13: p. 1759720×211060910.
13 Wei, W., et al, Persistance du traitement et résultats cliniques de la cyclicité de l’inhibiteur du facteur de nécrose tumorale ou du passage à un nouveau mécanisme de thérapie d’action : étude observationnelle en vie réelle de patients atteints de polyarthrite rhumatoïde aux États-Unis avec un traitement antérieur par inhibiteur du facteur de nécrose tumorale. Adv Ther, 2017. 34(8) : p. 1936-1952.
14. Migliore, A., et al, Cycling of tumor necrosis factor inhibitors versus switching to different mechanism of action therapy in rheumatoid arthritis patients with inadequate response to tumor necrosis factor inhibitors : a Bayesian network meta-analysis. Ther Adv Musculoskelet Dis, 2021. 13: p. 1759720×211002682.
15. Mann, H., et al, Switching to a Targeted Drug with a Different Mode of Action After Discontinuation of the First TNF Inhibitor Is Associated with Better Drug Survival Compared to a Second TNF Inhibitor in Rheumatoid Arthritis : A Propensity Score-matched Analysis from the Czech ATTRA Registry. Abstract 2277, présenté à l’ACR Convergence, 14-19 novembre 2024, Washington DC, USA.
16. information professionnelle actuelle de RINVOQ® (upadacitinib) sur www.swissmedicinfo.ch.
17. Fleischmann, R., et al, Efficacité et sécurité à long terme suite au passage de l’upadacitinib à l’adalimumab chez les patients atteints de polyarthrite rhumatoïde : données à 5 ans issues de SELECT-COMPARE. Rheumatol Ther, 2024. 11(3) : p. 599-615.
18. Linde, L., et al, Deuxième et troisième inhibiteurs du TNF chez les patients européens atteints de spondyloarthrite axiale : efficacité et impact de la raison du changement. Rheumatology (Oxford), 2024. 63(7) : p. 1882-1892.
19. Ørnbjerg, L.M., et al, Efficacité médicamenteuse des 2ème et 3ème inhibiteurs du TNF dans l’arthrite psoriasique – relation avec la raison de l’arrêt du traitement précédent. Joint Bone Spine, 2024. 91(4) : p. 105729.
20. Fleischmann, R., et al., Upadacitinib Versus Placebo ou Adalimumab chez les patients atteints de polyarthrite rhumatoïde et présentant une réponse inadéquate au méthotrexate : résultats d’un essai de phase III, en double aveugle, randomisé et contrôlé. Arthritis Rheumatol, 2019. 71(11) : p. 1788-1800.
21. Fleischmann, R., et al, Sécurité et efficacité à long terme de l’upadacitinib versus adalimumab chez les patients atteints de polyarthrite rhumatoïde : données à 5 ans de l’étude randomisée de phase 3 SELECT-COMPARE. RMD Open, 2024. 10(2).
22 Witte, T., et al, The impact of C-reactive protein levels on the effectiveness of upadacitinib in patients with rheumatoid arthritis : a 12-month prospective, non-interventional German study. Clin Exp Rheumatol, 2024. 42(3) : p. 726-735.
23 Bessette, L., et al., Efficacité réelle de l’upadacitinib pour le traitement de la polyarthrite rhumatoïde chez les patients canadiens : Interim Results from the Prospective Observational CLOSE-UP Study. Rheumatol Ther, 2024. 11(3) : p. 563-582.
24 Burmester GR, et al, Safety of Upadacitinib Across Rheumatoid Arthritis, Psoriatic Arthritis, and Axial Spondyloarthritis Encompassing 15,000 Patient-Years of Clinical Trial Data. Présenté au Congrès européen de rhumatologie (EULAR), 12-15 juin 2024, Vienne, Autriche. POS0894.
Les références peuvent être demandées par les professionnels de la santé en écrivant à medinfo.ch@abbvie.com.