Lors du congrès ESMO à Amsterdam, des intervenants de différents pays ont discuté des derniers résultats et des recommandations thérapeutiques dans le domaine de la leucémie lymphoïde chronique. Dans l’ensemble, la chimio-immunothérapie à base de fludarabine, de cyclophosphamide (FC) et de rituximab (R), un anticorps anti-CD20, montre certes une bonne efficacité, mais les traitements devraient à l’avenir être plus ciblés et surtout applicables aux formes récidivantes, concluent les experts.
Selon le professeur Paolo Ghia, de Milan, de nouvelles connaissances sur la génétique de la leucémie lymphoïde chronique (LLC) ont été acquises ces dernières années : “Des études soulignent par exemple l’importance de l’épissage pré-ARNm, un processus cellulaire critique qui peut contribuer à la leucémie lymphoïde chronique [1, 2]. En outre, les mutations périodiques de NOTCH1, MYD88 et XPO1 favorisent le développement clinique de la maladie [3]”. En fin de compte, l’influence de certaines mutations semble disparaître lorsqu’un traitement par allogreffe de cellules souches hématopoïétiques est mis en place [4].

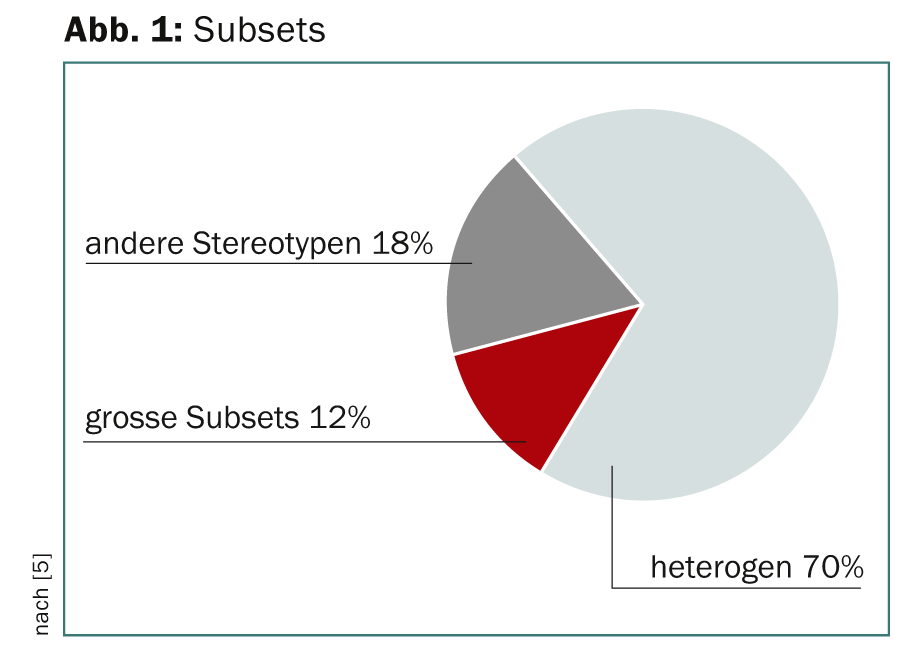
L’hypothèse selon laquelle la LLC peut être divisée en différents sous-ensembles de récepteurs de cellules B stéréotypés (BCR) est pertinente d’un point de vue fonctionnel et pronostique. Ainsi, une classification moléculaire et des interventions thérapeutiques ciblées s’appliquant à un grand nombre de patients dans le même sous-ensemble seraient possibles. Une analyse de séquence a révélé deux groupes supérieurs pour les patients atteints de LLC : L’un avec des BCR stéréotypés, l’autre avec des BCR non stéréotypés, avec un ratio de 1:2 [5]. 12% du groupe de stéréotypes formaient de grands sous-ensembles (Fig. 1).
Traitement de première ligne
Le Dr Peter Hillmen, Leeds, a présenté des pistes pour le traitement de première ligne de la LLC : “Des études randomisées de phase III [6] concluent qu’un traitement chimio-immun à base de fludarabine, cyclophosphamide et rituximab (FCR) améliore le taux de survie sans progression et le taux de survie global. Trois ans après la randomisation (le second groupe a subi une chimiothérapie par fludarabine, cyclophosphamide), 65% du premier groupe était sans progression, contre 45% seulement dans le second. Les auteurs concluent qu’un traitement spécifique de première ligne peut modifier l’évolution naturelle de la LLC. Ces résultats ont défini le nouveau standard dans le traitement de la LLC”. Si l’un des critères suivants s’applique à un patient, la combinaison (FCR) à pleine dose n’est pas recommandée :
- Âge : 75 ans ou plus
- Statut de performance OMS 2 ou 3
- Limitations cardiaques (NYHA classe II), respiratoires (bronchectasie ou BPCO modérée) ou rénales.
Autres options thérapeutiques
La question de savoir si la fludarabine en monothérapie (première ligne) est plus efficace que le chlorambucil chez les patients de plus de 65 ans est controversée. Bien que la fludarabine atteigne des taux de rémission significativement plus élevés, ni le taux de survie sans progression ni le taux de survie globale ne sont améliorés par rapport au chlorambucil [7].
L’ofatumumab, un anticorps monoclonal humain (anti-CD20), montre une bonne efficacité et une bonne tolérance en monothérapie chez les patients insensibles à la fludarabine, y compris chez ceux qui ont été précédemment traités par rituximab [8]. “Jusqu’à présent, il n’existe pas d’études comparatives comparant l’ofatumumab au rituximab. Ce que l’on pense, c’est que l’association de l’ofatumumab avec Chlorambucil pourrait améliorer le taux de survie sans progression par rapport à la monothérapie par Chlorambucil”, a déclaré le Dr Hillmen.
Un nouvel anticorps de type II anti-CD20 appelé obinutuzumab (GA-101) semble en outre offrir une approche prometteuse pour un nouveau traitement [9].
Le traitement actuel n’est pas assez efficace ?
Malgré les nombreuses possibilités : Le Dr Hillmen conclut que les voies de traitement actuelles sont inefficaces pour la LLC. Et ce pour plusieurs raisons :
Toxicité : Premièrement, des dommages sont causés aux cellules normales. En outre, les cellules LLC développent de plus en plus de résistance. “Les thérapies actuelles ne sont pas ciblées”, a souligné le Dr Hillmen.
Efficacité : seul un petit nombre de patients obtient une véritable rémission complète. Les rechutes sont donc inévitables et la majorité d’entre elles finissent par mourir de la LLC.
De nouvelles approches visant à mieux comprendre la physiopathologie sont donc nécessaires de toute urgence, par exemple avec l’ibrutinib, un inhibiteur de tyrosine kinase qui, dans les premières études multicentriques de phase Ib/II, a permis d’obtenir des taux de rémission durable chez les patients atteints de LLC en rechute ou résistante, y compris ceux présentant des lésions génétiques à haut risque [10].
Récidives de LLC
En cas de LLC récidivante, l’allogreffe de cellules souches hématopoïétiques est l’étalon-or, car elle permet d’obtenir un bon contrôle de la maladie indépendamment des mutations [4].
Stephan Stilgenbauer, Ulm, a décrit le traitement optimal comme suit : “La LLC récidivante est une maladie hétérogène sur le plan biologique et clinique qui, après une rémission de >24 (-36) mois, doit d’abord être abordée en répétant le régime de traitement initial. Les standards sont ici les thérapies FCR, R-bendamustine, R-chlorambucil. Malheureusement, il manque par ailleurs une norme de traitement satisfaisante pour les rechutes à 24-36 mois. L’allogreffe de cellules souches hématopoïétiques est une option pour les jeunes patients à haut risque. De nouveaux agents biologiques (antagonistes du signal BCR, inhibiteurs de BCL2, anticorps de type II, etc.) et de futures combinaisons sans chimiothérapie, ou du moins à dose réduite, sont porteurs d’espoir”.
Source : “Treatment of Chronic lymphocytic Leukaemia”, session du 38e congrès ESMO, 27 septembre au 1er octobre 2013, Amsterdam
Littérature :
- Wang L, et al : N Engl J Med 2011 ; 365 : 2497-2506. doi : 10.1056/NEJMoa1109016.
- Quesada V, et al : Nat Genet 2011 Dec 11 ; 44(1) : 47-52. doi : 10.1038/ng.1032.
- Puente XS, et al : Nature 2011 Jun 5 ; 475(7354) : 101-105. doi : 10.1038/nature10113.
- Dreger P, et al : Blood 2013 Apr 18 ; 121(16) : 3284-3288. doi : 10.1182/blood-2012-11-469627. Epub 2013 Feb 22.
- Agathangelidis A, et al : Blood 2012 ; 119(19) : 4467-4475.
- Hallek M, et al : The Lancet 2010 ; 376(9747) : 1164-1174.
- Eichhorst BF, et al : Blood 2009 Oct 15 ; 114(16) : 3382-3391. doi : 10.1182/blood-2009-02-206185. Epub 2009 Jul 15.
- Wierda WG, et al : Published online before print Blood 2011. doi : 10.1182/blood-2011-04-348656.
- Mössner E, et al : Blood 2010 Jun 3 ; 115(22) : 4393-4402. doi : 10.1182/blood-2009-06-225979.
- Byrd JC, et al. : N Engl J Med 2013 ; 369 : 32-42. doi : 10.1056/NEJMoa1215637.
InFo Oncologie & Hématologie 2013 ; 1(1) : 39-40
CongrèsSpecial 2014 ; 6(1) : 19-20











