Chez les patients présentant une hypertension artérielle résistante au traitement, il convient de procéder à une anamnèse détaillée, à un examen physique et à une mesure ambulatoire de la pression artérielle sur 24 heures, mais aussi à des analyses de laboratoire des électrolytes sériques, du glucose et des paramètres de rétention rénale, ainsi qu’à un diagnostic urinaire avec dosage des protéines et excrétion de l’urine sodée. La dénervation sympathique rénale interventionnelle (RDN) basée sur un cathéter est une nouvelle procédure interventionnelle puissante et à faible risque de complications pour les patients dont la résistance au traitement est avérée. Un cathéter d’ablation est introduit dans les artères rénales par voie fémorale, sous radioscopie, et l’énergie d’ablation (par ex. courant haute fréquence ou ultrasons) est ensuite délivrée. Cela entraîne la sclérose des fibres nerveuses sympathiques situées dans l’adventice. Les contre-indications à la RDN sont une hypertension d’origine secondaire, une anatomie inadaptée des artères rénales et un DFG <45 ml/min par 1,73 m². D’autres études doivent être menées pour déterminer dans quelle mesure la RDN peut également être utilisée pour traiter d’autres maladies présentant une activité sympathique accrue.
Environ 5 à 15% des patients hypertendus présentent une hypertension artérielle résistante au traitement [1–3]. Elle est définie comme un contrôle de la pression artérielle non conforme aux directives (>140/90 mmHg en général, >130-139/80-85 mmHg chez les patients atteints de diabète sucré, >130/80 mmHg en cas de maladie rénale chronique) malgré la prise continue d’une trithérapie antihypertensive incluant un diurétique dans une combinaison appropriée [2]. Dans la physiopathologie de la maladie, la suractivité du système nerveux végétatif, due à un déséquilibre entre l’activité sympathique et parasympathique, revêt une importance primordiale [4]. Une augmentation de l’activité sympathique efférente dans le rein entraîne une augmentation de la sécrétion de rénine, une augmentation de la rétention de sodium (tubule proximal) et une diminution de la perfusion rénale [4]. L’objectif de ce travail est de fournir un aperçu du traitement de l’hypertension résistante au traitement par dénervation sympathique rénale interventionnelle (RDN).
Sélection des patients
En principe, outre le traitement médicamenteux, les mesures de modification du mode de vie constituent la base de tout traitement antihypertenseur. Il faut faire la distinction entre une véritable résistance au traitement et une pseudo-résistance, due par exemple à un manque d’adhérence au médicament ou à des valeurs tensionnelles élevées en fonction de la situation, au sens d’une hypertension de la blouse blanche [2]. Dans jusqu’à 20% des cas, les patients souffrant d’hypertension résistante au traitement ont des causes secondaires d’hypertension (tableau 1) [2]. Les causes potentiellement réversibles incluent également un traitement antihypertenseur sous-optimal et les effets secondaires hypertensifs d’autres médicaments (par ex. AINS, cortisone). En plus d’une anamnèse détaillée, d’un examen physique et d’une mesure ambulatoire de la pression artérielle sur 24 heures, les analyses de laboratoire des électrolytes sériques, du glucose et des paramètres de rétention rénale ainsi qu’un diagnostic urinaire avec dosage des protéines et excrétion de l’urine sodée devraient donc faire partie intégrante du diagnostic chez les patients présentant une hypertension artérielle résistante au traitement [5]. Le dépistage de l’hyperaldostéronisme primaire se fait par la détermination du ratio aldostérone/rénine. Dans ce cas, il faut absolument faire attention aux interactions possibles avec les substances antihypertensives. Si un hyperaldostéronisme primaire est mis en évidence (ratio aldostérone/rénine >50), des examens d’imagerie plus poussés ainsi qu’un prélèvement sanguin des veines surrénales séparées par des parois sont recommandés. Les patients présentant des augmentations épisodiques et en crise de la pression artérielle doivent être examinés pour détecter la présence d’un phéochromocytome. En outre, une échographie des artères rénales est conseillée pour exclure une sténose athéroscléreuse de l’artère rénale ou une dysplasie fibromusculaire.

Contre-indications
Les contre-indications actuelles à la RDN sont une hypertension d’origine secondaire (à l’exception du syndrome d’apnée obstructive du sommeil), une anatomie inadaptée des artères rénales (diamètre <4 mm, longueur <20 mm ; dysplasie fibromusculaire ; sténose significative des artères rénales) et un DFG <45 ml/min par 1,73 m² [5]. Une étude pilote récemment publiée (n=15) a montré que la RDN pouvait également être réalisée de manière sûre et efficace chez les patients souffrant d’une maladie rénale chronique modérée à sévère (DFG moyen de 31 ml/min par 1,73 m²) [6]. Toutefois, le traitement des patients souffrant d’insuffisance rénale de haut niveau ne doit être effectué pour l’instant que dans des centres expérimentés et dans le cadre d’études cliniques.
Procédure
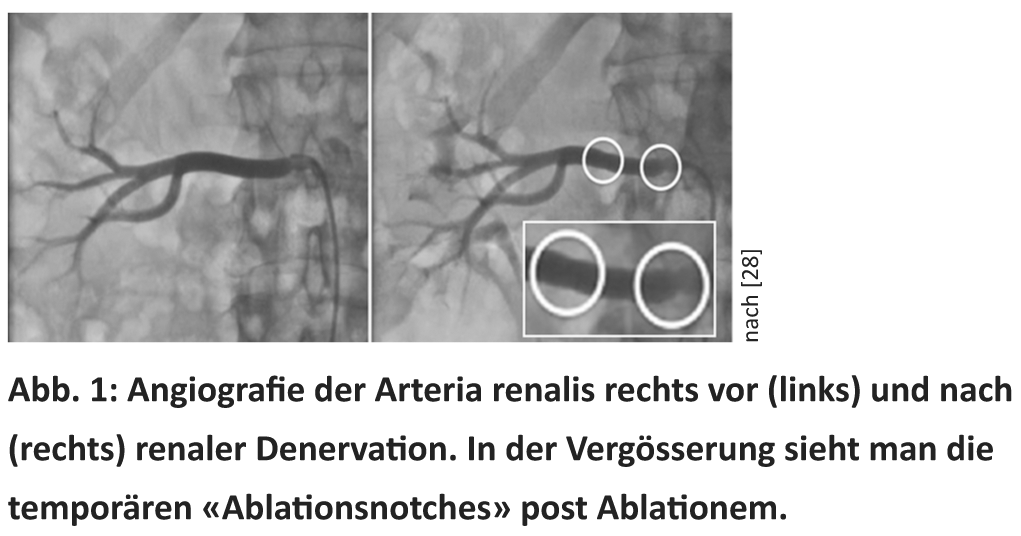
Dès les années 50, la splanchniectomie chirurgicale était considérée comme une procédure de réserve pour le traitement de l’hypertension artérielle sévère [7]. La section radicale des fibres nerveuses sympathiques a permis d’obtenir des réductions de la pression artérielle allant jusqu’à 70 mmHg. Cependant, l’intervention a très souvent entraîné des complications graves telles que des vertiges massifs, des syncopes, de l’incontinence et des dysfonctionnements érectiles [7]. Depuis peu, il est possible de scléroser de manière ciblée les fibres sympathiques rénales grâce à une procédure peu invasive basée sur un cathéter. Actuellement, six systèmes de cathéters certifiés CE sont disponibles pour la RDN (Medtronic® Symplicity, St Jude® EnligHTN, Vessix® The V2, Covidien® OneShot, Terumo Iberis et Recor® Paradies). Pour ce faire, un cathéter d’ablation est introduit dans les artères rénales par une voie fémorale, sous radioscopie, et l’énergie d’ablation (par ex. courant à haute fréquence ou ultrasons) peut ensuite être délivrée (Fig. 1). Cela entraîne la sclérose des fibres nerveuses sympathiques situées dans l’adventice [8]. La procédure dure environ 30 à 45 minutes selon le dispositif et est effectuée sur les deux reins. Comme les fibres sympathiques sont accompagnées de fibres C douloureuses, la douleur apparaît brièvement pendant la délivrance de l’énergie et uniquement pendant la durée de celle-ci (30 à 120 secondes), de sorte qu’une analgosédation avec des opiacés et des sédatifs est nécessaire pour ce moment [5]. Suite à l’intervention, un suivi continu des patients est recommandé, généralement tous les trois à six mois la première année après l’intervention, puis une fois par an [5].
Sécurité
L’intervention est considérée comme peu risquée et comparable à celle d’un cathétérisme cardiaque. La procédure a pu être réalisée sans complications chez 201 des 206 (98%) patients systématiquement recensés dans les études pivots. Quatre patients (1,9%) ont présenté des pseudo-anévrismes de l’artère fémorale après l’intervention (prévalence pour les autres interventions : 0,8-2,2% [9]), qui ont tous pu être traités de manière conservatrice. Les lésions vasculaires majeures telles que les dissections d’artères, les anévrismes ou le développement d’une sténose de l’artère rénale (<1%) sont extrêmement rares [10, 11]. De même, la dénervation rénale n’a pas révélé de dysfonction orthostatique, de troubles électrolytiques, d’incompétence chronotrope [12] ou d’influence négative sur la fonction rénale [11].
Études cliniques
Dans l’étude multicentrique de preuve de concept Symplicity HTN-1, les patients (n=45) sous traitement par 4,7 agents antihypertenseurs en moyenne présentaient une pression artérielle de 177/101 mmHg avant la RDN [13]. Après seulement un mois, une réduction significative de la pression artérielle de 14/10 mmHg (p=0,026) a été documentée dans le groupe de traitement. Cet effet a augmenté progressivement au cours de la période de suivi pour atteindre -27/-17 mmHg (p=0,026) à 12 mois, sans modification du traitement antihypertenseur. Aucune nouvelle augmentation de la pression artérielle n’a été observée au cours de la période d’étude ni dans le suivi étendu à 36 mois actuellement publié (figure 2) [14, 15]. Cela rend improbable une régénération fonctionnelle, de sorte que l’on peut supposer un effet à plus long terme. La réduction de l’activité sympathique par la RDN a été confirmée par une diminution significative de 47% de la libération rénale de noradrénaline (n=10) et a été corrélée à une réduction de la pression artérielle (-22/-12 mmHg) après six mois [13].

Dans l’étude randomisée et contrôlée Symplicity HTN-2 (n=106), la pression artérielle moyenne était de 178/96 mmHg malgré la prise d’une moyenne de 5,3 médicaments antihypertenseurs [16]. Six mois après la RDN, il y a eu une réduction significative de la pression artérielle de 32/12 mmHg (p<0,0001), alors que la pression artérielle est restée inchangée dans le groupe témoin. La réduction de la pression artérielle a permis de réduire la prise de médicaments ou la dose chez 20% des patients. Chez 84% des patients, la RDN a entraîné une réduction de la pression artérielle systolique d’au moins 10 mmHg à six mois. Une pression artérielle systolique élevée au moment de l’étude (p<0,001) et la prise de médicaments sympathiques à action centrale (p=0,018) étaient des prédicteurs indépendants d’une réduction significative de la pression artérielle [15].
Dans les études cliniques menées jusqu’à présent, le taux de non-réponse se situait entre 8 et 17% [17]. Les prédicteurs d’une absence de réponse au traitement n’ont pas encore été identifiés. Une mesure de la pression artérielle à long terme était disponible pour 20 patients du groupe de dénervation. La réduction de la pression artérielle à six mois était de 11/7 mmHg (p=0,007/0,014), alors qu’aucun changement significatif n’a été observé dans le groupe témoin [18]. Cette année, il a également été possible de recueillir pour la première fois des données sur des patients souffrant de formes moins sévères d’hypertension résistante au traitement, avec une pression artérielle systolique comprise entre 140 et 160 mmHg [19]. Dans ce groupe, la RDN a réduit la pression artérielle de 13/5 mmHg (p<0,001) à six mois.
Actuellement, l’étude multicentrique, en simple aveugle, randomisée et contrôlée par placebo Symplicity HTN-3 (NCT01418261) recrute des patients aux États-Unis. Cette étude répondra, nous l’espérons, à la question de savoir quelle est la contribution de l’effet placebo à la réduction de la pression artérielle après RDN. Des registres cliniques et un suivi continu des patients traités sont nécessaires pour pouvoir évaluer définitivement les effets à long terme et la sécurité de la procédure. Des registres nationaux (German Renal Denervation [GREAT] Registry) et internationaux (Symplicity Global Registry ; NCT01534299) sont en cours d’élaboration à cet effet.
Effets pléiotropes
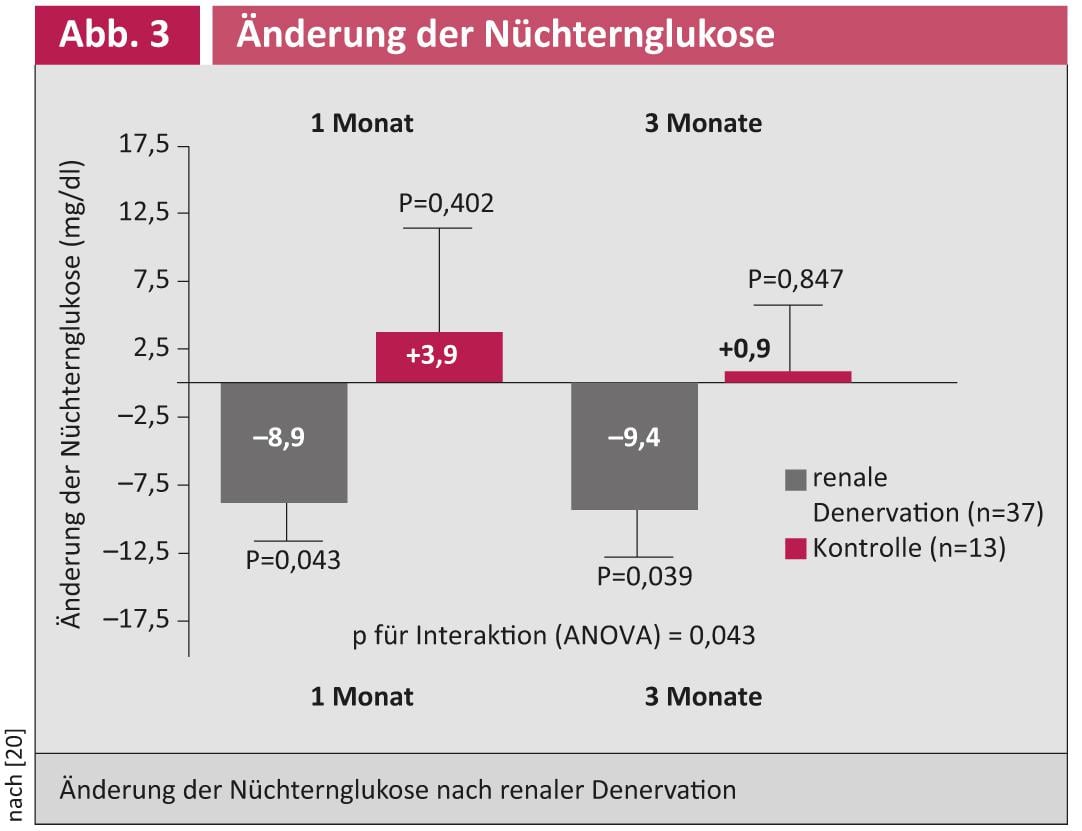
Les premiers résultats de l’étude indiquent que le métabolisme du glucose peut également s’améliorer chez les patients souffrant d’hypertension résistante au traitement après une RDN (Fig. 3) [20].
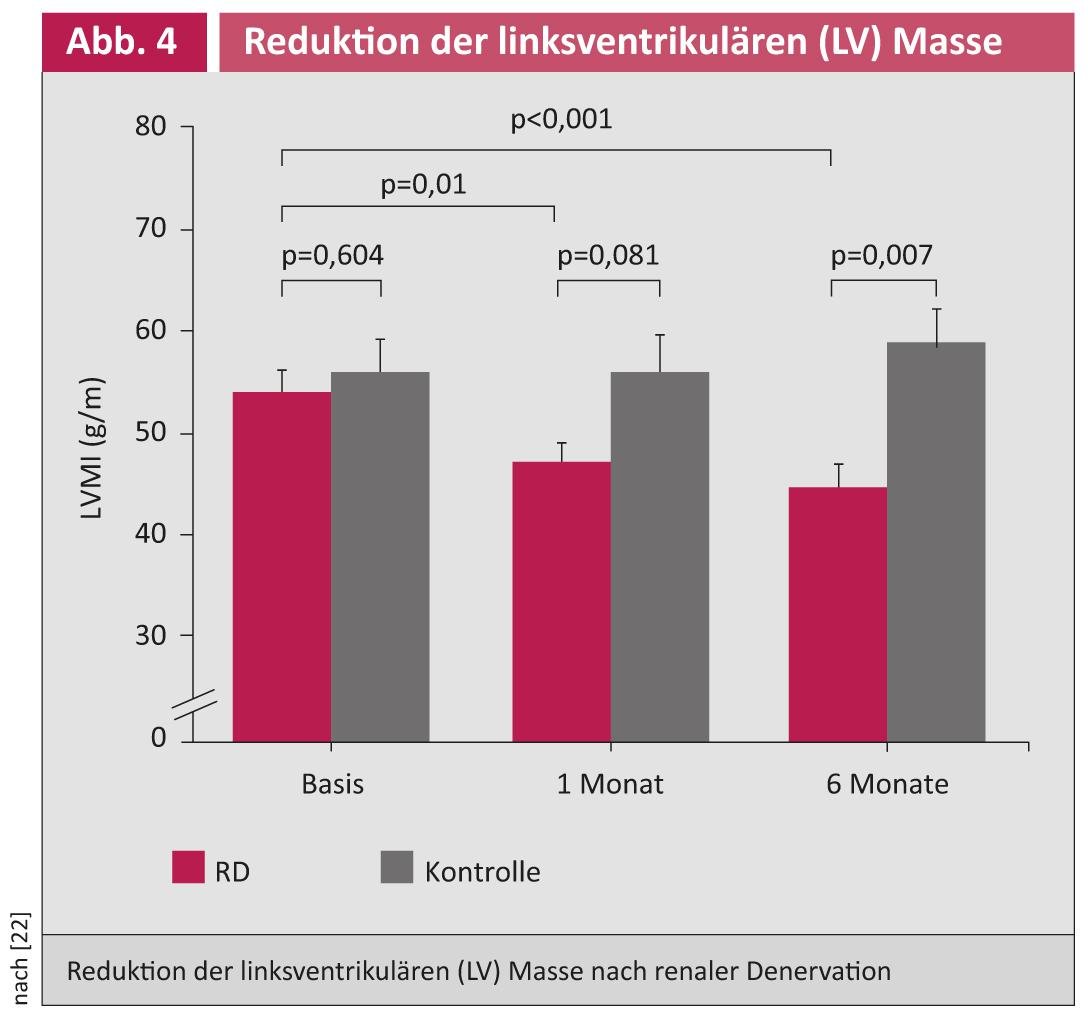
Dans le cadre d’une étude pilote, une réduction de la pression artérielle, une amélioration du métabolisme du glucose et une réduction de l’indice d’apnée/hypopnée ont été démontrées après RDN chez des patients souffrant d’hypertension résistante au traitement et du syndrome d’apnée obstructive du sommeil [21]. Une sous-étude d’écho a montré que la RDN peut entraîner une réduction de la masse ventriculaire gauche (en particulier en cas d’hypertrophie ventriculaire gauche) et une amélioration de la fonction diastolique (Fig. 4) [22].
En outre, les premiers effets positifs ont été démontrés chez des patients souffrant d’insuffisance cardiaque chronique [23, 24] en ce qui concerne le contrôle de la pression artérielle après une dissection aortique de type B [25] ainsi qu’en cas d’insuffisance rénale chronique [26].
Littérature :
- Lim SS, et al. : A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010 : a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2013 ; 380 (9859) : 2224-2260 doi:10.1016/S0140-6736(12)61766-8.
- Calhoun DA, et al : Resistant hypertension : diagnosis, evaluation, and treatment : a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Circulation 2008 ; 117(25) : e510-526 doi:10.1161/CIRCULATIONAHA.108.189141.
- Daugherty SL, et al : (2012) Incidence et pronostic de l’hypertension résistante chez les patients hypertendus. Circulation 2012 ; 125(13) : 1635-1642 doi:10.1161/CIRCULATIONAHA.111.068064.
- Sobotka PA, et al : Axe sympatho-rénal dans les maladies chroniques. Clin Res Cardiol 2011 ; 100 (12) : 1049-1057 doi:10.1007/s00392-011-0335-y.
- Mahfoud F, et al : Expert consensus document from the European Society of Cardiology on catheter-based renal denervation. Eur Heart J 2013 doi:10.1093/eurheartj/eht154.
- Hering D, et al : Dénervation rénale dans l’IRC modérée à sévère. J Am Soc Nephrol 2012 ; 23(7) : 1250-1257 doi:10.1681/ASN.2011111062.
- Smithwick RH, Thompson JE : Splanchnicectomie pour hypertension essentielle ; résultats dans 1,266 cas. J Am Med Assoc 1953 ; 152 (16) : 1501-1504.
- Atherton DS, et al : Micro-anatomie du système nerveux sympathique rénal : une étude histologique humaine post-mortem. Clin Anat 2012 ; 25 (5) : 628-633 doi:10.1002/ca.21280.
- Lenartova M, Tak T : Pseudoanévrisme latrogène de l’artère fémorale : rapport de cas et revue de la littérature. Clin Med Res 2003 ; 1(3) : 243-247.
- Vonend O, et al : Augmentation secondaire de la pression artérielle après une dénervation rénale. The Lancet 2012 ; 380(9843) : 778 doi:10.1016/s0140-6736(12)61145-3.
- Mahfoud F, et al : Hémodynamique rénale et fonction rénale après dénervation sympathique rénale par cathéter chez les patients souffrant d’hypertension résistante. Hypertension 2012 ; 60(2) : 419-424 doi:10.1161/HYPERTENSIONAHA.112.193870.
- Ukena C, et al : Réponse cardiorespiratoire à l’exercice après dénervation sympathique rénale chez les patients atteints d’hypertension résistante. J Am Coll Cardiol 2011 ; 58 (11) : 1176-1182 doi:10.1016/j.jacc.2011.05.036.
- Krum H, et al : Catheter-based renal sympathetic denervation for resistant hypertension : a multicentre safety and proof-of-principle cohort study. Lancet 2009 ; 373(9671) : 1275-1281 doi:10.1016/S0140-6736(09)60566-3.
- Esler MD, et al : Dénervation sympathique rénale pour le traitement de l’hypertension résistante aux médicaments : résultats à un an de l’essai contrôlé randomisé Symplicity HTN-2. Circulation 2012 ; 126(25) : 2976-2982 doi:10.1161/CIRCULATIONAHA.112.130880.
- Symplicité HTNI : Dénervation sympathique rénale par cathéter pour l’hypertension résistante : durabilité de la réduction de la pression artérielle au-delà de 24 mois. Hypertension 2011 ; 57(5) : 911-917 doi:10.1161/HYPERTENSIONAHA.110.163014.
- Esler MD, et al : Dénervation sympathique rénale chez les patients souffrant d’hypertension résistante au traitement (The Symplicity HTN-2 Trial) : un essai contrôlé randomisé. Lancet 2010 ; 376(9756) : 1903-1909 doi:10.1016/S0140-6736(10)62039-9.
- Ukena C, et al : Réponse et non-réponse à la dénervation rénale : qui est le candidat idéal ? EuroIntervention 2013 ; 9 Suppl R : R54-57 doi:DOI : 10.4244/EIJV9SRA10.
- Mahfoud F, et al : Changements ambulatoires de la pression artérielle après dénervation sympathique rénale chez les patients souffrant d’hypertension résistante. Circulation 2013 ; 128(2) : 132-140 doi:10.1161/CIRCULATIONAHA.112.000949.
- Kaltenbach B, et al : La dénervation sympathique rénale comme traitement de seconde ligne dans l’hypertension résistante légère : une étude pilote. Catheter Cardiovasc Interv 2013 ; 81(2) : 335-339 doi:10.1002/ccd.24557.
- Mahfoud F, et al : Effet de la dénervation sympathique rénale sur le métabolisme du glucose chez les patients souffrant d’hypertension résistante : une étude pilote. Circulation 2011 ; 123(18) : 1940-1946 doi:10.1161/CIRCULATIONAHA.110.991869.
- Witkowski A, et al : Effects of renal sympathetic denervation on blood pressure, sleep apnea course, and glycemic control in patients with resistant hypertension and sleep apnea. Hypertension 2011 ; 58(4) : 559-565 doi:10.1161/HYPERTENSIONAHA.111.173799.
- Brandt MC, et al : La dénervation sympathique rénale réduit l’hypertrophie ventriculaire gauche et améliore la fonction cardiaque chez les patients souffrant d’hypertension résistante. J Am Coll Cardiol 2012 ; 59(10) : 901-909 doi:10.1016/j.jacc.2011.11.034.
- Davies JE, et al : Évaluation de la sécurité du premier homme de la dénervation rénale pour l’insuffisance cardiaque systolique chronique : Résultats primaires de l’étude pilote REACH. Int J Cardiol 2012 doi:10.1016/j.ijcard.2012.09.019
- Ukena C, et al : Dénervation sympathique rénale pour le traitement de l’orage électrique : expérience du premier homme. Clin Res Cardiol 2012 ; 101(1) : 63-67 doi:10.1007/s00392-011-0365-5.
- Ewen S, et al. : Première expérience chez l’homme : dénervation rénale percutanée par fenestration de fausse lumière dans la dissection aortique de type B. EuroIntervention 2013 ; 8(9) : 1110 doi:10.4244/eijv8i9a170.
- Ewen S, et al : Le système nerveux sympathique dans la maladie rénale chronique. Curr Hypertens Rep 2013 doi:10.1007/s11906-013-0365-0.
- Mahfoud F, et al : Stratégies de traitement de l’hypertension artérielle résistante. Dtsch Arztebl Int 2011 ; 108(43) : 725-731 doi:10.3238/arztebl.2011.0725.
- Ewen S, et al. : Dénervation rénale percutanée : nouvelle option de traitement pour l’hypertension résistante et plus ? Heart 2013 (Epub before printing).
- Krum, et al : J Am Coll Cardiol 2012 ; 59 : E1704.