La Société européenne de nutrition clinique et de métabolisme (ESPEN) définit l’EM comme un état nutritionnel dans lequel un déficit en énergie, en protéines et en micronutriments entraîne une altération de la composition corporelle (masse musculaire réduite) et une diminution des fonctions physiques et mentales. Dans les pays industrialisés, un patient sur trois présente un risque d’EM ou un EM manifeste à son entrée à l’hôpital. La ME est décrite comme “l’une des principales raisons cachées de l’augmentation des coûts des soins de santé”.
Hippocrate de Kos, le père de la médecine moderne, attribuait déjà une grande importance à l’alimentation au quatrième siècle avant Jésus-Christ : “[…] que votre nourriture soit votre médecine et que votre médecine soit votre nourriture”. De nos jours, les effets cliniques négatifs de la malnutrition associée à une maladie (ME) sont bien étudiés : durée d’hospitalisation plus longue, qualité de vie plus faible, taux de morbidité et de mortalité plus élevés. La ME est considérée comme “l’une des principales raisons cachées de l’augmentation des coûts de la santé” [Neue Zürcher Zeitung, 11.06.2002].
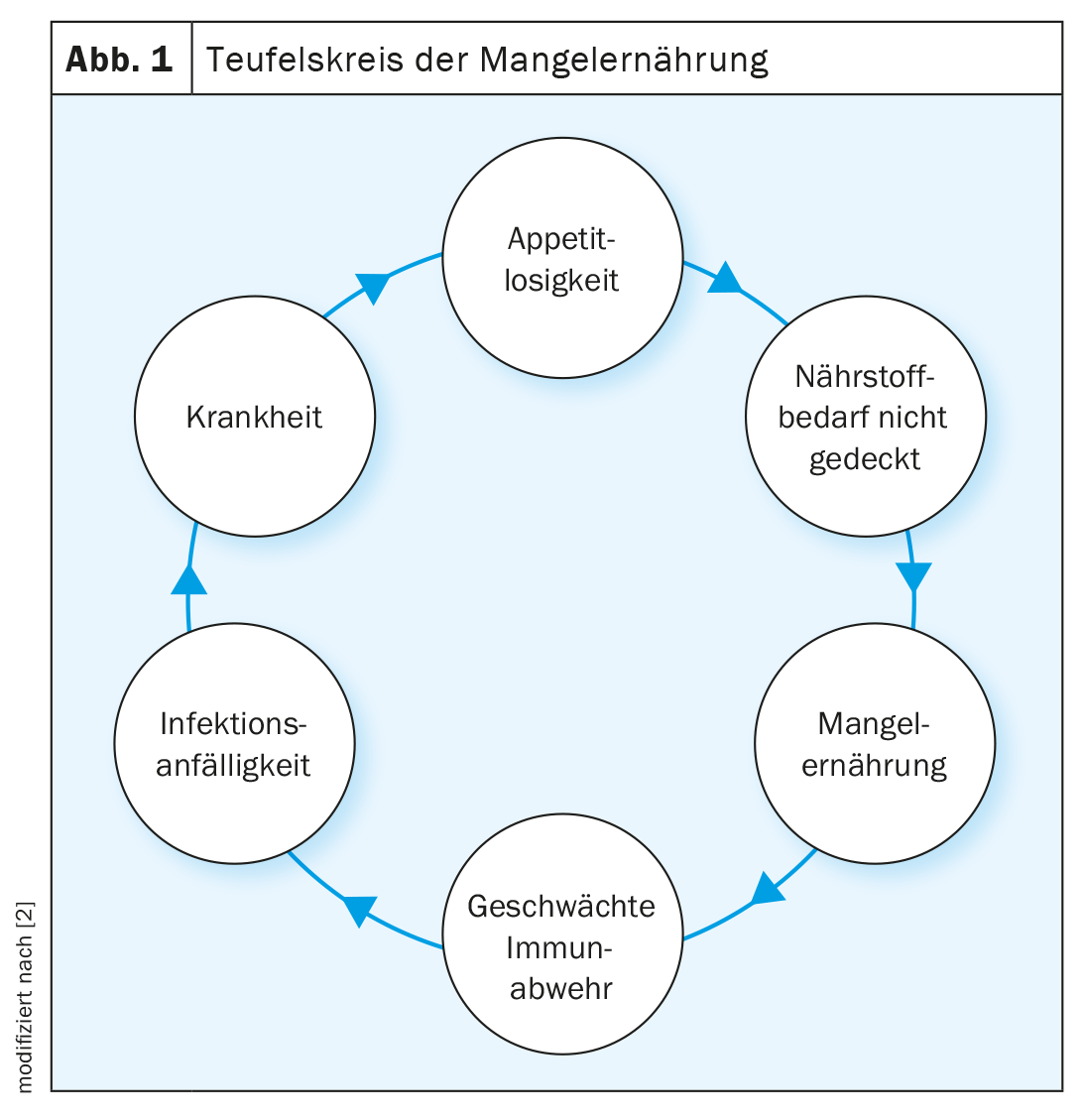
La Société européenne de nutrition clinique et de métabolisme (ESPEN) définit l’EM comme un état nutritionnel dans lequel un déficit en énergie, en protéines et en micronutriments entraîne une altération de la composition corporelle (masse musculaire réduite) et une diminution des fonctions physiques et mentales [1]. Dans les pays industrialisés, un patient sur trois présente un risque d’EM ou un EM manifeste à son entrée à l’hôpital. Ces patients continuent généralement à perdre du poids au cours de leur hospitalisation, ce qui entraîne une détérioration de leur état nutritionnel. Les multiples facteurs qui influencent cette perte de poids progressive et involontaire incluent la perte d’appétit, l’état inflammatoire, le catabolisme des protéines, les dysfonctionnements hormonaux, les troubles gastro-intestinaux, l’inactivité physique et l’abattement psychologique (Fig. 1). En moyenne, 2% de la population âgée est malnutrie et 24% présente un risque d’EM. Chez les personnes fragiles, la prévalence était nettement plus élevée, avec respectivement 9% et 45% [3]. La perte d’appétit est une réponse physiologique à une maladie aiguë, mais elle peut entraîner des déficits énergétiques et protéiques potentiellement dramatiques. L’EM et la maladie s’influencent mutuellement, la maladie pouvant entraîner l’EM d’une part et l’EM pouvant influencer négativement l’évolution de la maladie d’autre part. Combinés à une réponse endocrinienne et inflammatoire au stress, les déficits en énergie, en protéines et en micronutriments peuvent entraîner une perte de muscle et de force ainsi qu’une diminution des fonctions corporelles, en particulier chez les malades chroniques. En revanche, dans le cas d’une maladie aiguë, la perte d’appétit peut agir comme un mécanisme de protection et augmenter l’autophagie (un mécanisme propre à l’organisme pour éliminer les organelles cellulaires endommagées et les produits toxiques), ce qui peut favoriser la guérison. Ainsi, la suppression de l’autophagie par une thérapie nutritionnelle en cas de maladie aiguë a des effets potentiellement négatifs. Cependant, chez les malades chroniques, ce mécanisme de protection physiologique peut conduire à un EM associé à la maladie. Chez les patients atteints de maladies chroniques multiples de gravité légère et dont l’état nutritionnel se détériore, un traitement nutritionnel adéquat a un effet positif sur les résultats cliniques. Ces patients peuvent avoir un métabolisme plus efficace et une meilleure utilisation des nutriments en raison d’une faible résistance à l’insuline que les malades aigus [4]. Une thérapie nutritionnelle individuelle et personnalisée doit être mise en place pour améliorer les résultats cliniques et le bien-être. Les aspects importants sont le moment de la thérapie nutritionnelle, le mode d’administration, ainsi que la quantité et le choix des nutriments.
Preuves actuelles
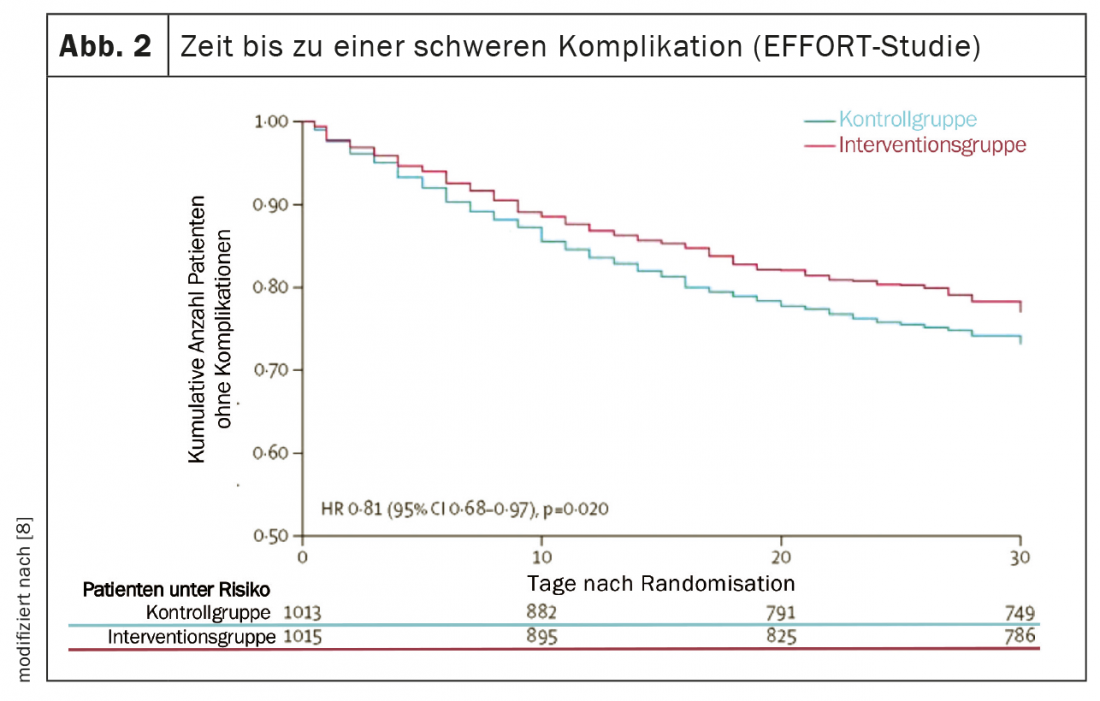
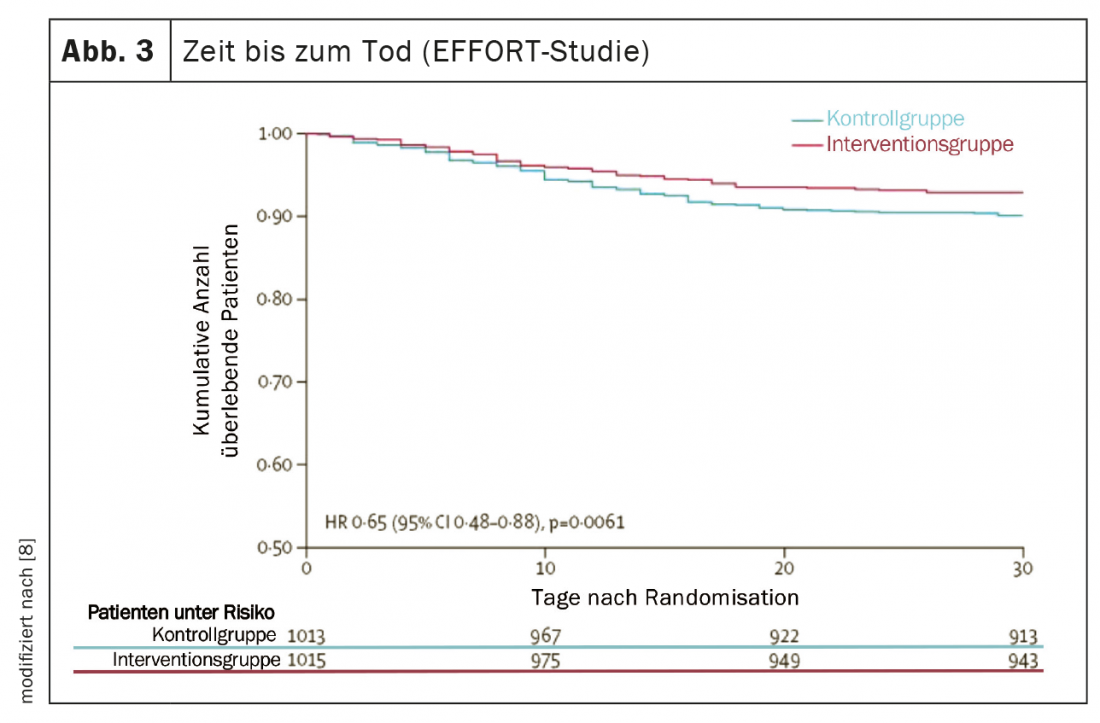
Plusieurs études de grande qualité ont fourni de nouvelles informations importantes au cours des cinq dernières années, ce qui a permis de faire progresser considérablement la médecine nutritionnelle et de mettre en pratique les résultats de la recherche en nutrition. [5]. L’étude PREDIMED (Prevención con Dieta Mediterránea) a fourni des preuves solides qu’un régime méditerranéen, complété par de l’huile d’olive extra vierge ou des noix mélangées, réduit le risque de maladies cardiovasculaires et métaboliques d’environ 30% sur cinq ans [6]. Deux études multicentriques contrôlées et randomisées ont démontré la grande efficacité d’un traitement nutritionnel adéquat chez les patients malnutris, tant à l’hôpital qu’après leur sortie [7,8]. D’une part, l’étude NOURISH (Nutrition effect On Unplanned ReadmIssions and Survival in Hospitalized patients), contrôlée par placebo et portant sur 652 adultes âgés souffrant de malnutrition, a montré qu’une supplémentation nutritionnelle orale à haute teneur en protéines pouvait réduire significativement la mortalité à 90 jours, avec un NNT (Number Needed to Treat) de 20 [7]. D’autre part, l’étude EFFORT (Effect of early nutritional support on Frailty, Functional Outcomes and Recovery of malnourished medical in patients Trial) portant sur 2028 patients hospitalisés et souffrant de malnutrition dans huit hôpitaux suisses a montré l’efficacité d’une thérapie nutritionnelle individualisée guidée par un algorithme. Comparée à l’alimentation hospitalière habituelle, la thérapie nutritionnelle axée sur la réalisation d’objectifs protéiques et énergétiques a permis de réduire significativement le taux de complications graves (NNT=25) et de mortalité (NNT=37) (figures 2 et 3). En outre, les handicaps fonctionnels ont été significativement moins fréquents et la qualité de vie s’est nettement améliorée [8]. Une méta-analyse récente incluant ces deux études conclut qu’un traitement nutritionnel adéquat chez les patients malnutris réduit le risque de mortalité et de réhospitalisation non urgente d’environ 25% [5].
Gestion de la nutrition
Le but de la thérapie nutritionnelle est de maintenir ou d’améliorer l’état nutritionnel et la qualité de vie par l’administration adéquate de nutriments. Pour éviter une détérioration de l’état nutritionnel, une prise en charge nutritionnelle rapide et fonctionnelle est nécessaire (tableau 1). Compte tenu des besoins croissants en matière de thérapie nutritionnelle dans le secteur ambulatoire – davantage de patients âgés, dépendants et polymorbides – il est judicieux de développer un champ de soins spécialisé pour la thérapie nutritionnelle en étroite collaboration avec une infirmière de pratique avancée. L’utilisation de professionnels de la santé dans des rôles de pratique avancée, en particulier dans la gestion de la nutrition, est à notre avis très prometteuse. Vous disposez de compétences cliniques approfondies et agissez conformément aux preuves scientifiques actuelles. Ils peuvent ainsi conseiller, traiter ou accompagner de manière autonome des patients présentant des pathologies complexes. Cela conduit à un développement efficace et durable dans la thérapie nutritionnelle.
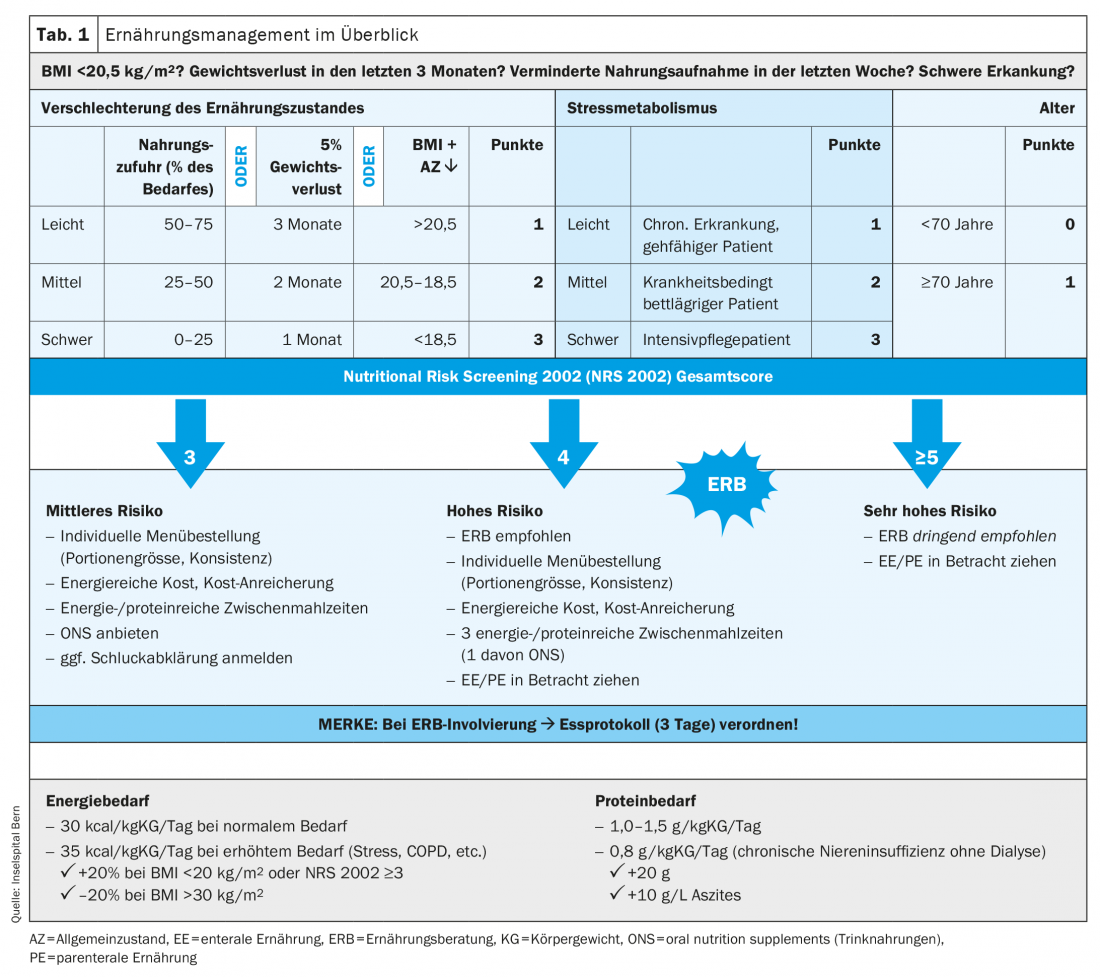
Dépistage et évaluation en ambulatoire : des procédures standardisées sont nécessaires pour mettre en place un traitement nutritionnel adéquat et en temps opportun. Un dépistage systématique du risque d’EM devrait être effectué, suivi d’une évaluation nutritionnelle complète, et conduire à l’élaboration d’un plan nutritionnel personnalisé. Le dépistage du risque d’EM est la première étape pour identifier précocement ou, au mieux, prévenir une détérioration de l’état nutritionnel. Le dépistage devrait identifier rapidement et de manière sensible les personnes qui ont besoin d’une évaluation nutritionnelle.
Le dépistage doit être effectué à l’aide d’instruments validés. L’ESPEN recommande le Nutritional Risk Screening 2002 (NRS 2002), Tab. 2). Il peut être réalisé en quelques minutes et est actuellement l’outil de dépistage le mieux validé [9,10]. Il a été développé en 2002 par le groupe de Jens Kondrup et est l’un des plus utilisés dans les hôpitaux du monde entier. Il consiste en un pré-screening de 4 questions. Si la réponse à une question est positive, le dépistage NRS 2002 doit être effectué. Il tient compte de l’évaluation de l’état nutritionnel (0-3 points), de la gravité de la maladie (0-3 points) et de l’âge (1 point si ≥70ans). Les points sont additionnés pour obtenir un score total, où ≥3points indiquent un risque d’EM ou un EM manifeste et où une évaluation nutritionnelle est indiquée.

Une évaluation nutritionnelle est une démarche globale visant à évaluer objectivement l’état nutritionnel. Il inclut l’anamnèse, les examens physiques, les mesures anthropométriques (poids, taille, IMC), les tests fonctionnels, la qualité de vie, l’activité physique et les résultats de laboratoire. En pratique, une évaluation simplifiée peut être réalisée, basée sur le poids, la taille, l’IMC et les paramètres subjectifs qui, selon la littérature, sont corrélés à l’état nutritionnel, tels que l’appétit, l’état général et les performances. Le moyen le plus simple d’enregistrer les paramètres subjectifs est d’utiliser une échelle visuelle analogique, similaire à celle utilisée pour enregistrer la douleur (échelle de 1 à 10).
Plan de nutrition : En accord avec le développement de la médecine personnalisée, le plan alimentaire est toujours adapté aux besoins individuels. Ces besoins dépendent en grande partie de l’état nutritionnel évalué lors de l’évaluation, et sont déterminés par la maladie sous-jacente, l’évolution du poids, l’appétit et l’apport alimentaire actuel. Les problèmes tels que la mastication, l’odynophagie, la dysphagie, la xérostomie, la dysgueusie, la mucosite/soor, la nausée/le vomissement, la constipation/la diarrhée ou la douleur jouent également un rôle important dans le plan alimentaire. D’autres aspects tels que les habitudes alimentaires, les préférences/aversions, la situation psychosociale et l’activité physique doivent être pris en compte. La réalisation d’un protocole alimentaire pendant 3 à 5 jours est très utile pour enregistrer de manière semi-quantitative la quantité d’aliments consommés et connaître en détail les habitudes alimentaires (pour les patients hospitalisés, le modèle du diagramme d’assiette peut également être utilisé). Avant la thérapie nutritionnelle, il convient d’optimiser le traitement médicamenteux, par ex. antiémétique fixe, mesures laxatives, solution de rinçage buccal, substituts salivaires, bloqueurs d’acide, etc.
Besoins en énergie, en protéines et en liquides : la détermination des besoins énergétiques est un point central de l’évaluation nutritionnelle. La consommation totale d’énergie se compose de la consommation d’énergie au repos, de la thermogenèse induite par l’alimentation et de l’énergie dépensée lors de l’activité physique. Les besoins énergétiques totaux peuvent être calculés à l’aide d’une formule spécifique à l’âge, au sexe et au poids, qui prend également en compte les facteurs d’activité et de stress (par exemple, la formule de Harris-Benedict [11]). Dans la pratique quotidienne, il peut être grossièrement estimé par une formule simplifiée basée sur le poids comme suit : 30-35 kcal/kg/jour ; plus 20% pour un NRS 2002 ≥3ou un IMC <20 kg/m2 ; moins 20% pour un IMC >30 kg/m2 [12]. Une alimentation complète et équilibrée chez les patients souffrant de malnutrition doit couvrir 40 à 60% des besoins énergétiques avec des glucides, 10 à 20% avec des protéines et 30 à 40% avec des lipides.
Les besoins en protéines sont généralement de 0,8 g/kg/jour pour les personnes en bonne santé. En cas d’insuffisance rénale chronique, l’apport en protéines doit être réduit à 0,6 g/kg/jour, sauf si une dialyse est pratiquée. Chez les patients âgés (>65 ans) souffrant d’insuffisance rénale chronique, l’apport en protéines est de 0,8 g/kg/jour. En cas de dialyse, les besoins en protéines sont les mêmes qu’en temps normal et il y a en plus un besoin d’environ 20 g de protéines après la dialyse (perte dialytique). Lors d’une paracentèse, les patients perdent environ 10 g de protéines par litre d’ascite [4]. Pour les patients malnutris souffrant de maladies aiguës ou chroniques, les recommandations en matière d’apport protéique sont de 1,0 à 1,5 g/kg/jour [13]. Il n’existe pas de recommandations spécifiques pour les patients polymorbides atteints d’insuffisance rénale chronique. Notre expérience clinique montre que cette population a besoin d’environ 1 g/kg/jour [8]. Un objectif individuel doit être défini pour chaque patient, car d’autres facteurs, tels que l’hypermétabolisme, peuvent modifier les besoins en protéines (par exemple, des facteurs de stress supplémentaires tels qu’une BPCO sous-jacente ou une maladie tumorale).
De manière générale, il convient de veiller à une hydratation suffisante et adaptée aux besoins. Le règlement sur les liquides devrait (i) compenser la perte imperceptible (500-1000 ml), (ii) fournir suffisamment d’eau et d’électrolytes, (iii) maintenir l’état normal des compartiments des fluides corporels ; et (iv) fournir suffisamment d’eau pour permettre aux reins d’éliminer les déchets (500-1500 ml). Les besoins moyens sont de 30-35 ml d’eau/kg/jour, 1 mmol de sodium/kg/jour et 1 mmol de potassium/kg/jour. La valeur indicative pour l’apport total en eau est >2 litres par jour (environ 1,1 ml d’eau par kcal), dont environ 1,4 litre devrait être consommé sous forme de boissons. Dans le cas d’indications spécifiques, il est possible de s’écarter de cette valeur de référence pour les quantités de boisson, qui seront déterminées par le médecin [14]. Les causes d’un manque de liquide ou d’une déshydratation sont multiples et reposent généralement sur une consommation de liquide trop faible associée à une perte de liquide trop importante. Les étiologies les plus fréquentes sont les maladies accompagnées de diarrhées, de vomissements ou de fièvre (pour chaque degré supérieur à 37 °C, le corps a besoin d’environ 300 ml de liquide supplémentaire par jour), la prise de diurétiques ou de laxatifs, les troubles de la déglutition, la diminution de la sensation de soif, les températures extérieures très chaudes et le travail ou le sport physiquement exigeant (besoin supplémentaire de 0,5 à 1,0 litre d’eau par heure d’activité intense). Toute prescription de liquide doit couvrir non seulement les besoins d’entretien quotidiens, mais aussi les pertes anormales. En cas de pertes du tractus gastro-intestinal, par exemple à la suite d’une fistule ou d’une aspiration nasogastrique, la prescription de liquides doit inclure les besoins quotidiens d’entretien plus un remplacement équivalent de l’eau et des électrolytes.
Besoins en micronutriments : chez les patients polymorbides souffrant de malnutrition, les besoins en micronutriments peuvent être accrus en raison d’une réduction de l’apport alimentaire ou de la maladie. Les micronutriments doivent être supplémentés et/ou substitués en fonction des apports journaliers recommandés. Les besoins quotidiens en micronutriments sont considérés comme couverts si la nutrition entérale par sonde est d’au moins 1500 mL par jour. Les vitamines et les oligo-éléments ne sont pas contenus dans les solutions nutritives parentérales et doivent être apportés en complément [4].
Les cinq étapes de la thérapie nutritionnelle (Fig. 4) : La première étape consiste à informer les patients sur l’alimentation riche en énergie et en protéines ainsi que sur le rythme des repas (repas fréquents tout au long de la journée), à aborder les éventuels problèmes qui empêchent un apport alimentaire adéquat et à évaluer les mesures d’optimisation. L’alimentation orale avec des aliments naturels riches en énergie et en protéines devrait être le premier choix de la thérapie nutritionnelle. Elle comprend des adaptations de la nature des aliments (température, goût, consistance, couleur), des préférences individuelles, le choix d’aliments peu odorants, l’adaptation de la taille des portions ainsi que la préparation douce des repas et l’utilisation d’accessoires (cuillère, tasse, tétine, etc.). En outre, les repas peuvent être enrichis avec des aliments naturels tels que de l’huile végétale de qualité, du beurre, de la crème, du fromage blanc, du fromage râpé, des œufs ou des produits spéciaux tels que des protéines ou des hydrates de carbone en poudre (maltodrextrine). Des collations à haute densité énergétique (par ex. milk-shakes maison, canapés, crèmes) peuvent également être intégrées au programme quotidien.
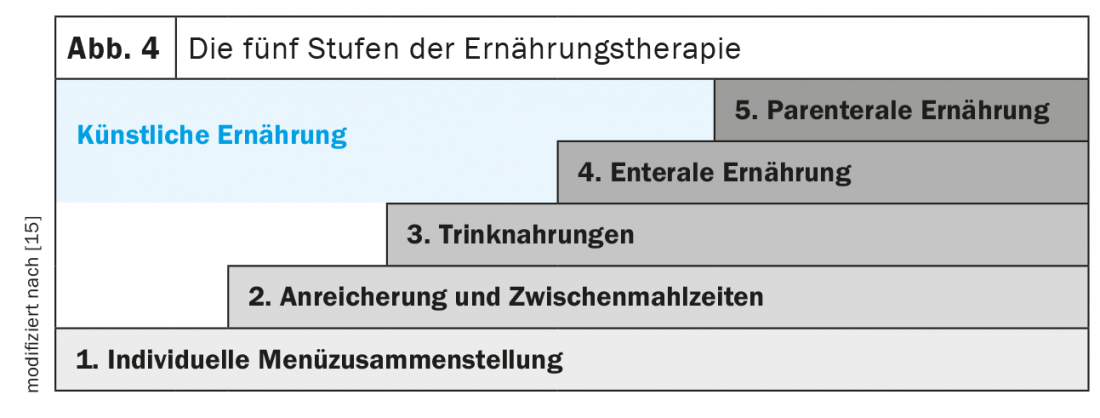
L’étape suivante est l’administration de formules d’alimentation buvable commerciales entièrement équilibrées qui peuvent être servies de manière attrayante et créative. Dès 1990, l’étude de Delmi et al. ont démontré que l’administration d’une alimentation buvable entièrement équilibrée (20 g de protéines, 254 kcal) le soir à des patients gériatriques souffrant d’une fracture du col du fémur augmentait l’apport énergétique de 23% et l’apport en protéines de 62%. Cette intervention a permis de réduire significativement le taux de complications, la durée de séjour dans les hôpitaux et les unités de rééducation, ainsi que la mortalité [16]. D’autres études ont montré que l’administration complémentaire d’une alimentation buvable en guise de collation ne réduisait pas l’appétit, mais entraînait une augmentation significative de l’apport total en énergie et en protéines. Plusieurs études et méta-analyses ont montré que l’hydratation permettait de maintenir la masse musculaire et d’améliorer la qualité de vie, tout en réduisant de manière significative les taux de complications, de mortalité et de réhospitalisation [7,8,17–21]. Dans l’ensemble, plusieurs études, principalement basées sur des analyses de coûts rétrospectives, indiquent que l’utilisation de formules d’alimentation buvable dans le secteur ambulatoire apporte un avantage en termes de coûts globaux. Ceci est souvent associé à des résultats cliniquement pertinents, ce qui indique un rapport coût-efficacité [22].
Si l’alimentation orale est insuffisante (<75% des besoins en énergie et en protéines) ou impossible, une alimentation entérale et éventuellement parentérale doit être envisagée. La nutrition entérale est préférable chez les patients dont le tractus gastro-intestinal est partiellement fonctionnel, en raison du risque réduit de complications infectieuses et non infectieuses. Les deux formes de nutrition artificielle et invasive devraient être complémentaires et non concurrentielles. En l’absence de besoins spécifiques, il est recommandé de commencer par une alimentation par sonde standard ou une solution nutritive. Pour les deux types d’alimentation, il existe, si nécessaire, un large choix de produits plus spécifiques.
L’apport énergétique et protéique devrait être évalué environ 2 à 3 fois par semaine chez les patients atteints de maladies aiguës, en fonction des ressources en personnel disponibles, et toutes les deux à quatre semaines chez les patients atteints de maladies chroniques dans le cadre d’une réévaluation au cabinet du médecin généraliste. En fonction de l’évolution, d’autres objectifs et interventions nutritionnels doivent être définis et, le cas échéant, d’autres mesures thérapeutiques doivent être prises. Le contact régulier entre le médecin et le patient et les contacts avec les diététiciens ou les infirmières de pratique avancée offrent une bonne occasion de vérifier les recommandations thérapeutiques et d’améliorer leur application.
Nutrition pour des états pathologiques spécifiques : chez les patients souffrant d’insuffisance rénale, les apports en potassium et en phosphate doivent souvent être limités. Les patients souffrant d’insuffisance cardiaque peuvent, dans certains cas, bénéficier d’une restriction en sodium et en eau ou d’une administration régulière de thiamine et de fer. Il existe de faibles preuves de l’utilisation de suppléments nutritionnels oraux spécifiques ou de solutions nutritives entérales chez les patients hospitalisés polymorbides. L’arginine, la glutamine et le bêta-hydroxy-bêta-méthylbutyrate (HMB) peuvent être utilisés chez les patients souffrant d’escarres. Un mélange de fibres solubles et insolubles peut être utilisé chez les patients atteints de maladies chroniques qui reçoivent une alimentation entérale et souffrent de diarrhée ou de constipation, les complications les plus fréquentes de l’alimentation entérale. Une attention particulière doit être accordée à l’état d’hydratation, car la déshydratation peut entraîner une constipation [4].
Moment de la thérapie nutritionnelle : le début précoce de la thérapie nutritionnelle (à l’hôpital, dans les 48 heures suivant l’admission) est recommandé afin d’éviter une détérioration de l’état nutritionnel et fonctionnel ainsi qu’une sarcopénie. Bien que la durée optimale de la thérapie nutritionnelle ne soit pas encore claire, il est recommandé, selon les connaissances actuelles, de poursuivre le traitement au-delà de la sortie de l’hôpital [13].
Contrôle de la thérapie nutritionnelle : les équipes de nutrition clinique expérimentées (en milieu hospitalier) et les diététiciens ou les infirmières de pratique avancée (en milieu ambulatoire) doivent évaluer régulièrement l’indication, la voie d’administration, les risques, les bénéfices et les objectifs de la thérapie nutritionnelle. La durée de cet intervalle dépend du patient et des paramètres à surveiller (par ex. paramètres nutritionnels, anthropométriques, biochimiques, état clinique) et peut s’allonger si l’état du patient s’améliore sous le traitement nutritionnel. Par exemple, il est recommandé de surveiller les apports nutritionnels par voie orale, entérale ou parentérale en milieu hospitalier ou lors de l’initiation d’un traitement artificiel, quotidiennement au début, puis deux fois par semaine lorsque l’état est stable (par exemple, en cas de risque élevé de développer un syndrome de réalimentation). De la même manière, les paramètres de laboratoire (par ex. potassium, magnésium, phosphate, sodium, urée, créatinine) doivent être surveillés quotidiennement au début, puis 1 à 2 fois par semaine. En plus des paramètres utilisés pour surveiller la réponse au traitement nutritionnel, des indices fonctionnels (par exemple, la force de fermeture du poing) doivent être régulièrement recueillis pour évaluer d’autres résultats cliniques (par exemple, la survie, la qualité de vie) [4]. Les intervalles de contrôle de l’évolution dans le secteur ambulatoire sont nettement plus longs que dans le secteur hospitalier.
Sensibilisation à la prévention, à l’identification et au traitement de la malnutrition
La ME doit être plus souvent abordée dans la formation initiale et continue du personnel médical, tant à l’hôpital qu’en ambulatoire. La sensibilisation à la ME doit être accrue et la prise en charge nutritionnelle doit être considérée comme faisant partie du traitement médical multimodal. L’EM est encore trop souvent non identifié, sous-diagnostiqué et, par conséquent, non traité.
Des protocoles et des responsabilités clairement définis sont nécessaires pour aborder ce problème dans le domaine hospitalier (à l’entrée de l’hôpital) et ambulatoire (lors des premières consultations/consultations de suivi). Cela commence par l’introduction d’un dépistage nutritionnel systématique, suivi d’une évaluation nutritionnelle rapide et simple chez les patients à risque. Une étude récente a montré qu’environ 80% des hôpitaux et des maisons de soins en Suisse n’ont pas mis en place de procédure de dépistage systématique du risque d’EM et que seuls 25% d’entre eux dépistent les patients lorsqu’ils soupçonnent un problème. De plus, 56% des établissements surveillent la prise alimentaire et 50% surveillent et documentent l’état nutritionnel de leurs patients [23].
L’étiologie de l’EM étant souvent multifactorielle (de la dépression au manque d’appétit en passant par l’incapacité à s’alimenter seul), il convient d’assurer une communication et une collaboration optimales entre l’équipe soignante hospitalière, l’équipe soignante/le réseau ambulatoire (médecin généraliste, soins à domicile, service de soins à domicile, diététicien, etc. Les problèmes potentiels peuvent ainsi être traités de manière efficace et efficiente.
L’EM est également un problème fréquent dans le secteur ambulatoire. Le rôle des médecins généralistes et des infirmières de pratique avancée, des spécialistes libéraux, des diététiciens et des infirmières est essentiel pour détecter les signes de l’EM à un stade précoce (NRS 2002 pré-dépistage/dépistage) et pour traiter de manière adéquate. La thérapie nutritionnelle est généralement initiée pendant l’hospitalisation et poursuivie en ambulatoire, avec un suivi régulier. L’étude de suivi “Effect of Nutritional Therapy on Frailty, Functional Outcomes and Recovery of Undernourished Medical Patients at Discharge Trial” (EFFORT II) est maintenant planifiée dans le domaine ambulatoire sur la base de la longue expérience clinique et des connaissances acquises dans le cadre de l’étude EFFORT – une étude suisse. à l’initiative de l’investigateur, essai contrôlé randomisé multicentrique non commercial qui débutera au second semestre 2021. L’objectif général de cette étude est de démontrer l’avantage durable d’une thérapie nutritionnelle individualisée à domicile en termes de mortalité, de complications graves, de réhospitalisations non électives et de fonctionnalité selon un algorithme de mise en œuvre par rapport à l’alimentation habituelle chez les patients malnutris polymorbides.
Conclusion
Une thérapie nutritionnelle appropriée et individualisée s’est avérée être une option de traitement très efficace dans la prévention et le traitement de l’EM. Elle réduit de manière significative les taux de morbidité et de mortalité. En outre, elle améliore considérablement la qualité de vie et la fonctionnalité physique. Compte tenu de la complexité de l’EM et afin d’obtenir un succès thérapeutique à long terme des interventions nutritionnelles, des mesures supplémentaires telles que l’activité physique et un soutien psychologique régulier doivent être intégrées dans le cadre d’une approche thérapeutique multimodale. Lors des contacts réguliers avec les patients, il convient de poser des questions sur les problèmes alimentaires et de recueillir des données anthropométriques simples. Il est important d’intégrer dans la pratique clinique les nouvelles connaissances qui vous ont été présentées dans cet aperçu afin de garantir que les patients reçoivent des soins optimaux, de qualité et sûrs.
Messages Take-Home
- La malnutrition est fréquente et associée à un taux de morbidité et de mortalité plus élevé.
- Il est crucial d’identifier rapidement les patients malnutris à l’aide d’un outil de dépistage simple (NRS 2002).
- La thérapie nutritionnelle doit être planifiée, mise en œuvre, surveillée et ajustée régulièrement.
- Des interventions nutritionnelles ciblées et adéquates sont efficaces et réduisent le taux de complications et de mortalité.
- Une gestion efficace de la nutrition permet d’atteindre les objectifs et d’assurer une qualité de traitement élevée.
Littérature :
- de van der Schueren MAE, Soeters PB, Reijven PLM, et al : Diagnostic de la malnutrition – Dépistage et évaluation. In : Sobotka L, Allison SP, Forbes A, Meier RF, Schneider SM, Soeters PB, et al : Basics in Clinical Nutrition. 5 ed. Prague : Galén 2019 ; 18-27.
- Schindlegger W : Causes de l’anorexie chez les personnes âgées. Journal de médecine nutritionnelle (édition pour la Suisse) 2001 ; 3(3) : 20-23.
- Guigoz Y : The Mini Nutritional Assessment (MNA) review of the literature – What does it tell us ? The journal of nutrition, health & aging 2006 ; 10(6) : 466-485 ; discussion 85-87.
- Reber E, Gomes F, Bally L, et al : Nutritional Management of Medical Inpatients. Journal of clinical medicine 2019 ; 8(8).
- Gomes F, Baumgartner A, Bounoure L, et al : Association of Nutritional Support With Clinical Outcomes Among Medical Inpatients Who Are Malnourished or at Nutritional Risk : An Updated Systematic Review and Meta-analysis. JAMA network open 2019 ; 2(11) : e1915138.
- Estruch R, Ros E, Salas-Salvado J, et al. : Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. The New England journal of medicine 2018 ; 378(25) : e34.
- Deutz NE, Matheson EM, Matarese LE, et al : Readmission and mortality in malnourished, older, hospitalized adults treated with a specialized oral nutritional supplement : A randomized clinical trial. Clinical nutrition 2016 ; 35(1) : 18-26.
- Schuetz P, Fehr R, Baechli V, et al : Individualized nutritional support in medical inpatients at nutritional risk : a randomized clinical trial. Lancet 2019 ; 393(1088) : 2312-2321.
- Kondrup J, Allison SP, Elia M, et al : ESPEN guidelines for nutrition screening 2002. Clinical nutrition 2003 ; 22(4) : 415-421.
- Kondrup J, Rasmussen HH, Hamberg O, Stanga Z : Nutritional risk screening (NRS 2002) : a new method based on an analysis of controlled clinical trials. Clinical nutrition 2003 ; 22(3) : 321-336.
- Harris JA, Benedict FG : Une étude biométrique du métabolisme basal humain. Proceedings of the National Academy of Sciences of the United States of America 1918 ; 4(12) : 370-373.
- Reber E, Strahm R, Bally L, et al. : Efficacité et efficience des équipes de soutien nutritionnel. Journal of clinical medicine 2019 ; 8(9).
- Gomes F, Schuetz P, Bounoure L, et al : ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clinical nutrition 2018 ; 37(1) : 336-353.
- Padhi S, Bullock I, Li L, Stroud M : Traitement par fluides intraveineux pour adultes en milieu hospitalier : résumé des directives du NICE. BMJ 2013 ; 347 : f7073.
- Aubry E, Mareschal J, Gschweitl M, et al : Faits sur la gestion de la nutrition clinique – une enquête en ligne. Médecine nutritionnelle actuelle 2018 ; 42(06) : 452-460.
- Delmi M, Rapin CH, Bengoa JM, et al : Dietary supplementation in elderly patients with fractured neck of the femur. Lancet 1990 ; 335(8696) : 1013-1016.
- Norman K, Pirlich M, Smoliner C, et al : Cost-effectiveness of a 3-month intervention with oral nutritional supplements in disease-related malnutrition : a randomised controlled pilot study. European journal of clinical nutrition 2011 ; 65(6) : 735-742.
- Stratton RJ, Elia M : Une revue des revues : A new look at the evidence for oral nutritional supplements in clinical practice. Nutrition clinique 2007 ; 2(1) : 5-23.
- National Institute for Health and Care Excellence. Nutrition support for adults : oral nutrition support, enteral tube feeding and parenteral nutrition (CG32)2006 ; last updated 2017.
- Chew STH, Tan NC, Cheong M, et al : Impact de la supplémentation nutritionnelle orale spécialisée sur les résultats cliniques, nutritionnels et fonctionnels : A randomized, placebo-controlled trial in community-dwelling older adults at risk of malnutrition. Clinical nutrition 2020.
- Milne AC, Avenell A, Potter J : Meta-analysis : protein and energy supplementation in older people. Annals of internal medicine 2006 ; 144(1) : 37-48.
- Elia M, Normand C, Laviano A, Norman K : A systematic review of the cost and cost effectiveness of using standard oral nutritional supplements in community and care home settings. Clinical nutrition 2016 ; 35(1) : 125-137.
CARDIOVASC 2021 ; 20(3) : 6-12