Le traitement de la sclérose en plaques, maladie auto-immune du système nerveux central la plus invalidante chez les jeunes adultes, a connu de nombreuses avancées, petites et grandes, au cours des deux dernières décennies. Le paysage thérapeutique a considérablement évolué, de sorte qu’il existe désormais différentes options thérapeutiques avec différents mécanismes d’action.
A ce jour, malgré de nombreux progrès thérapeutiques, la sclérose en plaques ne peut pas être guérie, mais elle peut souvent être contrôlée. Le traitement de la maladie auto-immune du système nerveux central, la plus invalidante chez les jeunes adultes, a connu de nombreux progrès, petits et grands, au cours des deux dernières décennies, et le paysage thérapeutique a considérablement évolué, de sorte qu’il existe aujourd’hui différentes options thérapeutiques avec différents mécanismes d’action. Cela permet de mieux prendre en compte l’hétérogénéité de la maladie et les caractéristiques et besoins de chaque patient.
Depuis fin 2020, un nouveau médicament a été autorisé en Suisse pour le traitement de la sclérose en plaques récurrente-rémittente (SEPR). Cet article de FMC se penche plus en détail sur ce médicament. Il s’agit de l’ozanimod, un modulateur sélectif du récepteur de la sphingosine-1-phosphate (S1P) qui se lie spécifiquement aux sous-types 1 et 5 du récepteur S1P. Les lymphocytes sont ainsi retenus en périphérie et ne peuvent plus intervenir dans le processus inflammatoire du système nerveux central (SNC) ; de plus, des mécanismes d’action supplémentaires sont potentiellement envisageables dans le SNC. Le produit est autorisé en Suisse en tant que traitement de première ligne chez les patients adultes atteints de RRMS.
Le mécanisme d’action de l’ozanimod en bref
Dans la SEP, l’entrée de certaines cellules inflammatoires dans le système nerveux central (SNC) via certaines barrières est un point central sur lequel l’ozanimod peut agir. L’ozanimod, en tant que modulateur sélectif du récepteur de la sphingosine-1-phosphate (S1P), retient ces cellules inflammatoires dans les organes lymphatiques secondaires (comme les ganglions lymphatiques ou la rate). La liaison de l’ozanimod aux récepteurs S1P sur les lymphocytes immatures entraîne l’activation et l’internalisation de ces récepteurs. En conséquence, la sortie des lymphocytes des ganglions lymphatiques dans la circulation sanguine est inhibée, ce qui réduit le nombre de lymphocytes dans le sang et les empêche d’intervenir dans le processus inflammatoire du SNC. D’autres mécanismes d’action directe sur le SNC, par exemple sur la fonction des cellules gliales, sont également envisageables.
Différence avec les autres modulateurs de récepteurs S1P
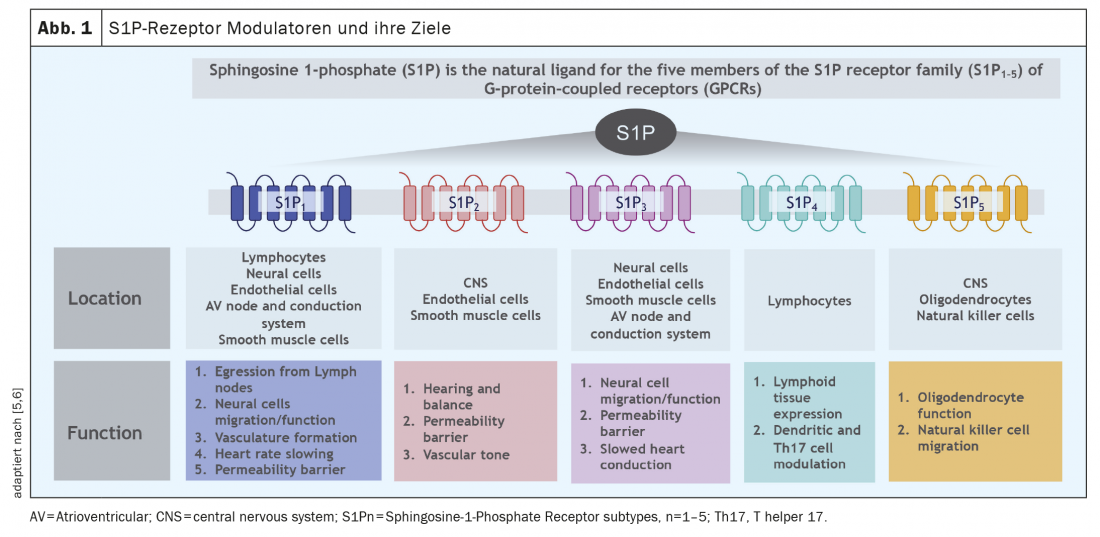
Outre l’ozanimod, il existe deux autres modulateurs du récepteur S1P dans le paysage thérapeutique suisse de la SEP : Fingolimod et Siponimod. Une caractéristique commune de ces substances est la liaison aux récepteurs S1P, avec une sélectivité différente pour chaque sous-type de récepteur selon la substance. Alors que l’ozanimod se lie de manière très sélective à la sous-famille des récepteurs S1P1 et S1P5, le fingolimod ne se lie pas de manière sélective à deux récepteurs sélectionnés, mais de manière plus non spécifique aux 5 sous-types de récepteurs S1P, au récepteur S1P2 avec une faible affinité (voir ci-dessous). Cependant, les sous-types de récepteurs S1P sont exprimés différemment selon les cellules et les tissus, et la figure 1 donne un aperçu de la répartition de ces récepteurs. En résumé, les récepteurs S1P1 se trouvent principalement sur les lymphocytes, tandis que le récepteur S1P5 est principalement exprimé dans le SNC. Ainsi, une liaison sélective à ces sous-types de récepteurs a également un sens sur le plan physiopathologique. Le siponimod, comme l’ozanimod, se lie sélectivement aux récepteurs S1P1 et S1P5, mais les médicaments diffèrent en termes de pharmacocinétique (l’ozanimod est en grande partie dégradé en 2 métabolites actifs en quelques heures) et peut-être aussi en termes de sélectivité pour les sous-types de récepteurs, car l’ozanimod se lie sélectivement in vitro avec une grande affinité, en particulier aux récepteurs S1P1 et moins aux récepteurs S1P5 [1].
Critères d’évaluation d’un traitement efficace de la SEP
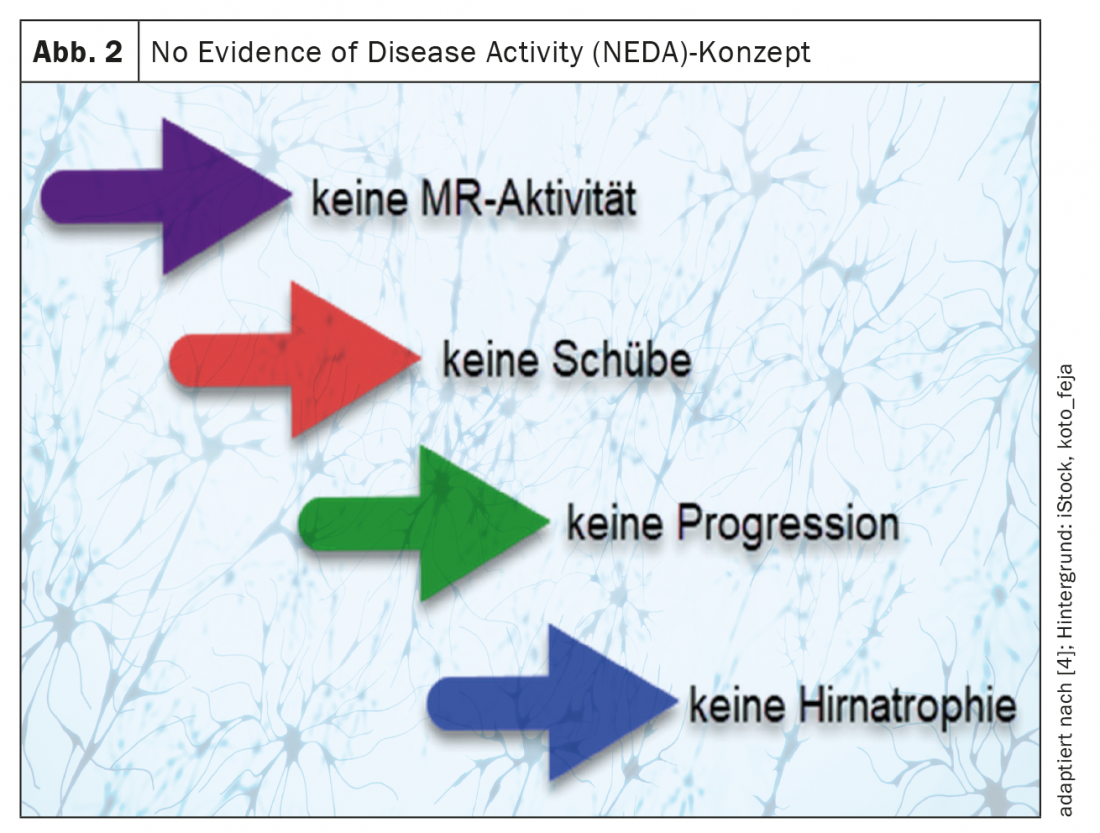
Aujourd’hui, grâce à des immunothérapies efficaces, il est possible de fixer des objectifs thérapeutiques plus élevés que ceux anticipés il y a quelques décennies. Le concept “No Evidence of Disease Activity” (NEDA) est un concept courant, en particulier dans les essais thérapeutiques [2,3].
Dans ce contexte, les
- pas d’activité RM (lésions hyperintenses T2 nouvelles et/ou en cours d’agrandissement et/ou lésions prenant le contraste T1),
- aucun événement de poussée,
- pas de progression insidieuse sur l’échelle EDSS (Expanded Disability Status Scale) (“NEDA3”) [2–4] et souvent aussi
- aucune atrophie cérébrale n’est définie comme objectif thérapeutique (“NEDA 4”) (Fig. 2) [2– 5].
Cependant, en raison de difficultés méthodologiques et techniques, la mesure quantitative de l’atrophie cérébrale n’est pas encore pratiquée de manière régulière en pratique clinique quotidienne [10,11]. En outre, le concept NEDA 3 est principalement motivé par l’activité d’imagerie, ce qui doit être considéré de manière critique d’un point de vue clinique. Dans la pratique clinique quotidienne, l’accent a été mis jusqu’à présent sur les critères d’évaluation qui peuvent être régulièrement objectivés sans grand effort, comme l’EDSS, mais des aspects tels que la cognition ou la fatigue font l’objet d’une attention accrue. L’IRM (crânienne) est de plus en plus utilisée comme instrument sensible pour l’évaluation de l’efficacité et de la sécurité. A moyen terme, la mesure quantitative de l’atrophie cérébrale (par exemple grâce à la segmentation automatisée de parties du cerveau par “machine learing”) fera probablement son entrée dans la pratique clinique quotidienne [11].
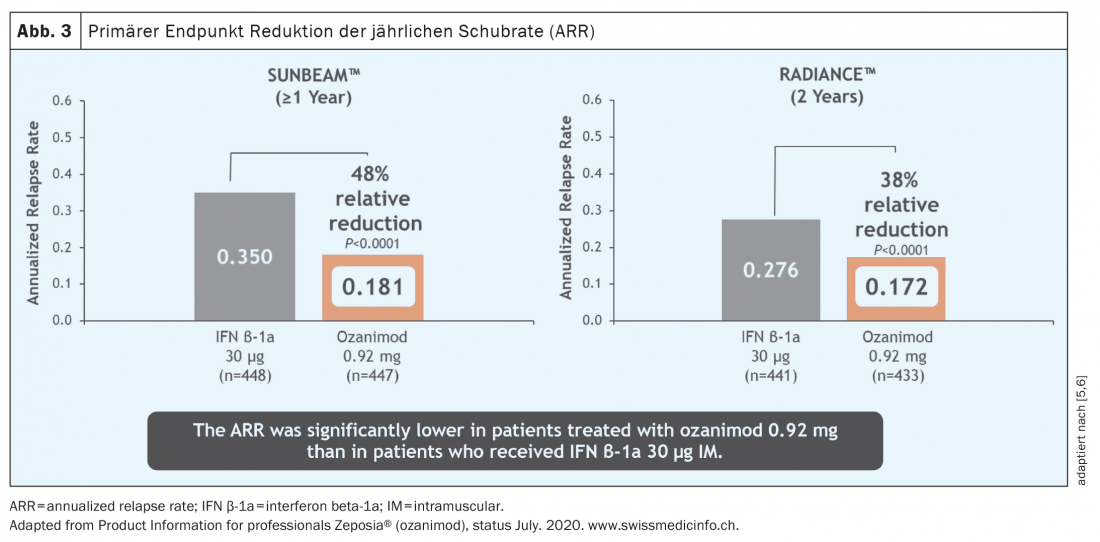
En ce qui concerne les données d’études, la qualité des études est également importante. Pour l’ozanimod, par exemple, deux grandes études différentes ont été menées en parallèle. Si, comme dans le cas de l’ozanimod, les deux études aboutissent essentiellement aux mêmes conclusions, on peut supposer que les études sont robustes. Les deux études pertinentes pour l’autorisation de mise sur le marché, RADIANCE [5] et SUNBEAM [6], sont des études de phase 3 multicentriques, en double aveugle et à double insu, qui comparent l’ozanimod à l’interféron bêta1a, un comparateur actif, et se distinguent principalement par une durée d’observation différente, de 24 et 12 mois respectivement.
Efficacité de l’ozanimod
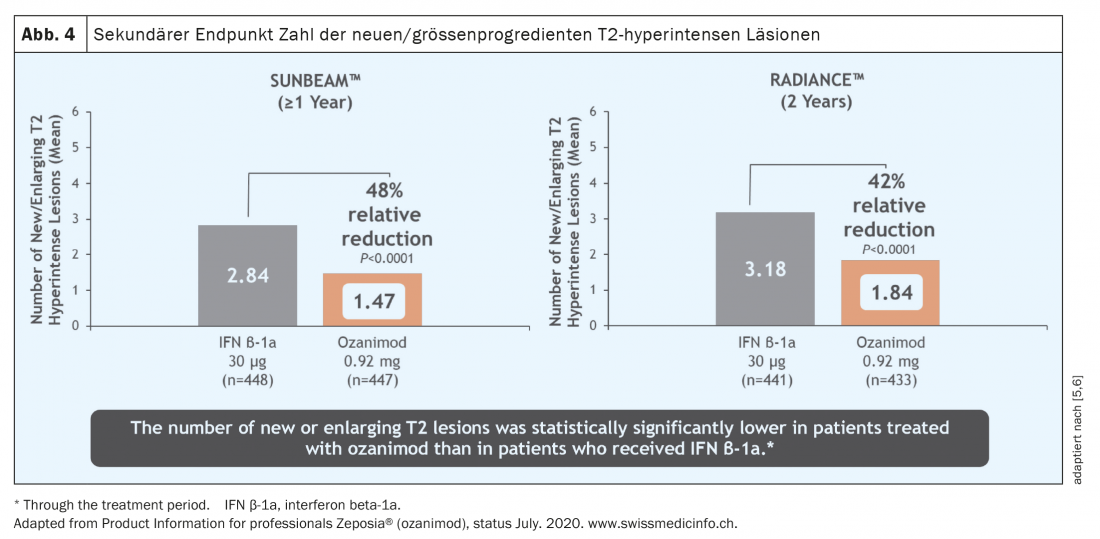
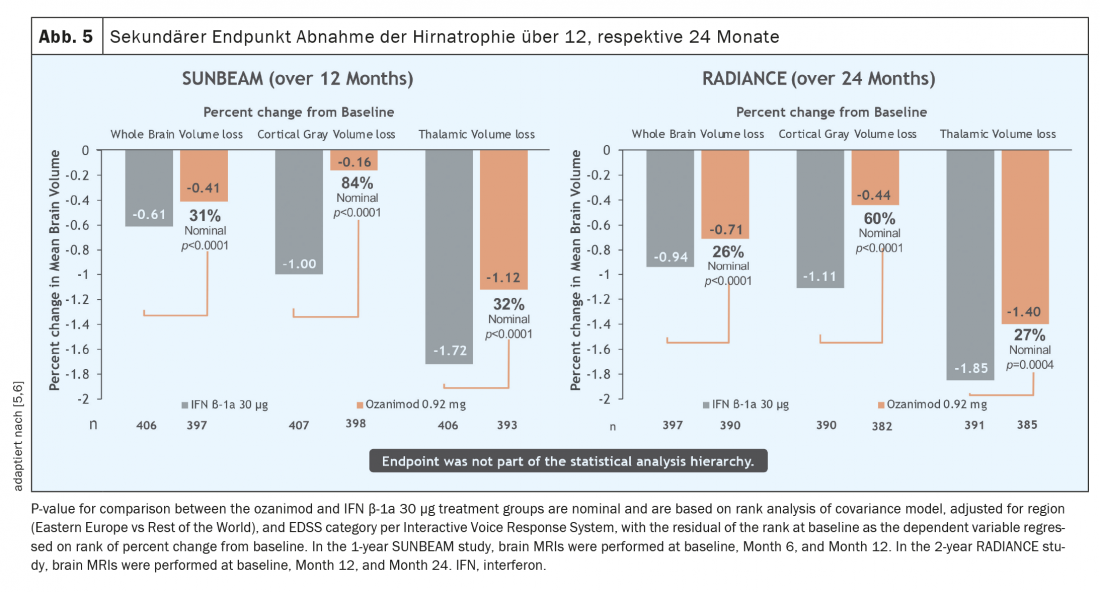
Sur une période d’un an et de deux ans, le taux de poussées a pu être réduit de manière significative chez un groupe de patients actifs avant le début du traitement ( fig. 3) [5 – 7]. Il faut souligner que dans ces études, l’ozanimod n’a pas été testé contre un placebo, mais contre un comparateur actif (interféron bêta-1A Avonex®), ce qui met en évidence l’efficacité clinique de l’ozanimod. En outre, une réduction significative de l’activité inflammatoire détectable par IRM a été observée (figure 4). Cependant, aucun effet sur la progression du handicap n’a pu être démontré sur la durée relativement courte de l’étude (12 ou 24 mois). Les premières données IRM des deux études ont cependant montré un effet en termes d’atrophie cérébrale globale, d’atrophie du thalamus et d’atrophie corticale (Fig. 5). Chez les patients traités par l’ozanimod, on a également observé une vitesse de traitement cognitif plus rapide que dans le groupe de comparaison, ce qui donne les premières indications d’un possible effet positif également sur les critères cognitifs. Les études d’enregistrement de l’ozanimod ont donc inclus, outre les critères d’évaluation “classiques” tels que la charge des lésions T2 et les événements liés aux poussées, des critères d’évaluation “plus récents” tels que la cognition et l’atrophie. Il convient toutefois de noter que dans ces études, la mesure de l’atrophie n’était qu’un critère secondaire et la vitesse de traitement cognitif un critère exploratoire, de sorte que ces résultats doivent être considérés avec certaines réserves. Dans ce domaine, les données à long terme permettront d’obtenir des résultats plus précis.
Effets secondaires
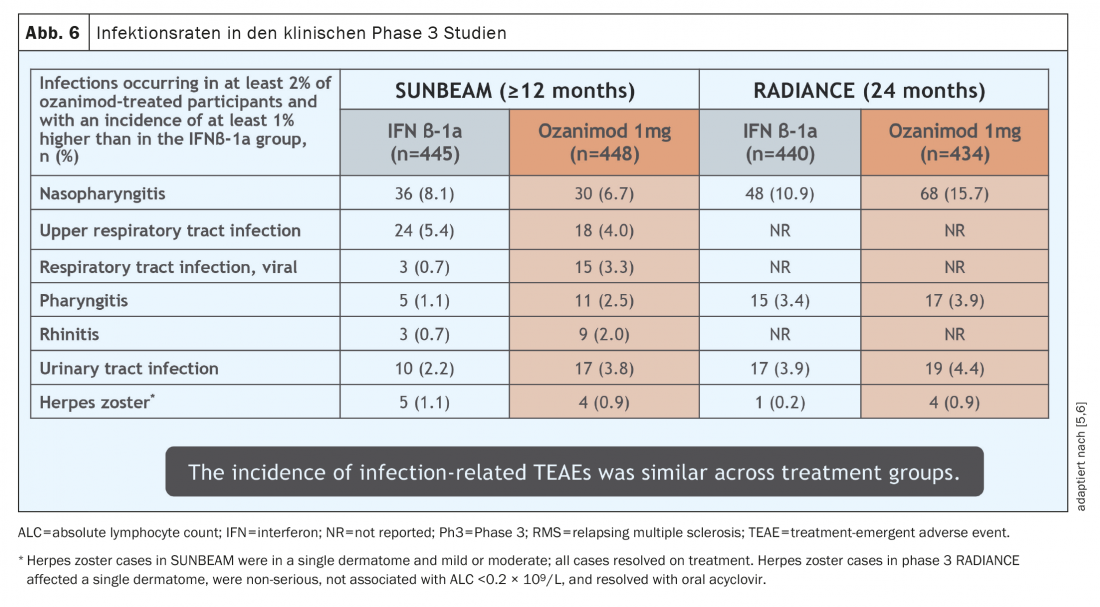
Les effets indésirables survenus lors de la prise d’ozanimod au cours des études pivotales étaient globalement similaires à ceux observés avec d’autres substances adressant la SP1 déjà présentes sur le marché depuis de nombreuses années. L’effet secondaire le plus fréquent a été une légère augmentation des infections des voies respiratoires et urinaires (figure 6). Ces infections ont toutes eu une évolution bénigne. Dans quelques cas (0,1- 0,3%), un œdème maculaire est apparu chez des patients à risque élevé ayant des antécédents médicaux (uvéite, diabète sucré ou maladies rétiniennes sous-jacentes/concomitantes) et un zona a été observé chez 0,6% des patients. Selon le mécanisme d’action, la réduction des lymphocytes dans le sang périphérique est d’environ 45 à 50%, ce qui ne constitue pas un effet secondaire en soi en raison du mécanisme d’action de l’ozanimod avec rétention des lymphocytes dans les organes lymphatiques secondaires. 2,5 à 4,2% des patients ont présenté une lymphopénie transitoire de grade 4 selon la CTCAE dans les études d’enregistrement (<0,2 G/l), mais qui n’étaient pas associées à une augmentation des infections et n’ont pas entraîné l’arrêt du traitement. Il n’y a pas encore de signal en direction des maladies opportunistes, mais des données plus nombreuses et plus longues sont nécessaires pour une évaluation plus approfondie. Il est important de noter que dans les études d’enregistrement, 5 à 6% des patients ont présenté des paramètres hépatiques élevés (définis comme >3× la valeur normale supérieure), ce qui a nécessité l’arrêt du traitement chez 1,1% des patients [5,6]. Il convient de noter qu’aucun de ces cas n’a jusqu’à présent satisfait à la loi de Hy, qui décrit la probabilité qu’une insuffisance hépatique puisse être attribuée à un médicament spécifique [12].
Pour minimiser les effets secondaires cardiaques, l’ozanimod est administré par paliers sur 7 jours. Dans les études d’enregistrement, 2 patients (0,5%) ont présenté une tachycardie sinusale et un patient (0,2%) une bradycardie sinusale, ce qui a entraîné l’arrêt du traitement chez un patient (0,2%).
Contre-indications de l’Ozanimod
Les contre-indications suivantes doivent être prises en compte avant de commencer le traitement par l’ozanimod [adaptiert nach 8,9]:
- hypersensibilité à l’ozanimod ou à l’un des autres ingrédients
- Au cours des 6 derniers mois : Infarctus du myocarde, angine de poitrine instable, accident vasculaire cérébral, accident ischémique transitoire, insuffisance cardiaque décompensée nécessitant une hospitalisation ou classe III/IV
- Antécédents ou présence actuelle d’un bloc auriculo-ventriculaire (AV) du deuxième degré (type II) ou d’un bloc AV du troisième degré ou d’un syndrome du nœud sinusal (exception : présence d’un stimulateur cardiaque fonctionnel)
- Apnée du sommeil sévère non traitée
- État d’immunodéficience
- Risque accru d’infections opportunistes, y compris pour les patients sous traitement immunosuppresseur ou immunodéprimés.
- Infections actives graves ou infections chroniques actives (par ex. hépatite, tuberculose)
- Maladie maligne active
- Insuffisance hépatique sévère (classe C de Child-Pugh)
- Œdème maculaire existant
- Grossesse
Autres aspects de la sécurité [adaptiert nach 7,8]
Les études pivots excluant les patients ayant reçu un traitement immunosuppresseur préalable (fingolimod, natalizumab, alemtuzumab, cladribine, ocrelizumab, cyclophosphamide, mitoxantrone, irradiation corporelle totale et greffe de moelle osseuse), l’ozanimod doit être utilisé avec précaution chez ces patients.
Lors de l’arrêt du traitement par l’ozanimod, la possibilité d’une aggravation grave de la maladie doit être prise en compte, car cela a été rapporté dans jusqu’à 10% des cas après l’arrêt d’un autre modulateur du récepteur S1P [13]. Cependant, on ne sait pas si cela s’applique également à l’ozanimod, qui a un profil de récepteur et une pharmacocinétique différents.
Il est également important d’éviter la comédication d’ozanimod avec des inhibiteurs de la BCRP (Breast Cancer Resistance Protein) (comme la ciclosporine), des inhibiteurs de la MAO (monoamine oxydase) (comme la sélégiline) et des inducteurs (comme la rifampicine) et des inhibiteurs (comme le gemfibrozil) du CYP2C8 (cytochrome P2C8).
Chez les femmes en âge de procréer, une grossesse doit être exclue avant le début du traitement et une contraception efficace doit être utilisée pendant le traitement par Zeposia et pendant 3 mois après l’arrêt du traitement par Zeposia.
Surveillance avant et pendant le traitement par l’ozanimod [adaptiert nach 8,9]
Avant de commencer le traitement, tous les patients doivent subir un contrôle des paramètres hépatiques et un hémogramme différentiel. Chez les femmes en âge de procréer, une grossesse doit également être exclue et une contraception sûre doit être mise en place (indiquée jusqu’à 3 mois après l’arrêt du traitement).
En outre, le statut vaccinal de tous les patients doit être mis à jour. Les patients sans antécédents de varicelle confirmés par un médecin et sans vaccination complète contre le VZV doivent être soumis à un test de détection des anticorps contre le VZV et, en l’absence de détection, être vaccinés (attention : vaccin vivant ; la vaccination doit être terminée au moins un mois avant le début du traitement). Il n’existe pas de données cliniques concernant la sécurité et l’efficacité des vaccinations sous traitement par ozanimod. En ce qui concerne les maladies et les vaccins COVID, malgré les préoccupations théoriques liées au mécanisme d’action, il n’existe à ce jour aucun signal de sécurité spécifique concernant l’ozanimod [14]. Selon les directives suisses et internationales, la vaccination contre le COVID est recommandée chez les patients sous ozanimod [15,16]. Les vaccins vivants atténués doivent être évités pendant et jusqu’à 3 mois après le traitement par l’ozanimod et doivent être terminés au moins 1 mois avant le début du traitement.
Avant le début du traitement, tous les patients doivent également subir un ECG afin de détecter un éventuel trouble de la conduction. Lors de l’initiation du traitement, un monitorage cardiaque de six heures avec ECG doit être effectué chez certains patients à risque cardiaque. Ceci est recommandé chez les patients présentant une FC au repos <55 spm, un bloc AV du 2e degré [Mobitz Typ I] ou un état stable. Infarctus du myocarde avant >6 mois ou insuffisance cardiaque indiquée. De plus, chez les patients atteints de st. n. En cas d’arrêt cardiaque, d’événements cérébrovasculaires survenus avant >6 mois, d’hypertension non contrôlée, de syncopes récurrentes et de bradycardie symptomatique, d’allongement significatif de l’intervalle QTc ou de traitement par des antiarythmiques, il convient de procéder à une co-évaluation cardiologique afin de déterminer si un traitement par ozanimod peut être instauré et comment la surveillance doit être organisée. Pour tous les autres patients, contrairement au fingolimod, il n’est plus nécessaire de procéder à un monitorage cardiaque pendant six heures. Un contrôle régulier de la pression artérielle est toutefois recommandé chez tous les patients sous traitement.
En outre, un contrôle des tests de la fonction hépatique est indiqué avant le début du traitement et, chez les patients asymptomatiques, après 1, 3, 6, 9 et 12 mois (contrôle périodique par la suite) [8]. Dans le cadre de ces contrôles, il convient également de réaliser un hémogramme différentiel avant le début du traitement et tous les 3 mois pendant la première année, afin de ne pas passer à côté d’une lymphopénie trop importante (contrôle périodique ensuite).
Les patients ophtalmologiques à risque présentant des facteurs de risque d’œdème maculaire (uvéite, diabète sucré, maladies de la rétine) doivent être suivis régulièrement par leur ophtalmologue avant et pendant le traitement. En l’absence de facteurs de risque d’œdème maculaire, il n’est toutefois pas nécessaire de consulter un ophtalmologiste avant le début du traitement, contrairement au fingolimod.
En cas d’infections graves sous ozanimod (survenues chez moins de 1% des patients dans les études pivots), l’interruption du traitement doit être évaluée. En raison de la longue durée d’élimination (surtout des métabolites actifs), une surveillance des infections doit être effectuée jusqu’à 3 mois après l’arrêt du traitement.
Procédure pratique de mise sous Ozanimod [adaptiert nach 8,9]
Lors du passage d’une médication immunosuppressive à l’ozanimod, la durée d’action ainsi que les mécanismes d’action de ces traitements doivent être pris en compte afin d’éviter des effets immunosuppresseurs additifs involontaires. Par exemple, en cas de traitement préalable par des médicaments qui réduisent les lymphocytes, il faut attendre que le nombre de lymphocytes se normalise avant de commencer le traitement par l’ozanimod. Il convient également de noter que dans les études pivots, les traitements préalables par fingolimod, natalizumab, alemtuzumab, anti-CD4, cladribine, rituximab, ocrelizumab, cyclophosphamide, mitoxantrone, irradiation corporelle totale et greffe de moelle osseuse ont été exclus à tout moment avant l’entrée d’un patient dans l’étude clinique et, par conséquent, aucune donnée clinique n’est disponible pour ces groupes de patients. Cependant, ces traitements antérieurs ne sont pas définis comme des contre-indications au traitement, de sorte qu’un traitement par l’ozanimod est tout à fait possible même après ces traitements antérieurs, mais il convient de tenir compte de la durée d’action ainsi que des mécanismes d’action des traitements antérieurs afin d’éviter des effets immunosuppresseurs additifs involontaires. Le traitement par l’ozanimod peut généralement être initié immédiatement après l’arrêt des interférons ou de l’acétate de glatiramère, si les résultats des analyses de laboratoire (en particulier le bilan sanguin différentiel et le bilan hépatique) sont normaux.
Au début du traitement, un schéma de titration de la dose est nécessaire du jour 1 au jour 7. Après la titration de dose de 7 jours, la dose d’entretien est de 0,92 mg par voie orale une fois par jour, à prendre en permanence à partir du 8e jour. Les gélules d’Ozanimod doivent être avalées entières et peuvent être prises au cours ou en dehors des repas. Si une dose d’Ozanimod a été oubliée, la dose suivante prévue doit être prise le jour suivant.
Place de l’ozanimod dans le paysage thérapeutique actuel de la SEP
L’ozanimod est autorisé en Suisse pour le traitement de première ligne des patients adultes atteints de SEP rémittente et ne peut être prescrit que par un médecin spécialiste en neurologie [17]. Contrairement à la Suisse, l’ozanimod ne peut être utilisé dans l’espace EMA qu’en cas de signes d’activité de la maladie (clinique, ou IRM), alors qu’en Suisse, ce critère ne doit pas être rempli [8,18]. Les populations d’étude comprenaient des patients adultes atteints de SMRR avec une maladie active, le critère d’inclusion était une poussée au cours des 12 derniers mois, ou une poussée au cours des 24 derniers mois avec détection d’une lésion prenant le contraste à l’IRM au cours des 12 derniers mois, et l’EDSS devait être inférieur à 5,5. La plupart des patients de l’étude présentaient déjà des troubles neurologiques (échelle EDSS 2,5 – 2,7) (ce qui n’est pas une condition préalable à un traitement par l’ozanimod en Suisse), l’âge moyen était d’environ 35 ans et les deux tiers des participants étaient des femmes. En conséquence, le groupe de patients approprié n’est pas un groupe spécial de patients hautement sélectionnés, mais des personnes concernées que l’on rencontre tous les jours en consultation. Un traitement préalable par d’autres médicaments n’exclut pas non plus le traitement par l’ozanimod (bien qu’une vigilance accrue soit nécessaire en fonction du traitement préalable). Les études post-hoc n’ont pas détecté de patients spécifiques qui n’ont pas répondu au modulateur du récepteur S1P, de sorte que l’ozanimod semble être une option thérapeutique pour différents profils de patients. Les études réglementaires (et maintenant les premières expériences cliniques quotidiennes) ont montré que l’ozanimod était bien toléré, qu’il n’y avait pas d’effets secondaires gastro-intestinaux significatifs et que la prise orale quotidienne unique était également simple. Grâce à ces facteurs, les patients peuvent très bien intégrer le traitement dans leur routine quotidienne, ce qui crée de bonnes conditions pour une forte adhésion au traitement.
Conclusion
Chaque nouvelle préparation est un élément bienvenu dans l’arsenal des thérapeutes de la SEP. La SEP ne peut pas être guérie, mais elle peut souvent être contrôlée. Cependant, tous les médicaments ne fonctionnent pas de la même manière pour chaque patient. De ce point de vue, il est essentiel de procéder à une adaptation individuelle à la personne concernée. Dans ce contexte, l’Ozanimod est un élément supplémentaire permettant aux personnes concernées de disposer d’un traitement individualisé, efficace, sûr et bien toléré.
Messages Take-Home
- A ce jour, malgré de nombreux progrès, la sclérose en plaques ne peut pas être guérie, mais elle peut souvent être contrôlée.
- L’ozanimod est un modulateur sélectif du récepteur de la sphingosine-1-phosphate (S1P) qui se lie spécifiquement aux sous-types 1 et 5 du récepteur S1P.
- En se liant à ces récepteurs S1P, l’ozanimod empêche les lymphocytes d’interférer avec le processus inflammatoire du système nerveux central.
- Le médicament est autorisé en Suisse depuis fin 2020 en tant que traitement de première ligne chez les patients adultes atteints de sclérose en plaques récurrente-rémittente (SEPR).
- L’ozanimod est pris par voie orale 1× par jour et a montré une bonne tolérance dans les études sans effets secondaires gastro-intestinaux significatifs. Ces données concordent avec les premières observations de la pratique clinique quotidienne.
Littérature :
- Scott FL, Clemons B, Brooks J, et al : L’ozanimod (RPC1063) est un agoniste puissant du récepteur 1 de la sphingosine-1-phosphate (S1P1) et du récepteur 5 (S1P5) ayant une activité modificatrice de la maladie auto-immune. Br J Pharmacol. 2016;173(11) : 1778-1792.
- Giovannoni G, Turner B, Gnanapavan S, et al. : Is it time to target no evident disease activity (NEDA) in multiple sclerosis ? Mult Scler Relat Disord. 2015 Jul;4(4) : 329-333. doi : 10.1016/j.msard.2015.04.006. Epub 2015 May 8. PMID : 26195051.
- Ziemssen T, Derfuss T, de Stefano N, et al : Optimiser le succès du traitement dans la sclérose en plaques. J Neurol. 2016 Jun;263(6) : 1053-1065. doi : 10.1007/s00415-015-7986-y. Epub 2015 Dec 24. PMID : 26705122 ; PMCID : PMC4893374.
- Kappos L, De Stefano N, Freedman MS, et al. : Inclusion de la perte de volume cérébral dans une mesure révisée de “l’absence de preuve d’activité de la maladie” (NEDA-4) dans la sclérose en plaques en phase de rémission. Mult Scler. 2016
- Cohen JA, Comi G, Selmaj KW ; RADIANCE Trial Investigators, et al. : Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (RADIANCE) : a multicentre, randomised, 24-month, phase 3 trial. Lancet Neurol. 2019
- Comi G, Kappos L, Selmaj KW, SUNBEAM Study Investigators, et al. : Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (SUNBEAM) : a multicentre, randomised, minimum 12-month, phase 3 trial. Lancet Neurol. 2019
- Cohen JA, Comi G, Arnold DL, RADIANCE Trial Investigators, et al. : Efficacy and safety of ozanimod in multiple sclerosis : Dose-blinded extension of a randomized phase II study. Mult Scler. 2019
- Compendium Suisse des Médicaments, compendium.ch, état 01/2021
- swissmedicinfo.ch, état 01/2021
- Rocca MA, Battaglini M, Benedict RH, et al. : Brain MRI atrophy quantification in MS : From methods to clinical application. Neurologie. 2017
- Sastre-Garriga J, Pareto D, Battaglini M, et al : MAGNIMS consensus recommendations on the use of brain and spinal cord atrophy measures in clinical practice. Nat Rev Neurol. 2020;16(3) : 171-182.
- Robles-Diaz M, Lucena MI, Kaplowitz N, Spanish DILI Registry, et al. : LatinDILI Network ; Safer and Faster Evidence-based Translation Consortium. Utilisation de la loi de Hy et d’un nouvel algorithme composite pour prédire l’insuffisance hépatique aiguë chez les patients souffrant d’une lésion hépatique induite par un médicament. Gastroentérologie. 2014 Jul;147(1) : 109-118.e5.
- Evangelopoulos ME, Miclea A, Schrewe L, et al : Frequency and clinical characteristics of Multiple Sclerosis rebounds after withdrawal of Fingolimod. CNS Neurosci Ther. 2018 Oct;24(10) : 984-986.
- Berger JR, Brandstadter R, Bar-Or A : COVID-19 and MS disease-modifying therapies. Neurol Neuroimmunol Neuroinflamm. 2020 May
- www.multiplesklerose.ch/de/aktuelles/detail/anti-sars-cov2-impfung-und-multiple-sklerose (consulté le 08.03.2021)
- www.msif.org/news/2020/02/10/the-coronavirus-and-ms-what-you-need-to-know (consulté le 08.03.2021)
- Liste suisse des spécialités, Office fédéral de la santé publique, www.spezialitätenliste.ch/ShowPreparations.aspx (consulté le 08.03.2021)
- Agence européenne des médicaments, ema.europa.eu (consulté le 08.03.2021)
InFo NEUROLOGIE & PSYCHIATRIE 2021 ; 19(3) : 12-18