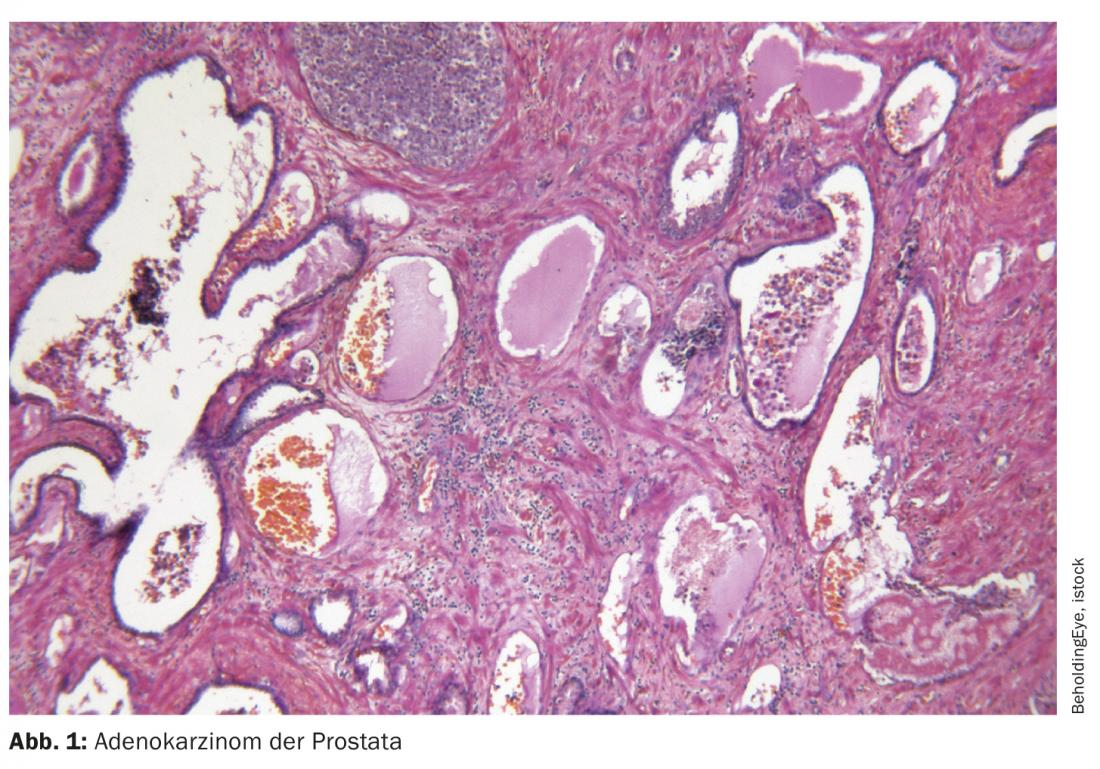
L’antigene di membrana specifico per la prostata (PSMA) svolge un ruolo sempre più importante non solo nella diagnosi del carcinoma prostatico. Con il radioligando 117Lutezio-PSMA-617, è disponibile anche una nuova opzione terapeutica per il cancro alla prostata avanzato resistente alla castrazione (mCRPC). Questo potrebbe presto portare a stadi precoci della malattia e a linee di terapia.
La radioterapia con 117Lutezio-PSMA-617ha suscitato grande interesse in tutti i principali congressi di oncologia di quest’anno. Motivo sufficiente per avere una sessione tutta sua alla Advanced Prostate Cancer Consensus Conference (APCCC), che si è svolta il 9 ottobre. Oltre ai risultati degli studi attuali, in questa occasione sono state discusse anche le sfide cliniche e le speranze future, sia per la terapia basata su PSMA che per la diagnostica.
PSMA: Piccole tabelle di moltiplicazione
L’antigene di membrana specifico per la prostata (PSMA) è una proteina transmembrana con la funzione enzimatica di una carbossipeptidasi idrolasi del folato. Ha un breve dominio citoplasmatico, un lungo dominio extracellulare e una regione transmembrana idrofobica [1,2]. La PSMA è espressa in particolare – ma non esclusivamente – sulle cellule epiteliali della prostata. Nel carcinoma della prostata, si riscontra una sovraespressione fino a 1000 volte rispetto ad altri tipi di tessuto. La proteina serve molto probabilmente all’assorbimento dell’acido folico e del glutammato, ma il suo ruolo esatto non è ancora chiaro. Oltre alla prostata, la PSMA si trova fisiologicamente nelle ghiandole lacrimali e salivari e nell’intestino tenue. Un’espressione leggermente inferiore è rilevabile nel fegato, nella milza e nei gangli parasimpatici, che a volte può portare a risultati falsi-positivi nell’imaging basato su PSMA [3]. Inoltre, poiché i traccianti utilizzati vengono escreti per via renale, l’assorbimento nei reni, negli ureteri e nella vescica è inevitabile.
Esistono marcate differenze intra- e interindividuali nell’espressione di PSMA, che sono di grande importanza nella clinica. Da un lato, senza PSMA manca il bersaglio terapeutico, dall’altro, le lesioni PSMA-negative non possono essere rilevate nell’imaging basato su PSMA. Fino al 10% dei pazienti non mostra alcuna espressione o solo una minima espressione. In generale, questo valore è più alto nel mCRPC rispetto al cancro alla prostata sensibile alla castrazione (CSPC). Livelli più elevati di PSMA sono associati a un punteggio Gleason più alto e a una sopravvivenza globale più scarsa [4]. Spesso, alcuni focolai in un paziente esprimono il PSMA, mentre altri rimangono invisibili alla PET PSMA – una sfida clinica.
La PSMA è stata riconosciuta come un potenziale bersaglio terapeutico e diagnostico più di 30 anni fa. La prima approvazione da parte della FDA di un anticorpo monoclonale diretto contro il PSMA è arrivata già nel 1996: ProstaScint®. Tuttavia, questo si è rivelato poco affidabile negli studi clinici, poiché si lega al dominio citoplasmatico di PSMA e quindi si deposita solo nelle cellule tumorali apoptotiche. Gli approcci più recenti che hanno come bersaglio la PSMA si basano quindi sull’attacco del dominio extracellulare della proteina transmembrana.
L’interazione del recettore degli androgeni con PSMA è interessante. Quindi, la terapia di deprivazione androgenica (ADT) di solito porta ad un aumento dell’espressione di PSMA [5,6] sia nei casi sensibili alla castrazione che in quelli resistenti alla castrazione. Alcune metastasi compaiono con l’imaging PSMA solo dopo l’ADT. A causa della risposta tumorale, il carcinoma prostatico sensibile alla castrazione (CSPC) determina effetti opposti dell’ADT sull’imaging PSMA: il numero di cellule tumorali diminuisce, ma queste mostrano una maggiore espressione di PSMA.
PSMA nella diagnostica per immagini
Nel frattempo, la PSMA-PET rappresenta un metodo di imaging robusto con un processo ben definito e una buona disponibilità globale. Le linee guida corrispondenti esistono dal 2017 e un aggiornamento è previsto per il 2022 [7]. Tuttavia, l’uso ottimale non è stato chiarito in modo definitivo ed esistono alcune sfide cliniche. Tra l’altro, esiste un gran numero di traccianti che non sono ancora stati adeguatamente confrontati tra loro (panoramica 1) . Alcuni confronti con alcuni pazienti mostrano risultati simili per le diverse sostanze [8,9]. I dati più solidi esistono per il confronto tra 18F-PSMA-1007e 68Ga-PSMA-11, presumibilmente perché questi traccianti sono i più utilizzati. In questo contesto, è stato dimostrato che il 18F-PSMA-1007produce più falsi positivi. Le lesioni ossee, in particolare, non possono essere rilevate in modo affidabile con 18F-PSMA-1007a causa dell’accumulo fisiologico nel midollo osseo. Quindi, soprattutto con questo tracciante, per interpretare le immagini si deve ricorrere a una diagnostica per immagini aggiuntiva, come la risonanza magnetica o la TAC. D’altra parte, il 18F-PSMA-1007si è dimostrato estremamente utile per valutare le condizioni locoregionali [10]. In termini di sensibilità, non sembra esserci alcuno svantaggio di un tracciante [11]. La conclusione è che diversi traccianti sono probabilmente più adatti a seconda del contesto – un campo in cui c’è ancora molto da indagare.

Oltre alla mancanza di una caratterizzazione precisa dei vari traccianti, la PSMA-PET pone anche altre sfide, non da ultimo di natura finanziaria. Indipendentemente dalla sostanza utilizzata, la sensibilità del metodo non è mai del 100%. Inoltre, la valutazione affidabile delle immagini richiede una certa esperienza – esperienza che non può essere data per scontata, vista la novità. La PSMA non è assolutamente specifica per il cancro, per la prostata o per il cancro alla prostata. L’espressione si trova anche, ad esempio, nel linfoma, nel carcinoma polmonare e nell’adenocarcinoma del colon, oltre che in varie infiammazioni attive come il morbo di Crohn o il COVID-19. Anche il significato clinico dell’imaging basato su PSMA e il suo impatto sulla pratica clinica devono essere chiariti in futuro.
Ciò solleva la questione scottante se la PSMA-PET sia effettivamente la modalità migliore per una stadiazione affidabile. Questa domanda è difficile da chiarire, soprattutto perché l’imaging convenzionale è stato utilizzato per valutare lo stadio del tumore in quasi tutti gli studi clinici fino ad oggi e mancano confronti randomizzati. Sostituire o integrare l’imaging classico con la PSMA-PET potrebbe avere un impatto duraturo e difficile da valutare sulla gestione clinica, compresa la terapia e quindi l’esito. Se, ad esempio, il metodo rileva metastasi non rilevate in precedenza, non c’è solo il pericolo di un sovra-trattamento. D’altra parte, ci sono probabilmente pazienti che trarrebbero beneficio da una valutazione più precisa del loro stadio patologico e quindi da un’intensificazione del trattamento. L’obiettivo deve rimanere quello di utilizzare la diagnostica per immagini per identificare i pazienti che hanno davvero bisogno di un aumento dell’intensità e quindi migliorare i loro risultati clinici.
Per illustrare questo problema, all’APCCC sono state presentate alcune cifre impressionanti. Quindi, il 98% dei pazienti CRPC considerati M0 nella stadiazione convenzionale presenta lesioni nella PSMA-PET, di cui il 24% sono locali e il 76% sono N1/M1 [12]. Complessivamente, circa la metà dei pazienti originari M0 diventano pazienti M1 – un upstaging con conseguenze. Infatti, anche se le opzioni di trattamento sono simili nella CRPC metastatica e non metastatica, secondo l’attuale stato di approvazione, l’opzione di apalutamide o darolutamide è persa [13]. Con le nuove modalità di imaging, la gestione clinica deve sempre essere messa in discussione e adattata – un processo che attualmente è in pieno svolgimento nel cancro alla prostata. Non c’è dubbio che la PSMA-PET sia superiore alla TAC convenzionale e alla PET colina, in uso fino al 2016, in termini di specificità e sensibilità. Tuttavia, il valore clinico resta da chiarire, in modo ottimale nell’ambito di studi clinici randomizzati.
Radioterapia basata su PSMA
Per quanto controverso possa essere l’uso della PSMA-PET nella stadiazione, è altrettanto chiaro nella selezione dei pazienti per la terapia con radioligandi diretti da PSMA. Pertanto, 117Lutezio-PSMA-617è già accessibile presso i centri specializzati in Svizzera nell’ambito di un programma di uso compassionevole, sebbene non sia ancora stata ottenuta l’approvazione di Swissmedic [13]. Finora, il trattamento viene utilizzato dopo il fallimento di un agente mirato all’AR e di un taxano (docetaxel) nella mCRPC. La sequenza terapeutica ideale con cabazitaxel è attualmente ancora poco chiara e deve essere valutata individualmente. Grazie alla diversa natura della terapia, ha un elevato potenziale per integrare in modo ottimale le opzioni esistenti. Inoltre, con un tasso di espressione di circa l’87% nella mCRPC, PSMA è un bersaglio quasi ubiquitario che include biomarcatori di risposta. Il trattamento mirato al PSMA potrebbe quindi essere un’opzione per un gran numero di malati in futuro – e l’identificazione dei pazienti adatti non è particolarmente complicata.
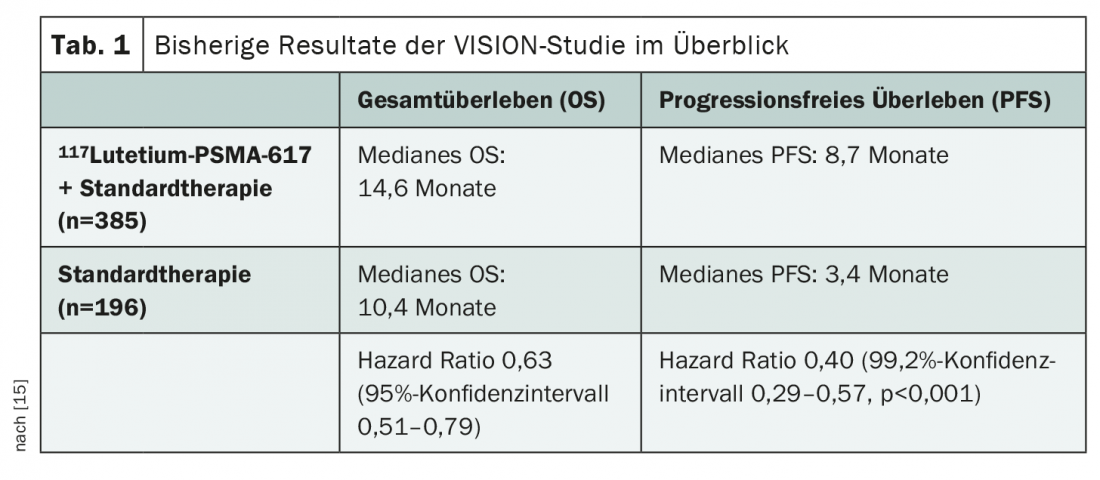
La maggior parte dei dati disponibili finora su 117Lutezio-PSMA-617proviene dallo studio VISION, pubblicato di recente [14,15] e presentato in vari congressi. Questo studio studia l’aggiunta di 117Lutezio-PSMA-617alla terapia standard nell’mCRPC dopo il pre-trattamento con almeno un bloccante del recettore degli androgeni e un regime chemioterapico a base di taxano, in presenza di una PET/CT 68Gallio-PSMA-11positiva. Sono già stati dimostrati benefici significativi nella sopravvivenza globale (OS) e nella sopravvivenza libera da progressione (PFS) in tutti i sottogruppi (Tabella 1) . Data la comprovata efficacia della terapia con 117Lutezio-PSMA-617in questo contesto, sorgono ora diverse altre domande. Ad esempio, il momento ottimale per il trattamento deve ancora essere chiarito. Il 117Lutezio-PSMA-617deve essere usato prima, con o dopo la chemioterapia? E il trattamento con radioligandi potrebbe essere utilizzato anche nelle fasi precedenti della malattia, ad esempio nella CSPC o nei casi non metastatici? Qual è la situazione delle opzioni terapeutiche successive? Ad oggi mancano anche dati affidabili sulla valutazione della tossicità a lungo termine, in particolare la soppressione del midollo osseo. È probabile che questo problema venga sempre più alla ribalta con i test in stadi sempre più precoci della malattia e delle linee di terapia.
Alcuni studi stanno attualmente esaminando la sequenza di trattamento ottimale con 117Lutezio-PSMA-617. Ad esempio, è in corso lo studio PSMAfore, che testa l’efficacia del radioligando nell’mCRPC dopo un bloccante del recettore degli androgeni ma prima della chemioterapia. Un’applicazione ancora più precoce viene studiata nello studio PSMAddition, che sta testando l’aggiunta di 117Lutezio-PSMA-617al trattamento standard nel mCSPC di prima linea. Anche nel contesto neoadiuvante, è attualmente in corso uno studio: LuTectomy. Sebbene il beneficio nella mCRPC dopo la chemioterapia a base di taxano sia ormai considerato comprovato, il suo utilizzo nelle linee di terapia precedenti e negli stadi della malattia sarà visto nei prossimi anni.
La chiave è la selezione dei pazienti?
<Gli esperti dell’APCCC hanno attribuito il fatto che nella maggior parte dei pazienti dello studio VISION è stata ottenuta solo una riduzione del 50% del PSA con la terapia 117-lutezio-PSMA-617alla selezione inadeguata dei pazienti fino ad oggi, tra le altre cose. Probabilmente non tutti i pazienti inclusi hanno beneficiato del trattamento aggiuntivo. Questo potrebbe indicare che, oltre alla PSMA-PET, si dovrebbero utilizzare altri metodi di selezione dei pazienti per ottenere un’efficacia clinica ottimale. Potrebbero essere di natura genetica, ma anche un’ulteriore FDG-PET è un’opzione.
Il profilo genetico del cancro alla prostata è estremamente eterogeneo; ad esempio, la malattia metastatica de novo mostra spesso un profilo genetico meno favorevole, con un esito peggiore [16]. Questi pazienti rispondono meno bene a diverse terapie, il che potrebbe essere vero anche per il trattamento con 117Lutezio-PSMA-617. Tuttavia, c’è una mancanza di dati affidabili al riguardo – un motivo per determinare il profilo genetico nell’ambito di studi clinici. Pertanto, in futuro, il profilo genetico potrebbe essere preso in considerazione nelle decisioni terapeutiche, oltre all’espressione di PSMA.
Inoltre, non è chiaro se la FDG-PET debba essere utilizzata per la selezione dei pazienti, oltre al PSMA-. Questo non è stato fatto nello studio VISION [14] – a differenza dello studio TheraP, che ha confrontato il trattamento con 117Lutezio-PSMA-617con cabazitaxel nella mCRPC [17]. La FDG-PET aggiuntiva ha portato da un lato a un maggior numero di esclusioni dallo studio – e dall’altro a un tasso di risposta più elevato al trattamento con 117Lutezio-PSMA-617, pari al66% (VISION: 46%). Ciò è probabilmente dovuto al fatto che i pazienti che avevano metastasi che esprimevano PSMA, così come quelli senza espressione corrispondente, potevano essere identificati ed esclusi grazie alla FDG-PET. Oltre a un potenziale vantaggio nella selezione dei pazienti, l’esecuzione della FDG-PET porta anche vantaggi nella caratterizzazione più accurata della malattia e nell’ottimizzazione dei siti di campionamento bioptico. Per esempio, i sintomi causati dalle metastasi possono essere meglio assegnati e trattati correttamente in una fase iniziale. In generale, l’eterogeneità intraindividuale spesso presente nel carcinoma prostatico metastatico rappresenta un limite importante per il trattamento con i radioligandi. Questo può essere rilevato da un’ulteriore FDG-PET.
Sogni del futuro: di combinazioni e nuovi principi attivi
Lo sviluppo del 117Lutezio-PSMA-617pone le basi per una nuova opzione terapeutica nel cancro alla prostata. Questi dovranno essere esaminati più da vicino nei prossimi anni e caratterizzati in termini di potenziale. Le combinazioni terapeutiche e le sequenze ottimali devono ancora essere trovate. Inoltre, esistono approcci terapeutici alternativi che mirano anche al PSMA.
Si sta aprendo un ampio campo di ricerca nell’ambito delle possibili terapie combinate con 117Lutezio-PSMA-617. Combinazioni di farmaci adeguate potrebbero, tra l’altro, prevenire la resistenza dovuta all’eterogeneità della malattia. Le combinazioni con enzalutamide in prima linea (ENZA-P) e con olaparib (LuPARP) e pembrolizumab (PRINCE) in seconda linea sono attualmente oggetto di studio nella mCRPC. E le cose stanno cambiando anche per quanto riguarda le possibili terapie successive. Qui l’attenzione è rivolta in particolare agli emettitori α. Da un lato, questi potrebbero essere utilizzati dopo l’emettitore β 117Lutezio-PSMA-617, dall’altro potrebbero essere un’alternativa più efficace e delicata. Questo perché gli emettitori α provocano un trasferimento di energia maggiore a una distanza inferiore. Attualmente, le sostanze 225Act-PSMA-617, 225Act-J591e 227Thorium-PSMA-TTCsono in fase di sperimentazione di fase I.
Classi di farmaci alternativi che mirano al PSMA sono le cellule CAR-T e gli anticorpi bispecifici (BiTE, Bispecific T-Cell Engagers), come l’acapatamab. Attualmente, sono ancora agli inizi e lo sviluppo si sta rivelando difficile, data la fase avanzata della malattia e l’elevata vulnerabilità della popolazione di pazienti. Tuttavia, ci sono i primi risultati promettenti degli studi di fase I, con tassi di risposta intorno al 34% [18]. Rimaniamo curiosi.
Fonte: PSMA nella diagnostica e nella terapia. Sessione 2, Advanced Prostate Cancer Consensus Conference (APCCC) online, 09.10.2021.
Letteratura:
- Rajasekaran AK, Anilkumar G, Christiansen JJ: L’antigene di membrana specifico per la prostata è una proteina multifunzionale? Am J Physiol Cell Physiol. 2005; 288(5): C975-981.
- Sengupta S, et al: Confronto tra i ligandi dell’antigene di membrana specifico della prostata nella ricerca di traduzione clinica per la diagnosi del cancro alla prostata. Cancer Rep (Hoboken). 2019; 2(4): e1169.
- Hofman MS, et al: PET dell’antigene di membrana specifico della prostata: utilità clinica nel cancro alla prostata, modelli normali, perle e insidie. Radiografie. 2018; 38(1): 200-217.
- Paschalis A, et al.: Eterogeneità dell’antigene di membrana specifico della prostata e difetti di riparazione del DNA nel cancro alla prostata. Eur Urol. 2019; 76(4): 469-478.
- Bakht MK, et al: Influenza della terapia di deprivazione androgenica sull’assorbimento di agenti mirati a PSMA: opportunità e sfide emergenti. Nucl Med Mol Imaging. 2017; 51(3): 202-211.
- Hope TA, et al: Imaging PET 68Ga-PSMA-11 della risposta all’inibizione del recettore degli androgeni: prima esperienza umana. J Nucl Med. 2017; 58(1): 81-4.
- Fendler WP, et al: (68)Ga-PSMA PET/CT: linea guida di procedura congiunta EANM e SNMMI per l’imaging del cancro alla prostata: versione 1.0. Eur J Nucl Med Mol Imaging. 2017; 44(6): 1014-1024.
- Giesel FL, et al: Confronto intraindividuale di (18)F-PSMA-1007 e (18)F-DCFPyL PET/CT nella valutazione prospettica di pazienti con carcinoma prostatico di nuova diagnosi: uno studio pilota. J Nucl Med. 2018; 59(7): 1076-80.
- Dietlein M, et al.: Confronto tra [(18)F]DCFPyL e [ (68)Ga]Ga-PSMA-HBED-CC per l’imaging PSMA-PET nei pazienti con cancro alla prostata recidivato. Mol Imaging Biol. 2015; 17(4): 575-584.
- Dietlein F, et al.: Confronto intraindividuale di (18)F-PSMA-1007 con i ligandi PSMA escreti a livello renale per l’imaging PSMA PET nei pazienti con tumore alla prostata recidivato. J Nucl Med. 2020; 61(5): 729-734.
- Rauscher I, et al.: Confronto a coppie di (68)Ga-PSMA-11 PET/CT e (18)F-PSMA-1007 PET/CT: frequenza di insidie ed efficacia di rilevamento nella recidiva biochimica dopo la prostatectomia radicale. J Nucl Med. 2020; 61(1): 51-57.
- Fendler WP, et al: Tomografia a emissione di positroni dell’antigene di membrana specifico della prostata negli uomini con cancro alla prostata resistente alla castrazione non metastatico. Clin Cancer Res. 2019; 25(24): 7448-7454.
- Informazioni sui farmaci di Swissmedic: www.swissmedicinfo.ch (ultimo accesso 21.10.2021).
- Sartor O, et al: Lutezio-177-PSMA-617 per il cancro alla prostata metastatico resistente alla castrazione. N Engl J Med. 2021; 385(12): 1091-1103.
- Morris MJ, et al: Studio di fase III del lutezio-177-PSMA-617 nei pazienti con carcinoma prostatico metastatico resistente alla castrazione (VISION). Riunione annuale ASCO 2021, Sessione plenaria Cancro genitourinario – Prostata, testicolo e pene, abstract #LBA4.
- Deek MP, et al: Il paesaggio mutazionale del cancro alla prostata metastatico sensibile alla castrazione: la teoria dello spettro rivisitata. Eur Urol. 2021; 80(5): 632-640.
- Hofman MS, et al: [(177)Lu]Lu-PSMA-617 rispetto a cabazitaxel nei pazienti con carcinoma prostatico metastatico resistente alla castrazione (TheraP): uno studio randomizzato, in aperto, di fase 2. Lancet. 2021; 397(10276): 797-804.
- Einsele H, et al.: La piattaforma BiTE (T-cell engager bispecifico): sviluppo e potenziale futuro di una terapia immuno-oncologica mirata per tutti i tipi di tumore. Cancro. 2020; 126(14): 3192-3201.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(6): 26-28 (pubblicato l’8.12.21, prima della stampa).