La selezione della terapia appropriata e le medicazioni ottimali sono fattori decisivi nel processo di guarigione. La considerazione del microambiente della ferita individuale gioca un ruolo importante, come dimostrano i risultati attuali.
A differenza di altre specialità della medicina, esiste una base di prove relativamente piccola nel campo della ricerca sulle ferite, che dovrebbe cambiare in futuro. Le sinergie tra la pratica clinica e la ricerca scientifica sono particolarmente importanti in questo settore. La Prof. Dr. med. Ewa K. Stürmer, direttrice dell’Istituto per la Ricerca Traslazionale sulle Ferite dell’Università di Witten/Herdecke (D) [1], ha parlato delle attuali scoperte in questo campo al Congresso sulle Ferite di Norimberga 2019.
Biofilm: cosa è possibile fare in ambito ambulatoriale?
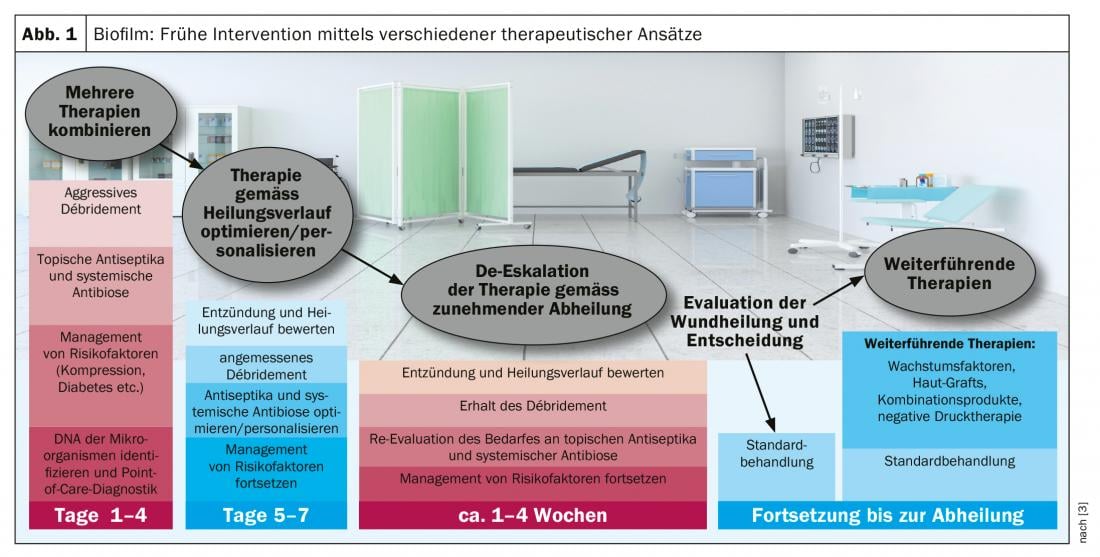
Nel 78% di tutte le ferite croniche, si forma un biofilm (scatola) con effetti potenzialmente negativi sulla guarigione della ferita [2]. Che l’ambiente della ferita sia un fattore centrale per le prestazioni antimicrobiche nel contesto della terapia del biofilm è una delle scoperte attuali in questo campo [2]. Solo lo sbrigliamento meccanico può pulire completamente un biofilm. Tuttavia, la cura ambulatoriale delle ferite può ridurre la carica microbica, evitando che il biofilm si sviluppi in un’infezione (Fig. 1) . I metodi comprovati sono: pulizia intensiva e NaCl, soluzioni per l’irrigazione della ferita, disinfezione spray, medicazione antisettica della ferita. In generale, i seguenti principi si applicano alla cura del margine della ferita e dell’area circostante: gli antimicrobici tendono ad avere un effetto antiproliferativo; l’edema deve essere rispettato, l’idratazione della pelle deve essere assicurata e deve essere fornita un’assistenza di base. Un biofilm non causa di per sé un’infezione e può trovarsi anche su una ferita che non sembra infetta. Il margine della ferita è spesso interessato dal biofilm. Questo può essere reso visibile attraverso la misurazione della fluorescenza, in quanto i batteri hanno una fluorescenza intrinseca e quando vengono irradiati con luce UV, la colonizzazione batterica viene colorata ad una concentrazione >104/m2. Il relatore lo illustra con il caso di un’ulcera del piede diabetico. “Al momento, il migliore e unico trattamento di scelta per la rimozione del biofilm è la rimozione meccanica con una curette o un bisturi” [1]. Questa è anche la conclusione delle attuali raccomandazioni di consenso [3].
Reti idrofobiche per ferite e medicazioni intelligenti per ferite
“Le maglie idrofobiche non sono solo economiche, ma anche delicate per le cellule” [1]. Per una ferita localmente infetta, il relatore raccomanda di passare a una rete idrofoba per ferite dopo 7-10 giorni di medicazioni antimicrobiche e soluzioni di irrigazione della ferita. Il meccanismo d’azione si basa, tra l’altro, sulla struttura di questa rete di ferite, che ha un’influenza favorevole sull’assorbimento batterico.
Il tema delle tecnologie intelligenti per le ferite è controverso. Da un lato, l’industria offre già prodotti corrispondenti, con i quali è possibile misurare, ad esempio, il valore ph, la temperatura e l’ipossia. D’altra parte, la questione di cosa fare sulla base di queste informazioni è un’altra dimensione. L’oratore sottolinea che c’è ancora un grande divario in questo senso. Identificare quale trattamento è indicato per quale ferita e quali materiali e metodi sono utili o meno per il processo di guarigione è una questione centrale che viene affrontata su un altro livello. Forse in futuro ci saranno ulteriori sinergie tra queste aree.
| Biofilm Il biofilm è una comunità strutturata di microbi con diversità genetica ed espressione genica variabile che crea comportamenti e meccanismi di difesa che portano alla produzione di infezioni uniche (croniche) con una significativa tolleranza agli antibiotici e agli antimicrobici, proteggendo al contempo dall’immunità dell’ospite [1]. |
Importanza dell’argento nella terapia antisettica
L’argento è contenuto in numerosi prodotti per la cura delle ferite e secondo una recente meta-analisi [4], quando viene utilizzato in modo mirato e limitato nel tempo, vi sono prove di un miglioramento della qualità della vita e di un buon rapporto costo-efficacia, oltre agli effetti antimicrobici. Una corretta indicazione e una durata della terapia di massimo 14 giorni sono decisive [4]. Non è stato possibile dimostrare una resistenza all’argento clinicamente rilevante [5]. La conclusione di un articolo pubblicato nel 2019 è che attualmente non ci sono prove che la resistenza all’argento sia una seria minaccia per la salute [5]. Per poter fare affermazioni più chiare in merito e determinare la quantità di argento necessaria per un effetto terapeutico ottimale, sono necessari ulteriori studi.
Fonte: Congresso sulle ferite di Norimberga (D)
Letteratura:
- Stürmer EK: Colonizzazione della ferita, infezione o allergia? Come riconoscere e trattare? Prof. Dr. med. Ewa K. Stürmer, Istituto per la Ricerca Traslazionale sulle Ferite, Università di Witten/Herdecke (D), presentazione di diapositive, Congresso sulle Ferite di Norimberga 06.12.2019.
- Hülsbömer LF, Rembe JD, Besser M, Stürmer EK: Valutazione quantitativa e qualitativa dell’efficacia anti-biofilm delle moderne sostanze antimicrobiche e antisettiche in un nuovo modello di biofilm batterico in vitro (hpBIOM). Contributo FV37, Congresso sulle ferite di Norimberga, 07.12.2019.
- Schultz G, et al: (per il Global Wound Biofilm Expert Panel): Linee guida di consenso per l’identificazione e il trattamento dei biofilm nelle ferite croniche non cicatrizzanti. Riparazione e rigenerazione delle ferite 2017; 25 (5): 744-757.
- Dissemond J, et al: Prove per l’argento nella cura delle ferite – meta-analisi degli studi clinici del 2000-2015. J Dtsch Dermatol Ges 2017; 15(5): 524-535.
- Percival SL, Salisbury AM, Chen R: Argento, biofilm e ferite: resistenza rivisitata. Crit Rev Microbiol 2019; 45(2): 223-237.
HAUSARZT PRAXIS 2020; 15(1): 28-30 (pubblicato il 25.1.20, prima della stampa).