La nefroprotezione comprende interventi che rallentano il declino del GFR nel tempo, ritardando così l’insufficienza renale in fase terminale. L’intervento più recente è l’uso degli inibitori SGLT2 nei pazienti con nefropatia diabetica.
L’insufficienza renale cronica può essere diagnosticata in due modi:
- Evidenza di una funzione renale compromessa con una velocità di filtrazione glomerulare calcolata (eGFR) inferiore a 60 ml/min, che persiste da almeno tre mesi.
- Evidenza di danno renale cronico (albuminuria, ematuria, evidenza di imaging come reni policistici) che persiste da almeno tre mesi – indipendentemente dall’eGFR.
La diagnosi di insufficienza renale cronica può quindi essere fatta nella pratica con tre semplici esami: Determinazione della creatinina (da cui calcolare l’eGFR), stato delle urine con sedimento e proteinuria (urine a campione) ed ecografia renale.
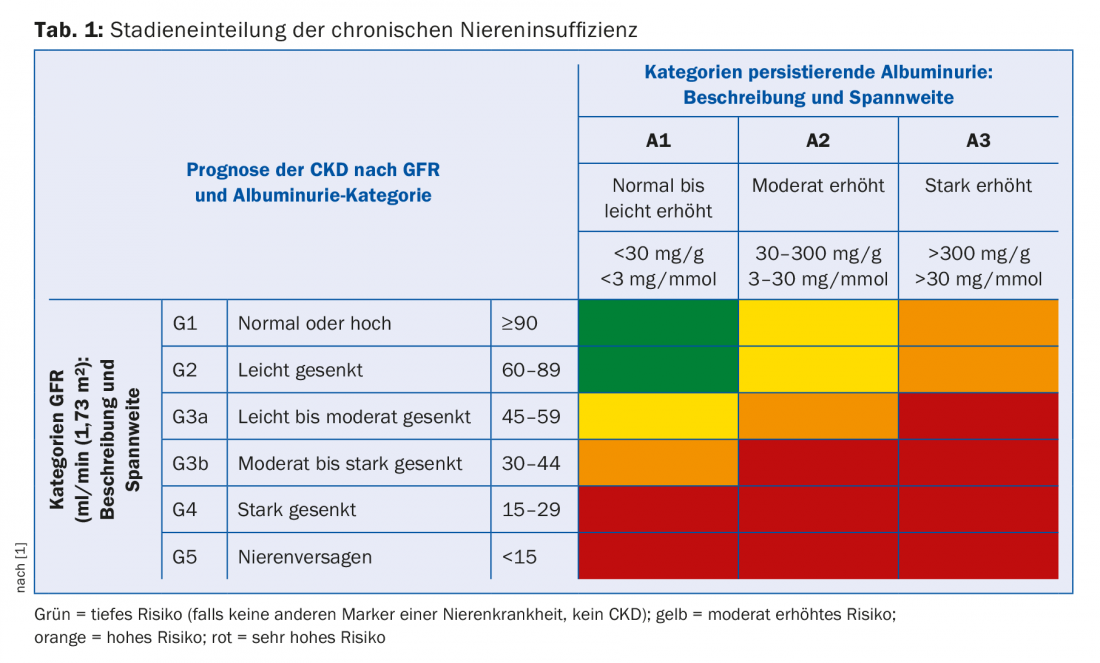
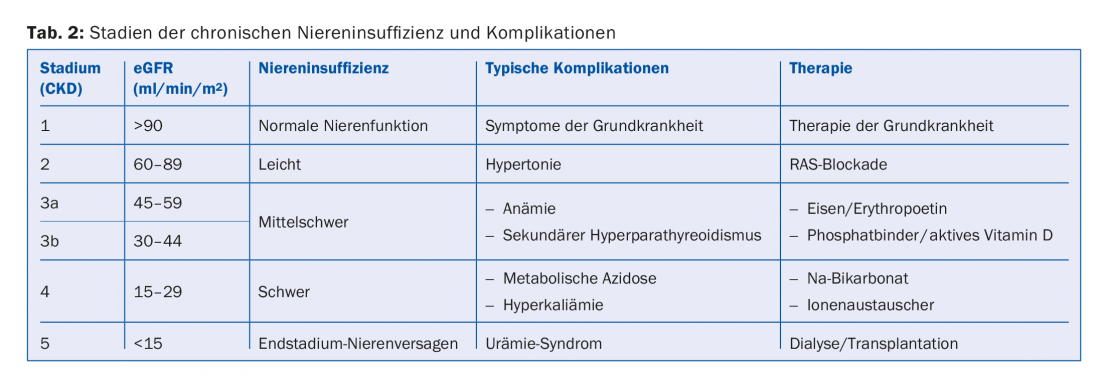
A seconda dell’entità della compromissione della funzione renale e dell’albuminuria, si effettua la stadiazione dell’insufficienza renale cronica. L’eGFR e l’albuminuria sono fattori di rischio indipendenti sia per la mortalità cardiovascolare che per il rischio di sviluppare un’insufficienza renale in fase terminale [1]. La stadiazione indica quindi la frequenza con cui tali pazienti devono essere monitorati e quanto aggressivamente devono essere trattati per quanto riguarda i rischi cardiovascolari (tab. 1). Inoltre, l’entità della compromissione della funzione renale indica quali sono le complicanze secondarie da aspettarsi (tab. 2). Questi devono essere ricercati attivamente e, se necessario, trattati.
Corso
L’insufficienza renale cronica è progressiva nel corso degli anni, indipendentemente dal fatto che la malattia di base sia ancora attiva o meno. Questo fenomeno è spiegato dalla cosiddetta “ipotesi di Brenner”, che afferma che con la perdita di un numero maggiore di nefroni, i nefroni rimanenti compensano almeno parzialmente la perdita di funzione e quindi iperfiltrano. Questa iperfiltrazione, che dura a lungo, porta al danneggiamento dei nefroni ancora intatti. Istologicamente, si può rilevare prima l’ipertrofia glomerulare, seguita da una crescente glomerulosclerosi, con conseguente perdita progressiva della funzione e comparsa di albuminuria.
La progressione dell’insufficienza renale cronica può essere descritta individualmente per ogni paziente con la cosiddetta curva di Mitch [2]. Se si traccia l’eGFR o il valore 1/creatinina nel tempo, si ottiene una curva linearmente decrescente. Con questa curva, si può stimare il rischio di sviluppare un’insufficienza renale in fase terminale per un singolo paziente (Fig. 1A). Questo facilita la discussione con il paziente e permette di prepararsi tempestivamente all’avvio di una procedura di sostituzione renale.
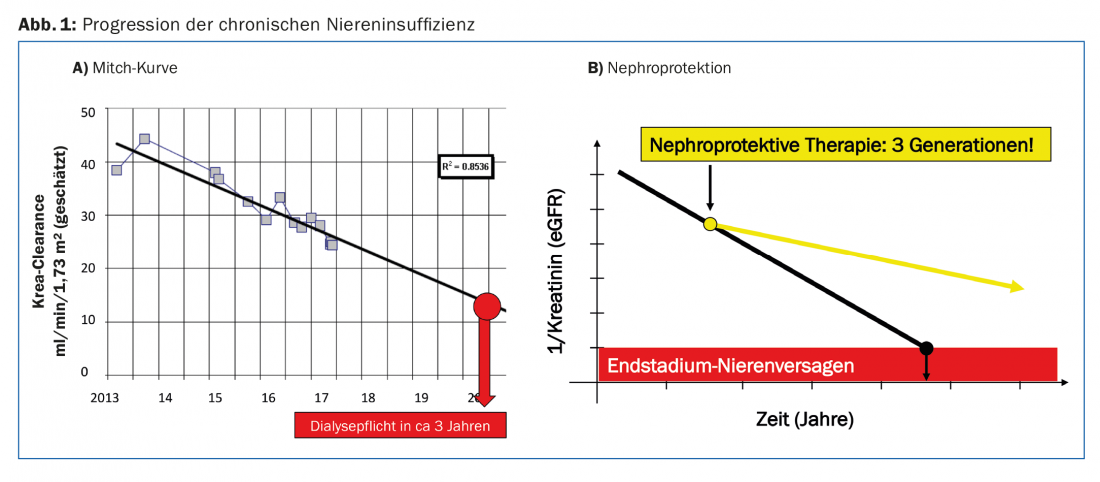
Come medici, vorremmo avere un’influenza favorevole sulla progressione dell’insufficienza renale cronica. Per “misure nefroprotettive” intendiamo tutti gli interventi che rallentano il declino dell’eGFR nel tempo. Ad oggi, non c’è stato alcun intervento per fermare completamente questo spreco. Ma se la caduta della curva Mitch può essere appiattita solo un po’, il paziente può guadagnare diversi anni senza dialisi (Fig. 1B).
Nefroprotezione
Prima generazione – blocco del sistema renina-angiotensina: il sistema renina-angiotensina (RAS) è coinvolto in modo cruciale nella regolazione del flusso sanguigno renale e quindi della perfusione dei singoli glomeruli. L’angiotensina influenza direttamente il tono del vaso efferente. Una maggiore quantità di angiotensina porta alla costrizione dei vasi efferenti e quindi ad un aumento della pressione di filtrazione nel letto capillare glomerulare. Da un lato, ciò consente l’autoregolazione della filtrazione glomerulare in un’ampia gamma di fluttuazioni della pressione sanguigna. D’altra parte, porta anche alla summenzionata iperfiltrazione nell’ambito dell’ipotesi di Brenner. Il blocco del RAS con ACE-inibitori, bloccanti del recettore dell’angiotensina di tipo 1 (sartani) o inibitori della renina porta alla dilatazione del vaso efferente al glomerulo. Questo abbassa la pressione di perfusione glomerulare e protegge il letto capillare glomerulare. Allo stesso tempo, però, il tasso di filtrazione glomerulare per nefrone e complessivo diminuisce. L’inizio del blocco del RAS in un paziente con insufficienza renale comporta quindi sempre un aumento della creatinina. Tale aumento può essere tollerato fino al 25%, a condizione che successivamente rimanga stabile a questo livello. L’aumento della creatinina è funzionale e prova che la pressione di perfusione glomerulare potrebbe effettivamente essere abbassata. Se il blocco del RAS viene interrotto di nuovo, la creatinina scende di nuovo dello stesso valore. Se il livello di creatinina non si stabilizza dopo l’introduzione del blocco del RAS, questo deve essere nuovamente interrotto e si deve cercare una stenosi dell’arteria renale.
Diversi studi randomizzati condotti negli anni ’90 hanno dimostrato che il blocco del RAS può rallentare la progressione dell’insufficienza renale cronica, sia nella nefropatia diabetica che in quella non diabetica [3]. Il blocco del RAS è quindi ora la base di qualsiasi intervento nefroprotettivo e deve essere reso più aggressivo quanto più alta è la proteinuria. Le singole sostanze devono essere dosate al massimo; il doppio blocco RAS deve essere rigorosamente evitato [4].
Seconda generazione – correzione dell’acidosi metabolica: il rene è l’organo principale per l’escrezione degli acidi fissi, che si accumulano con la crescente restrizione della funzione renale. L’insufficienza renale cronica è quindi solitamente associata alla comparsa di acidosi metabolica, soprattutto negli stadi avanzati della CKD G3b.
L’acidosi metabolica ha diversi effetti sfavorevoli. Compromette la salute delle ossa e favorisce la comparsa di iperkaliemia, che a sua volta aumenta il rischio di aritmie cardiache. Tuttavia, per molto tempo non è stato chiaro se l’acidosi metabolica stessa influenzi la progressione dell’insufficienza renale cronica. Negli anni 2000, sono stati pubblicati diversi studi randomizzati che hanno analizzato l’effetto del trattamento dell’acidosi metabolica con bicarbonato di sodio sulla progressione dell’insufficienza renale cronica. Con sorpresa di molti nefrologi, è stato dimostrato che in vari stadi dell’insufficienza renale cronica (CKD G2, G3 e G4), la progressione può essere rallentata e l’insorgenza dell’insufficienza renale in fase terminale ritardata con questa semplice misura [5]. Pertanto, oggi è una raccomandazione generale che l’acidosi metabolica con un bicarbonato sierico <20 mmol/l deve essere trattata con bicarbonato di sodio. Questo migliora anche l’iperkaliemia, che a sua volta consente di mantenere il blocco RAS più efficiente.
I limiti di questo intervento sono spesso la tollerabilità (il bicarbonato di sodio provoca flatulenza), l’elevato numero di compresse (per ottenere un bicarbonato sierico >20 mmol/l, a volte sono necessarie da sei a otto compresse al giorno) e il carico di sodio, che può portare a un aumento dell’edema e/o della pressione sanguigna.
Terza generazione – blocco del cotrasportatore sodio/glucosio SGLT2 nel tubulo prossimale: negli ultimi anni, un nuovo gruppo di farmaci antidiabetici orali è stato testato in diversi studi randomizzati: Si tratta di inibitori del cotrasportatore sodio/glucosio nel tubulo prossimale (SGLT2, “trasportatore sodio-glucosio 2”). Questi farmaci inducono glucosuria. Questo comporta un miglioramento dell’HbA1c e un bilancio calorico negativo che porta a una perdita netta di peso. Allo stesso tempo, però, il blocco del SGLT2 porta anche alla natriuresi. Queste sostanze sono quindi una nuova classe di diuretici che, a differenza dei diuretici dell’ansa e dei tiazidici, non agiscono nel nefrone distale ma nel tubulo prossimale.
Gli inibitori SGLT2 sono stati finora testati soprattutto nei pazienti con diabete di tipo 2 e un profilo di rischio cardiovascolare aumentato (spesso nella prevenzione secondaria). È stato dimostrato un beneficio altamente significativo sulla mortalità per tutte le cause (empagliflozin) e sulla mortalità cardiovascolare (empagliflozin, canagliflozin). Grazie all’effetto diuretico, anche le riospedalizzazioni per insufficienza cardiaca scompensata potrebbero ridursi in modo significativo [6,7].
Gli studi di follow-up hanno ora dimostrato anche un effetto positivo altamente significativo sugli endpoint renali difficili (nuova insorgenza di macroalbuminuria, raddoppio della creatinina sierica, comparsa di insufficienza renale allo stadio finale). L’effetto è dello stesso ordine di grandezza del blocco RAS in un gruppo di pazienti che per la maggior parte è già trattato con bloccanti RAS [8]! Il meccanismo della nefroprotezione non è ancora stato chiarito in dettaglio. Tuttavia, si ipotizza un effetto attraverso la macula densa con dilatazione dei vasi afferenti. È stato dimostrato lo stesso aumento funzionale della creatinina all’inizio del trattamento, con successiva stabilizzazione della funzione renale, come con il blocco del RAS [9].
Con questa classe di sostanze si devono notare due effetti collaterali clinici: Frequenti ma innocue sono le infezioni urogenitali maggiori, che possono essere facilmente trattate. Una complicazione rara ma grave è la chetoacidosi diabetica euglicemica, che può verificarsi in caso di carenza di insulina e di lunghi periodi di digiuno. Nelle situazioni cliniche elencate nella tabella 3, gli inibitori SGLT2 non devono quindi essere utilizzati o devono essere utilizzati solo con grande cautela o temporaneamente sospesi.

Conclusione
Dopo il blocco del RAS e la terapia dell’acidosi metabolica, da due anni è disponibile una terza misura nefroprotettiva: l’uso degli inibitori SGLT2. Attualmente è approvato solo per i pazienti con nefropatia diabetica (tab. 4). Poiché il meccanismo di nefroprotezione molto probabilmente non ha a che fare con l’influenza sul metabolismo del glucosio, ma con l’effetto diuretico di queste sostanze, si può supporre che funzionino anche nella nefropatia non diabetica. Gli studi corrispondenti sono attualmente in corso.

Messaggi da portare a casa
- L’insufficienza renale cronica ha un decorso progressivo che può essere descritto con la curva di Mitch.
- Per misure nefroprotettive intendiamo interventi che possono rallentare il declino del GFR nel tempo e quindi ritardare l’insufficienza renale allo stadio finale.
- La base di qualsiasi protezione nefrologica è l’uso di inibitori del sistema renina-angiotensina (ACE-inibitori, bloccanti del recettore AT1, inibitori della renina). Questi devono essere dosati in base alla tolleranza, ma non combinati.
- Il trattamento dell’acidosi metabolica con bicarbonato di sodio è nefroprotettivo e deve essere iniziato con un bicarbonato sierico <20 mmol/l.
- L’intervento più recente è l’uso degli inibitori SGLT2 nei pazienti con nefropatia diabetica. Hanno un effetto diuretico sul tubulo prossimale e sono cardio- e nefroprotettivi.
Letteratura:
- Stevens PE, Levin A: Valutazione e gestione della malattia renale cronica: sinossi della linea guida di pratica clinica “Malattia renale: migliorare gli esiti globali” del 2012. Ann Intern Med 2013; 158: 825-830.
- Mitch WE, et al: Un metodo semplice per stimare la progressione dell’insufficienza renale cronica. Lancet 1976; 2: 1326-1328.
- Lewis EJ, et al: L’effetto dell’inibizione dell’enzima di conversione dell’angiotensina sulla nefropatia diabetica. Il Gruppo di Studio Collaborativo. N Engl J Med 1993; 329: 1456-1462.
- Luft FC: Prospettiva sulla terapia combinata di blocco del RAS: off-TARGET, dis-CORD, MAP-to-nowhere, ALTITUDINE bassa e NEPHRON-D. Am J Nephrol 2014; 39: 46-49.
- de Brito-Ashurst I, et al: L’integrazione di bicarbonato rallenta la progressione della CKD e migliora lo stato nutrizionale. J Am Soc Nephrol 2009; 20: 2075-2084.
- Zinman B, et al: Empagliflozin, esiti cardiovascolari e mortalità nel diabete di tipo 2. N Engl J Med 2015; 373: 2117-2128.
- Neal B, et al: Canagliflozin ed eventi cardiovascolari e renali nel diabete di tipo 2. N Engl J Med 2017; 377: 644-657.
- Wanner C, et al: Empagliflozin e la progressione della malattia renale nel diabete di tipo 2. N Engl J Med 2016; 375: 323-334.
- Anders HJ, et al: Protezione del nefrone nella malattia renale diabetica. N Engl J Med 2016; 375: 2096-2098.
PRATICA GP 2018; 13(4): 22-25
CARDIOVASC 2019; 18(5): 6-9