Prima di iniziare la terapia, i pazienti affetti da GIST devono essere discussi in un comitato tumori interdisciplinare. Per il rischio di recidiva da intermedio ad alto, si deve prendere in considerazione la terapia adiuvante con imatinib dopo la resezione. I pazienti con GIST metastatico beneficiano degli inibitori della tirosin-chinasi e degli interventi locali.
Il tumore stromale gastrointestinale (GIST) è un’entità tumorale mesenchimale del tratto gastrointestinale o – molto più raramente – dei tessuti molli intra-addominali. Si presume che le cosiddette cellule di Cajal siano le cellule di origine. Queste cellule muscolari specializzate si trovano nel plesso mesenterico e hanno una funzione di pacemaker per quanto riguarda la contrazione peristaltica. I GIST possono verificarsi lungo l’intero tratto gastrointestinale – ma si trovano più comunemente nello stomaco (50%) e nell’intestino tenue (30-35%), molto meno comunemente nel colon/retto (5%) o nell’esofago (<1%). I GIST che insorgono nell’omento, nel mesentere o nel retroperitoneo sono chiamati E-GIST (extra-gastrointestinali) e sono una rarità.
L’incidenza annuale del GIST è riportata in letteratura come circa dieci casi per milione di popolazione. Se si includono anche i cosiddetti micro-GIST (tumore GIST <1 cm), che si trovano in modo autoptico in un massimo del 20% dei pazienti di età superiore ai 50 anni nell’area dello stomaco/giunzione gastro-esofagea, allora la cifra è molto più alta. Tuttavia, i micro-GIST hanno un potenziale di malignità estremamente basso e rappresentano quindi un sottogruppo separato, clinicamente irrilevante.
Diagnosi e stadiazione
La maggior parte dei pazienti con diagnosi di GIST è sintomatica della malattia tumorale. Classicamente, riferiscono sanguinamento gastrointestinale, dolore addominale, nausea, vomito o irregolarità delle feci. Tuttavia, a causa dell’aumento dell’uso dell’imaging nel contesto di altre domande, fino al 25% dei casi viene rilevato un GIST in pazienti completamente asintomatici.
In definitiva, la diagnosi di GIST può essere fatta solo sulla base di un’istologia tipica. Dal punto di vista istologico, una biopsia ottenuta per via endoscopica è chiaramente preferibile a una biopsia percutanea. La positività per CD117 e DOG1 distingue un GIST da altri tumori mesenchimali o da un carcinoma mesenchimale in crescita o da un melanoma (Fig. 1).
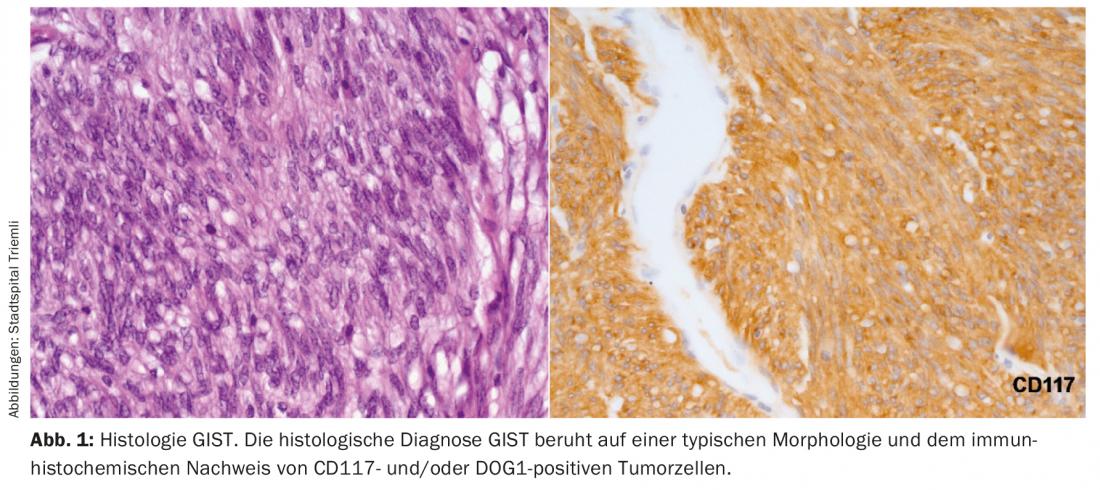
Le metastasi da GIST si sviluppano tipicamente nel fegato, nell’omento o nel peritoneo. Le metastasi al di fuori dell’addome si vedono solo in caso di malattia avanzata, già trattata in modo intensivo. Pertanto, come esame di stadiazione iniziale, si dovrebbe eseguire almeno una TAC addome/pelvi con contrasto o una risonanza magnetica dell’addome.
Patologia molecolare
Il 75% dei pazienti con GIST presenta una mutazione del gene c-Kit, in genere nell’esone 11 o 9. La seconda alterazione molecolare più comune (10%) è una mutazione nel gene PDGFR. Tutti questi cambiamenti portano a una continua attivazione delle cellule. Se non è possibile rilevare né una mutazione c-KIT né una mutazione PDGFR, si parla di un cosiddetto GIST di tipo selvaggio, anche se la sua definizione è attualmente in evoluzione. Tuttavia, spesso si riscontrano cambiamenti nei geni BRAF, RAS e SDH-A-D. I GIST di tipo selvaggio si vedono tipicamente in associazione con la neurofibromatosi, la triade di Carney o la sindrome di Carney-Stratakis.
GIST localizzato non metastatico
Il GIST localizzato non metastatico deve essere resecato quando possibile. La resezione completa è l’unica terapia curativa.
I tumori <2 cm possono in alternativa essere monitorati endosonograficamente e resecati solo se le dimensioni progrediscono.
Resezione
L’obiettivo primario della resezione chirurgica curativa di un GIST è ottenere una situazione R0 (nessun residuo tumorale macroscopico o microscopico al margine dell’incisione). La resezione R0 si ottiene solitamente se si mantiene una distanza di sicurezza di 1-2 cm dal tumore. L’estensione dell’intervento chirurgico dipende fortemente dalle dimensioni e dalla posizione del GIST. Un GIST di piccole o medie dimensioni nel corpo dello stomaco può spesso essere rimosso con una semplice resezione gastrica parziale in laparoscopia. Tuttavia, se il GIST è localizzato nel duodeno, ad esempio, potrebbe essere necessario estendere l’estensione della resezione a una duodenopancreatectomia Whippel. A differenza della maggior parte degli altri tumori maligni del tratto gastrointestinale (ad esempio, adenocarcinoma, tumori neuroendocrini), la resezione di un GIST non richiede la dissezione linfonodale locoregionale a causa della rarità delle metastasi linfonodali (prevalenza <1%). Solo nei rari GIST pediatrici o nei giovani adulti (<40 anni) il rischio di metastasi linfonodali è significativamente più alto (20-59%), il che può naturalmente influenzare la tattica chirurgica. In linea di principio, si punta a una resezione laparoscopica, se possibile, grazie al recupero più rapido. Tuttavia, la capsula tumorale non deve mai rompersi durante l’asportazione, poiché questo porterebbe alla semina peritoneale delle cellule tumorali, che di solito si tradurrebbe in una situazione tumorale palliativa. I GIST di grandi dimensioni, in particolare, hanno spesso una capsula molto morbida e fragile, che può rompersi rapidamente se maneggiata in modo incauto (in laparoscopia). Pertanto, i vantaggi della resezione laparoscopica devono sempre essere ben soppesati rispetto ai rischi di rottura del tumore nel corso di una “laparoscopia acrobatica di alto livello”, soprattutto nel caso di tumori di grandi dimensioni.
Terapia adiuvante
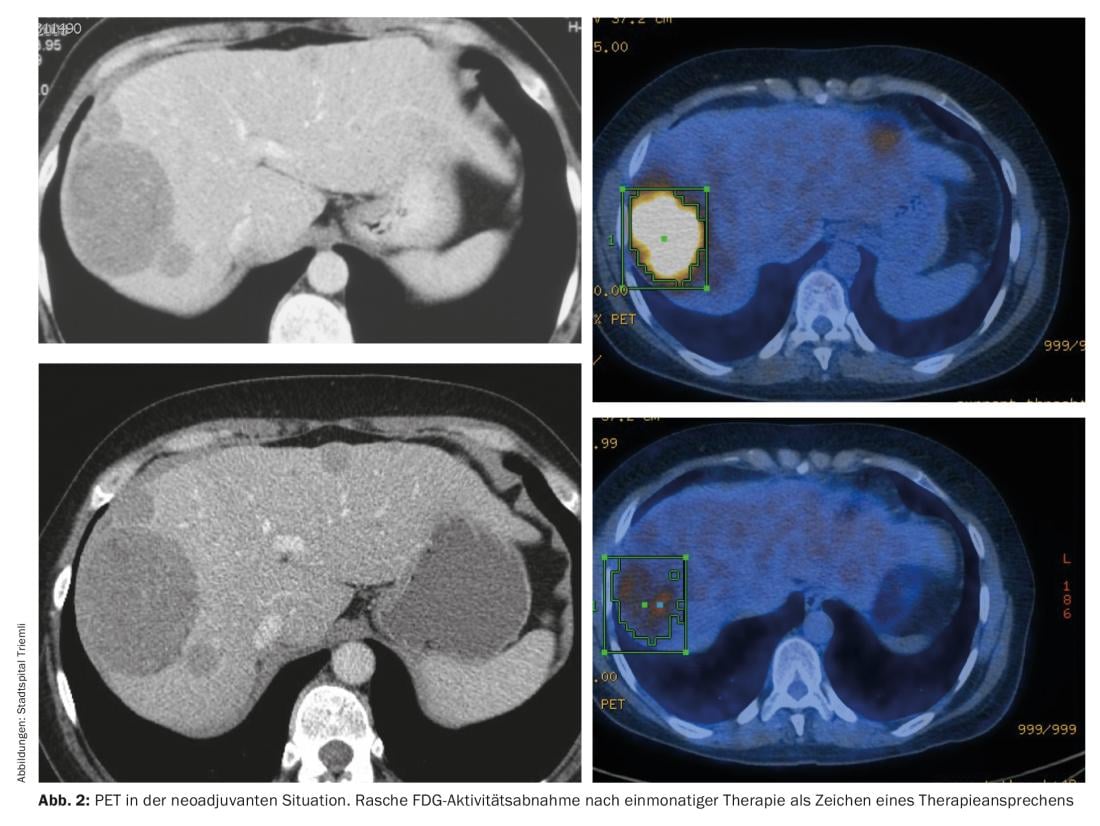
Nonostante il successo della resezione R0, i pazienti possono sviluppare metastasi nel tempo. Il rischio di sviluppare metastasi dipende principalmente dall’indice mitotico, dalle dimensioni del tumore e dalla localizzazione nel tratto gastrointestinale – questi fattori sono registrati nel cosiddetto indice di Miettinen (Tab. 1) [1]. Le tabelle di ricaduta sviluppate da Heikki Joensuu [2] sono classificate più finemente e quindi riflettono meglio il rischio individuale di ricaduta. Tutti gli studi che hanno analizzato il beneficio della terapia adiuvante hanno utilizzato l’inibitore della tirosin-chinasi (TKI) imatinib. I criteri di inclusione e la durata della terapia variavano da studio a studio. Sulla base dei dati dello studio SSGXVIII/AIO [3], che ha mostrato un beneficio di sopravvivenza di tre anni rispetto a un anno di terapia con imatinib, oggi si raccomanda una durata della terapia di tre anni. Attualmente si sta studiando se sia utile o meno una durata della terapia più lunga (per un totale di cinque o sei anni). Mentre lo studio SSGXVIII/AIO includeva solo pazienti con criteri di “alto rischio” – in base al consenso NIH modificato applicato all’epoca – oggi ai pazienti con un rischio di recidiva da moderato ad alto viene offerta una terapia adiuvante, secondo Miettinen. Soprattutto nei pazienti con un rischio moderato, è importante confrontare i benefici con gli effetti collaterali (come mucosite, crampi muscolari, nausea) in una discussione. A differenza degli studi, ora si raccomanda un’analisi delle mutazioni all’inizio della terapia. Se è presente una mutazione insensibile all’imatinib, ad esempio PDGFR D842V, una terapia così costosa e anche onerosa non ha senso. Attualmente non è chiaro se i pazienti con una mutazione dell’esone 9 beneficino anche di una dose di imatinib più elevata (800 mg/d) in un contesto adiuvante, in analogia con i dati del contesto palliativo. Tuttavia, l’esperienza ha dimostrato che una dose di 800 mg/d non può essere continuata per un periodo di tempo più lungo, a causa della tossicità associata.
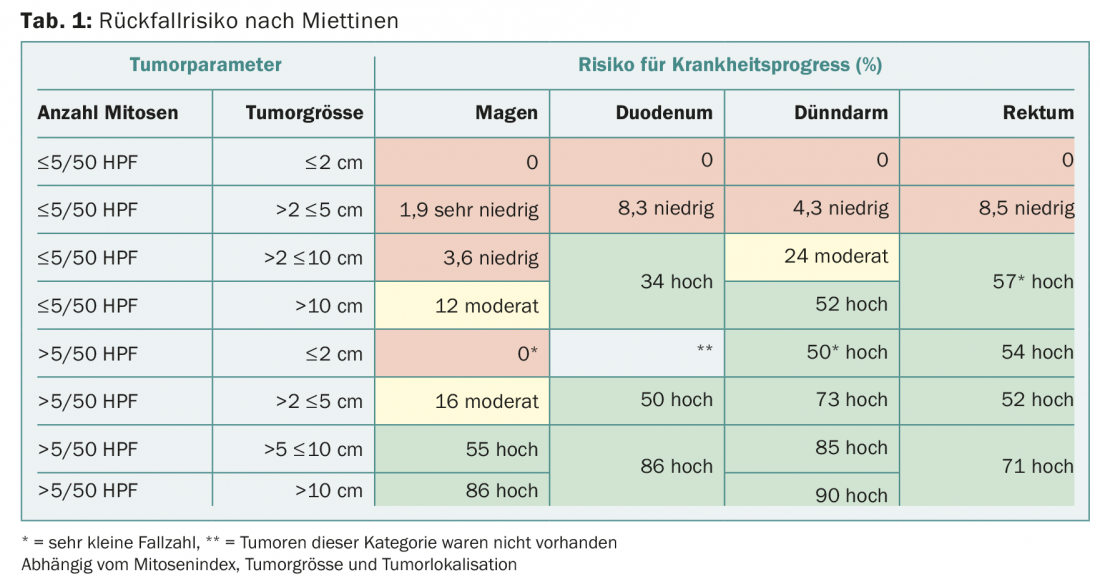
Terapia neoadiuvante
Per i tumori localmente avanzati, l’opzione della terapia neoadiuvante deve essere sempre discussa in seno al comitato interdisciplinare per i tumori, soprattutto se è necessario un intervento chirurgico mutilante per la resezione completa. I prerequisiti per la terapia neoadiuvante sono una diagnosi istologicamente accertata di GIST e la presenza di una mutazione sensibile a imatinib. Si raccomanda una stretta sorveglianza per evitare una progressione indesiderata. Utilizzando la PET, si può fare una dichiarazione sulla risposta già un mese dopo l’inizio della terapia (Fig. 2).
La durata ottimale della terapia neoadiuvante non è chiara, ma la maggior parte della letteratura indica da sei a nove mesi [4].
Cura successiva
Dopo l’intervento chirurgico, così come durante e dopo la terapia adiuvante, si raccomandano esami clinici e di imaging regolari. Purtroppo, non esiste uno schema di follow-up basato sulle prove. Nei primi due anni dopo l’intervento chirurgico o dopo l’interruzione della terapia adiuvante, eseguiamo l’imaging addominale ogni tre-sei mesi – nei periodi di minor rischio di recidiva (durante la terapia adiuvante in corso; da tre a cinque anni dopo l’intervento chirurgico o dopo l’interruzione della terapia con imatinib) solo ogni sei-dodici mesi. A causa dell’imaging seriale e dell’esposizione alle radiazioni associata, la risonanza magnetica è preferibile alla TAC, soprattutto nei pazienti giovani.
GIST metastatico, non resecabile
Terapia farmacologica: grazie all’uso dei TKI, la prognosi dei pazienti con GIST metastatico è migliorata in modo significativo, passando da una media di dieci a circa 55 mesi. Se è presente una mutazione sensibile a imatinib, imatinib 400 mg/d è la terapia di prima linea di scelta. Nei pazienti con una mutazione dell’esone 9, si raccomanda principalmente un dosaggio di 800 mg/d, sulla base dei dati meta-GIST [5]. In caso di progressione, sono disponibili i TKI sunitinib [6] e regorafenib [7], che sono stati studiati in studi di fase III. Spesso, i pazienti sono ancora in buone condizioni generali dopo aver affrontato tutte e tre le linee di terapia stabilite (imatinib, sunitinib, regorafenib), quindi si vorrebbe offrire loro una terapia efficace. A meno che non possano essere inclusi in uno studio, un nuovo test con imatinib ha certamente senso, anche se il beneficio in termini di PFS è stato molto limitato rispetto al placebo nello studio RIGHT. Meccanicamente, si presume che i cloni sensibili all’imatinib, resistenti alle precedenti terapie con TKI, abbiano avuto la meglio. Sebbene questo effetto sia stato studiato solo per l’imatinib, probabilmente può essere estrapolato agli altri TKI.
Altri TKI, come pazopanib [8] o ponatinib [9], sono stati confrontati solo in studi di fase II con la “migliore terapia di supporto”. Hanno portato a un prolungamento significativo, ma purtroppo molto limitato, della PFS. In primo luogo, hanno stabilizzato la malattia. Una risposta chiara, nel senso di una risposta parziale o completa, purtroppo si è vista solo raramente. I ricercatori ripongono quindi le loro speranze in altre sostanze, come cabozantinib o l’inibitore del checkpoint nivolumab.
Un approccio di studio completamente diverso, ma molto interessante, è quello di trattare i pazienti con GIST con citostatici convenzionali, come la doxorubicina o il paclitaxel, dopo anni di terapia con TKI. La speranza è che il GIST, che in passato era resistente alla chemioterapia, sia cambiato così tanto grazie alla lunga terapia con TKI da essere ora sensibile alla chemioterapia.
Anche se i TKI imatinib, sunitinib e regorafenib sono le cosiddette “terapie mirate”, purtroppo nel tempo si verificano tossicità relativamente considerevoli. Con sunitinib, il 20% dei pazienti ha sviluppato tossicità di grado III (principalmente affaticamento, sindrome mano-piede), con regorafenib addirittura fino al 60% (ipertensione, sindrome mano-piede). Per contrastare questi effetti collaterali in fase iniziale, è necessaria una valutazione regolare da parte del medico o dell’infermiere. Allo stesso modo, i pazienti devono essere informati del problema della compliance ai farmaci e delle interazioni.
Quando un paziente con malattia GIST è sottoposto a terapia sistemica, il comportamento terapeutico deve essere valutato clinicamente e radiologicamente a intervalli regolari. Mentre i colleghi radiologi utilizzano i criteri RECIST per la valutazione della terapia nella maggior parte delle entità tumorali, i criteri Choi devono essere utilizzati per i pazienti affetti da GIST. Questi includono anche la densità del tumore nella valutazione e quindi riflettono meglio il comportamento biologico del GIST [10].
Terapia non farmacologica: se il paziente mostra una progressione, è utile una valutazione interdisciplinare. Ciò significa che, oltre alle opzioni mediche, vengono sfruttate appieno anche le opzioni chirurgiche. Soprattutto se c’è una progressione focale e lo sviluppo di resistenza di singole metastasi alla terapia farmacologica, si dovrebbe discutere anche la resezione di queste metastasi resistenti alla terapia. La tomografia computerizzata FDG-PET è uno strumento diagnostico utile per localizzare la progressione focale. La resezione di queste metastasi focalmente resistenti alla terapia può evitare un’ulteriore escalation di farmaci in alcuni pazienti. Altrimenti, la resezione chirurgica delle metastasi è indicata solo in caso di complicazioni sintomatiche (dolore, ostruzione intestinale o emorragia gastrointestinale). In alternativa alla resezione chirurgica palliativa di singole metastasi, si deve prendere in considerazione l’uso di altri metodi ablativi a livello locale, come la radioterapia stereotassica o la radiofrequenza o la radioterapia. Si dovrebbe prendere in considerazione l’ablazione a microonde.
Messaggi da portare a casa
- I pazienti con diagnosi di GIST devono sempre essere discussi in un comitato tumori interdisciplinare prima di iniziare la terapia.
- Per i GIST con rischio di recidiva da intermedio ad alto, la terapia adiuvante con imatinib deve essere valutata con il paziente dopo una resezione riuscita.
- I pazienti con GIST metastatico beneficiano non solo degli inibitori della tirosin-chinasi imatinib, sunitinib e regorafenib, che sono approvati in Svizzera e sono coperti dall’assicurazione sanitaria, ma anche di misure locali come la chirurgia, la RFA o la radioterapia.
Letteratura:
- Miettinen M, et al: Seminari di Patologia Diagnostica 2006; 23: 70-83.
- Joensuu H, et al: Lancet Oncology 2012; 13: 265-274.
- Joensuu H, et al: JAMA 2012; 307(12): 1265-1272.
- Rutkowski P, et al: Ann Surg Oncol 2013; 20: 2937-2943.
- Gruppo di meta-analisi del tumore stromale gastrointestinale: JCO 2010; 28: 1247-1253.
- Demetri G, et al: Lancet 2006; 368: 1329-1338.
- Demetri G, et al: Lancet 2013; 381: 295-302.
- Mir O, et al: Lancet Oncol 2016; 17: 632-641.
- Heinrich M, et al: J Clin Oncol 2015; abstract 10535.
- Benjamin RS, et al: J Clin Oncol 2007; 25(13): 1760-1764.
InFo ONCOLOGIA & EMATOLOGIA 2017; 5(3): 24-28











