La BPCO è considerata una malattia prevenibile e curabile, ma questo è vero solo in parte. Il fumo di sigaretta è il fattore di rischio più comunemente identificato e prevenibile in questo Paese – ma in molte coorti di pazienti, tra cui la Svizzera, un terzo o anche più sono non fumatori [1]. I fattori occupazionali e ambientali possono avere un ruolo. La diagnosi di BPCO si basa sull’ostruzione delle vie aeree, definita come un rapporto (dopo la broncodilatazione con farmaci) di FEV1/FVC inferiore a 0,7 [2]. Sebbene questo cut-off sia stato messo in discussione e siano stati invece diffusi limiti inferiori dipendenti dall’età (LLN, “limiti inferiori di normalità”), questo continua ad essere valido. Il seguente articolo fornisce una panoramica aggiornata sulla diagnosi e sul trattamento della BPCO.
Si ritiene che 330 milioni di persone nel mondo siano affette da BPCO e che solo un quarto di loro riceva una diagnosi. Entro il 2020, gli epidemiologi prevedono che la BPCO sarà la terza malattia mortale più diffusa nei Paesi occidentali [3]. Una strategia globale per la diagnosi, la gestione e la prevenzione della BPCO si trova anche nel Sommario esecutivo GOLD [4].
Diagnosi e valutazione
Anamnesi, clinica e spirometria pratica: i sintomi tipici sono dispnea, tosse cronica e produzione di espettorato. Spesso si raccomanda di eseguire una spirometria in ufficio nei pazienti di età superiore ai 40 anni a rischio aumentato, con o senza sintomi [5]. Questo è semplice e permette di diagnosticare la BPCO e di classificarla nei livelli di gravità I-IV (lieve, moderata, grave e molto grave), come raccomandato dal Comitato dell’Iniziativa Globale per la Malattia Polmonare Cronica Ostruttiva (GOLD) nel primo Rapporto di Consenso del 2001. Finora, non ci sono le basi per uno screening generale.
L’attuale strategia GOLD: negli anni successivi, si è scoperto che l’ostruzione delle vie aeree è correlata solo in modo condizionale con vari problemi di salute e conseguenze per i pazienti, e si è reso necessario un approccio più completo per catturare diversi fenotipi [6].
Sebbene un orientamento completamente nuovo di un sistema di classificazione valido solo da pochi anni non sia facile da comunicare, la categorizzazione in quattro gruppi di rischio (A, B, C, D) mostra anche chiari vantaggi: La classificazione si basa ancora sulla gravità dell’ostruzione, ma ora si tiene conto anche della gravità dei sintomi e della frequenza delle esacerbazioni. Quindi, la mortalità più bassa si trova nella categoria A, la più alta nella categoria D, e un tasso comparabile nelle categorie B e C. Questo vale anche per la frequenza dei ricoveri, ma le esacerbazioni aumentano continuamente da A a D. Le comorbilità sono (senza sorpresa) più frequenti nelle categorie B e D, più sintomatiche. Anche questa classificazione attuale non sarà perfetta, poiché i pazienti affetti da BPCO si manifestano in modo troppo eterogeneo, ad esempio con o senza enfisema concomitante, con diversi modelli di infiammazione, disturbi dello scambio gassoso, reperti aggiuntivi rilevabili radiologicamente e molto altro ancora [2].
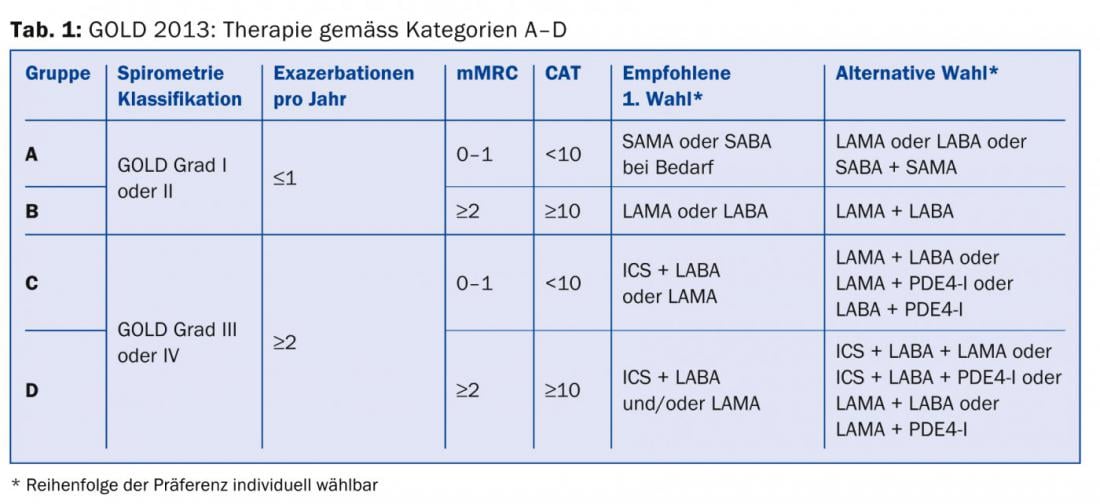
Sebbene le linee guida svizzere pubblicate di recente non abbiano adottato questa nuova classificazione [7], almeno in qualità di pneumologo non si potrà fare a meno di adottarla.

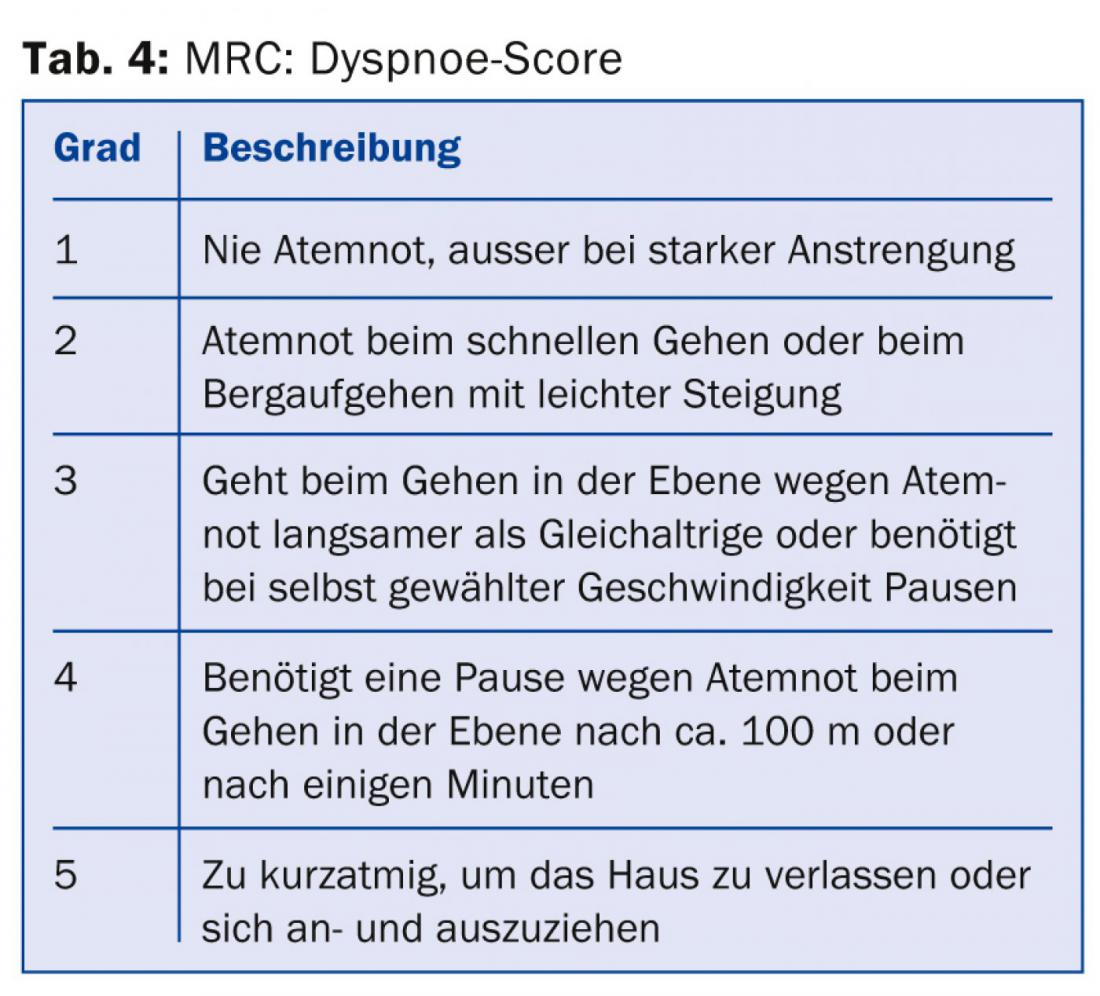
Tutti i medici che trattano i pazienti con BPCO dovrebbero almeno essere consapevoli che, oltre alla gravità dell’ostruzione delle vie aeree, la gravità dei sintomi e la frequenza delle esacerbazioni [8] dovrebbero essere incluse nella stratificazione del rischio e nel piano di trattamento. Le informazioni necessarie per la categorizzazione e la raccomandazione della terapia (tab. 1) possono essere raccolte dalla funzione polmonare (tab. 2), dal punteggio CAT (tab. 3), dal punteggio dispnea (tab. 4) e dalla storia delle esacerbazioni.
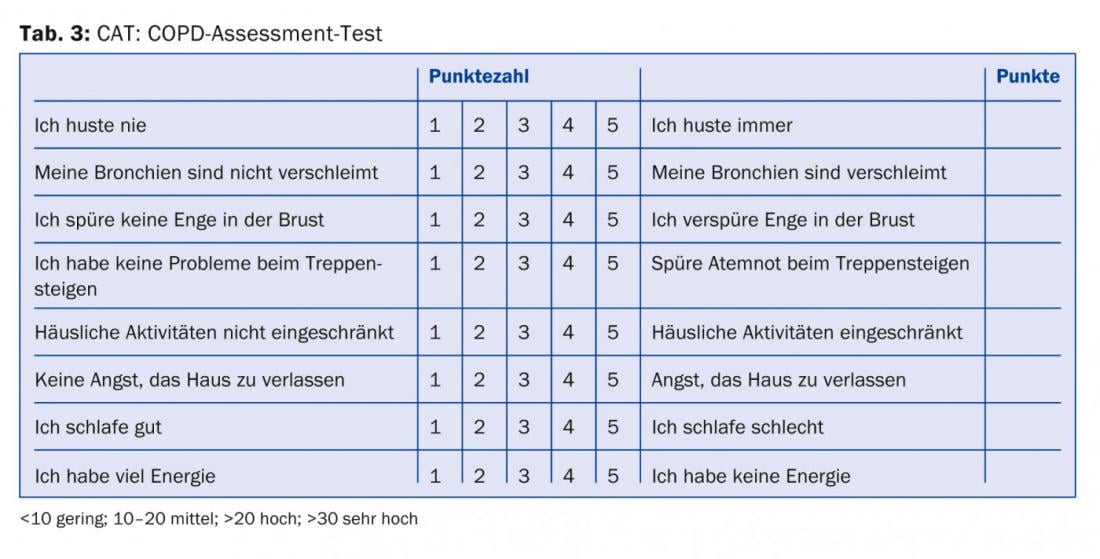
L’esperienza dimostra che spesso i pazienti non vengono trattati secondo le linee guida [9]. Questo può avere ragioni individuali, e spesso le raccomandazioni vengono pubblicate prima che sia stata dimostrata la loro superiorità rispetto a una pratica precedente. Tuttavia, con un trattamento conforme alle linee guida ci si può aspettare un risparmio sui costi e forse anche l’evitamento degli effetti collaterali. I trattamenti polipragmatici e l’uso “senza concetto” di tutti i farmaci possibili, a volte con diverse sostanze dello stesso gruppo di principi attivi, riflettono da un lato un effetto limitato e sintomi persistenti nonostante il trattamento, ma dall’altro anche una gestione non sufficientemente chiara del paziente da parte del medico.
Opzioni terapeutiche
La maggior parte delle opzioni terapeutiche non prolungano la vita e hanno un effetto minimo o nullo sulla progressione della malattia. Tuttavia, l’interesse delle aziende farmaceutiche per questa malattia è alto, probabilmente anche a causa dell’immenso numero di pazienti e del gran numero di casi non ancora diagnosticati. Diversi nuovi farmaci e combinazioni sono attualmente in fase di lancio o stanno per esserlo. Tuttavia, non ci si deve aspettare immediatamente un cambiamento fondamentale nella gravità e nella prognosi della BPCO, ma si parla piuttosto di differenze graduali nell’insorgenza dell’effetto, nella forza dell’effetto e nel miglioramento di endpoint aggiuntivi come le prestazioni di resistenza o il “trough FEV1” (capacità del primo secondo alla fine dell’intervallo di dosaggio). Ma anche la facilità d’uso dei dispositivi di inalazione viene costantemente migliorata. Da parte loro, i sostenitori delle sostanze presenti sul mercato da più tempo evidenziano i dati con un ampio numero di casi sulla sicurezza del trattamento e sui benefici clinici dimostrati.
Terapie farmacologiche
Broncodilatatori e steroidi inalabili: i bron codilatatori a lunga durata d’azione (beta-agonisti a lunga durata d’azione [LABA] e agonisti antimuscarinici a lunga durata d’azione [LAMA]) sono il pilastro del trattamento farmacologico. Anche se questo migliora solo leggermente la capacità di primo secondo, la diminuzione dell’iperinflazione, gli effetti antinfiammatori e immunomodulatori portano comunque a una diminuzione della dispnea, al miglioramento dei sintomi, alla prevenzione delle esacerbazioni, al miglioramento della qualità della vita e alla riduzione della necessità di farmaci di “soccorso” [10,11]. L’uso combinato di LABA/LAMA e steroidi topici per via inalatoria (ICS) è raccomandato nei pazienti con esacerbazioni frequenti e/o con una gravità di ostruzione bronchiale GOLD III o superiore. In pratica, gli ICS vengono prescritti troppo frequentemente [12]. L’evitamento delle esacerbazioni è compensato da un aumento precedentemente sottostimato della polmonite dovuta all’uso di ICS [13].
Altre terapie antinfiammatorie: La N-acetilcisteina, comunemente prescritta, probabilmente non ha alcun effetto terapeutico o prognostico nella terapia della BPCO. Una nuova sostanza efficace è l’inibitore della fosfodiesterasi-4, il roflumilast. Con questa sostanza, le esacerbazioni possono essere evitate soprattutto nei pazienti con un “fenotipo bronchitico” [14]. Tuttavia, solo le esacerbazioni moderatamente gravi possono apparentemente essere prevenute in modo significativo; non sono ancora stati dimostrati i vantaggi in termini di qualità della vita e di mortalità.

Altre opzioni di trattamento
Riabilitazione: i pazienti con BPCO in genere traggono beneficio dall’allenamento fisico. Le offerte di programma per la terapia di formazione medica (MTT) sono disponibili sul sito www.pneumo.ch. La MTT eseguita in regime ambulatoriale o ospedaliero migliora significativamente la dispnea, la resistenza, la qualità della vita e riduce i ricoveri ospedalieri dovuti alle esacerbazioni [15].
Ossigeno: l’ ossigeno può essere utilizzato a livello prognostico per motivi palliativi o nei casi di ipossiemia e ipertensione polmonare. I pazienti mobili traggono il massimo beneficio dall’ossigeno liquido ambulatoriale. I pazienti potenzialmente idonei al trattamento con ossigeno a lungo termine dovrebbero essere identificati dai medici di base e indirizzati agli pneumologi per la titolazione, la prescrizione e il monitoraggio [16].
Intervento chirurgico: la riduzione chirurgica del volume polmonare (LVR) viene presa in considerazione per i pazienti che presentano un’angoscia significativa e limitazioni in caso di sforzo ridotto, iperinflazione grave ed enfisema prevalentemente eterogeneo. Con una selezione corretta, si può addirittura prevedere un vantaggio di sopravvivenza [17]. La procedura può essere eseguita con un rischio accettabile, ma è comunque necessaria un’astinenza controllata dal tabacco. Il trapianto di polmone rimane l’ultima risorsa.
LVR endoscopica: la riduzione del volume polmonare può essere ottenuta anche con procedure parzialmente endoscopiche, relativamente semplici e a basso stress (uso di valvole o bobine). La selezione dei pazienti è fondamentale in questo caso; solo pochi centri hanno un’esperienza sufficiente e risultati controllati finora [18].
Strategie di coping (“gestione della malattia”): La formazione specifica per la malattia si svolge spesso nel contesto della MTT. I medici di base sono chiamati a formare i pazienti a riconoscere un’esacerbazione, a sviluppare un piano di emergenza e ad aiutare a interrompere la spirale negativa di malattia, ansia, isolamento e depressione [19].
Vaccinazioni: La vaccinazione antinfluenzale riduce i tassi di esacerbazione e, soprattutto nei pazienti più anziani, l’ospedalizzazione e la mortalità. Dovrebbe essere fatto ogni anno. Le raccomandazioni per la vaccinazione pneumococcica polivalente sono state recentemente messe in discussione. Le vaccinazioni di richiamo con il vaccino 23-valente (PPV 23) non sono attualmente raccomandate. Il programma di vaccinazione svizzero prevede attualmente una singola dose di vaccino pneumococcico 13-valente (PCV-13) per le persone a maggior rischio di complicanze da malattia pneumococcica. Questa vaccinazione deve essere somministrata a un intervallo minimo di quattro settimane da una vaccinazione antinfluenzale. Attualmente, tuttavia, i costi della vaccinazione contro lo pneumococco sono coperti solo per i bambini fino a cinque anni di età.
Esacerbazioni acute
Le esacerbazioni acute, le complicanze più comuni nella pratica, sono definite da un aumento persistente della dispnea, della tosse o della produzione di espettorato. Il trattamento comprende un aumento dei farmaci inalatori, corticosteroidi orali, che possono essere utilizzati al massimo per un periodo più breve rispetto a prima (solo per cinque giorni) a una dose di 50 mg di prednisone equivalente [20], e antibiotici in caso di aumento della purulenza dell’espettorato.
Controversie
Le aspettative che la farmacoterapia possa rallentare il decorso della BPCO rimangono finora insoddisfatte. Non è chiaro se l’uso precoce di inalatori possa arrestare la perdita della funzione polmonare, o se le terapie combinate composte da LABA + LAMA + ICS siano vantaggiose per i pazienti. L’uso dell’ICS dovrà essere ulteriormente messo in discussione. Il rapporto rischio-beneficio è stato probabilmente giudicato troppo favorevole finora. In futuro, si attribuirà maggiore importanza al trattamento delle comorbidità e a una terapia che sia il più possibile adattata al fenotipo.
Prof. Dr. med. Robert Thurnheer
Letteratura:
1. Ackermann-Liebrich U, et al: American journal of respiratory and critical care medicine 1997; 155: 122-129.
Iniziativa Globale per la Malattia Polmonare Cronica Ostruttiva, aggiornato al 2014.
Halbert RJ, et al: ERJ 2006; 28: 523-532.
4. Vestbo J, et al: American journal of respiratory and critical care medicine 2013; 187: 347-365.
Rothe T: Praxis 2012; 101: 1481-1487.
6. Vestbo J: Clinics in chest medicine 2014; 35: 1-6.
7 Russi EW, et al: Respiration 2013; 85: 160-174.
8. Aaron SD: American journal of respiratory and critical care medicine 2009; 179: 335-336.
9. Fritsch K, et al: Swiss medical weekly 2005; 135: 116-121.
10. Calverley PM, et al: NEJM 2007; 356: 775-789.
11 Tashkin DP, et al: NEJM 2008; 359: 1543-1554.
12. Jochmann A, et al: Swiss medical weekly 2012; 142: w13567.
13 Suissa S, et al: Lancet 2009; 374: 695-703.
15 Casaburi R, ZuWallack R: NEJM 2009; 360: 1329-1335.
16 Calverley PM: Thorax 2000; 55: 537-538.
17 Meyers BF, et al: Annali di chirurgia toracica 2001; 71: 2081.
18 Herth FJ, et al: Respiration 2010; 79: 5-13.
19. Bourbeau J: Copd 2011; 8: 143-144.
20 Leuppi JD, et al: JAMA 2013; 309: 2223-2231.
CONCLUSIONE PER LA PRATICA
- Sebbene non sia ancora stata raggiunta una grande svolta nel trattamento della BPCO, una nuova comprensione della malattia ha contribuito a una varietà di interventi possibili e a un cambiamento evidente.
- Spesso i pazienti non vengono trattati secondo le linee guida.
- I dispositivi di inalazione stanno diventando sempre più facili da usare.
- I pazienti con BPCO in genere traggono beneficio dall’esercizio fisico.
- La farmacoterapia non è ancora riuscita a rallentare il decorso della BPCO.
PRATICA GP 2014; 9(8): 18-21