Le raccomandazioni delle linee guida per il trattamento chirurgico della fibrillazione atriale (FA) variano e spesso il successo del trattamento è strettamente legato all’esperienza dell’ospedale curante, alle co-morbilità del paziente e all’intenso scambio interdisciplinare tra elettrofisiologi e cardiochirurghi. Inoltre, sembra che non ci sia consenso tra i cardiochirurghi per quanto riguarda l’indicazione, la tecnica chirurgica e la cura post-operatoria. Dal 2009, l’Inselspital ha introdotto un nuovo algoritmo per il trattamento chirurgico della VCF in collaborazione interdisciplinare, che include un concetto uniforme per l’indicazione, la tecnica intraoperatoria, la cura post-operatoria e il follow-up.
La fibrillazione atriale (FA) è l’aritmia cardiaca più comune. Solo nel mondo occidentale, circa l’1% della popolazione soffre di VCF. L’incidenza aumenta con l’età [1, 2]. Il rischio di VCF aumenta notevolmente con la gravità della malattia cardiaca esistente. Per esempio, è stata riscontrata una prevalenza del 4% nello stadio NYHA I dell’insufficienza cardiaca, una prevalenza di circa il 25% negli stadi NYHA II e III, e fino al 50% nello stadio NYHA IV.
La mortalità è circa il doppio nei soggetti con VHF rispetto ai coetanei con ritmo sinusale, ma ciò è dovuto principalmente o esclusivamente alle patologie cardiache più frequenti. In media, circa il 6% dei pazienti con VCF ha un ictus ogni anno, e il 15-20% di tutti gli ictus sono associati alla VCF. L’indagine Euro Heart Survey per la VCF ha identificato il numero crescente di ricoveri ospedalieri e l’aumento delle procedure interventistiche come i principali fattori di costo economico della VCF. L’interesse per lo sviluppo di approcci di successo al trattamento della VCF che promuovano la prevenzione primaria o secondaria è quindi giustificato [3].
Entrambi gli studi AFFIRM e RACE hanno dimostrato che nei pazienti anziani, poco sintomatici, una terapia farmacologica di puro controllo del ritmo combinata con l’anticoagulazione orale è equivalente a una terapia di controllo del ritmo in termini di mortalità. Tuttavia, meno del 30% dei pazienti può essere trattato con farmaci o terapia elettrica. Inoltre, i farmaci antiaritmici mostrano spesso un successo moderato a lungo termine, nel migliore dei casi, e spesso hanno effetti collaterali indesiderati. Al contrario, l’ablazione interventistica o con catetere a radiofrequenza ha dimostrato di essere una terapia efficace per la VCF sintomatica ricorrente e refrattaria ai farmaci [5]. Tuttavia, con la procedura del catetere, i tassi di successo per la VCF parossistica si aggirano intorno al 60-80% quando viene utilizzata per la prima volta; il 30-40% dei pazienti necessita di almeno un secondo intervento [6–8]. Tuttavia, i tassi di successo a lungo termine continuano a diminuire nel corso degli anni: la sopravvivenza senza aritmia è riportata solo nel 29-53% dei pazienti [9–11]. Per i pazienti con VCF persistente, il pendolo non oscilla a favore dell’ablazione interventistica, poiché di solito sono necessarie ablazioni ripetute ed estese [12–14]. Dati i limiti delle terapie farmacologiche e interventistiche, l’ablazione chirurgica della VCF sta diventando sempre più importante.
VCF: sviluppo del trattamento chirurgico
Nel 1980, Williams et al. [15], cinque anni dopo Guiraudon et al. [16] i primi trattamenti chirurgici per la VCF. Questi metodi cercavano di incanalare i percorsi elettrici mediante incisioni nell’atrio sinistro, in modo da garantire una conduzione regolare nei ventricoli. Entrambi i metodi sono falliti perché porzioni più ampie degli atri continuavano a mostrare la VCF e quindi non si poteva garantire il trasporto atriale e il rischio di tromboembolia rimaneva invariato.
Nel 1991, Cox [17] ha presentato la prima cosiddetta operazione labirinto (Cox-Maze I). Il concetto si basa su due presupposti:
- Il frazionamento del tessuto atriale in piccoli segmenti evita i ‘rientri’ multipli.
- Tuttavia, questi piccoli segmenti devono essere comunque collegati per consentire la depolarizzazione di una quantità sufficiente di tessuto miocardico.
Ferguson e Cox [18] hanno definito cinque obiettivi del trattamento chirurgico della VCF: eliminazione della VCF, ripristino del ritmo sinusale, sincronia atrio-ventricolare, conservazione della funzione di trasporto atriale e prevenzione dell’ictus.
Utilizzando l’intervento Cox-MAZE III, più avanzato, il ritmo sinusale viene raggiunto nel 75-98% dei casi e la funzione di trasporto viene ripristinata nell’81-86%. Il follow-up a 10 anni mostra un’incidenza di ictus di <1%. L’effetto sul tasso di sopravvivenza non è ancora chiaro. Tuttavia, il processo richiede tempo e pratica. Oggi è possibile imitare l’originale frammentazione atriale complessa dell’intervento Cox-Maze III con uno sforzo minore, utilizzando varie fonti di energia ipertermiche o ipotermiche (soprattutto l’ablazione con radiofrequenza). Le percentuali di successo di questo metodo – chiamato ablazione chirurgica o Cox-Maze-IV – mostrano risultati comparabilmente buoni: Nel 70-98% dei casi, tuttavia, il ritmo sinusale si verifica con una singola procedura [19–29], a seconda dell’esito a breve o a lungo termine.
Linee guida
Le raccomandazioni per il trattamento chirurgico della VCF variano. L’unico studio randomizzato che ha confrontato l’ablazione chirurgica con quella interventistica con catetere ha mostrato una maggiore libertà da aritmie atriali un anno dopo l’intervento chirurgico, ma un tasso di complicanze più elevato rispetto al metodo catetere-tecnico [30]. L’esperienza dell’ospedale curante, le comorbilità e i desideri del paziente e un intenso scambio interdisciplinare tra elettrofisiologi e cardiochirurghi fanno parte della decisione terapeutica.
Le linee guida della Società Europea di Cardiologia (ESC) del 2010 per il trattamento della VCF raccomandano l’ablazione chirurgica per:
- Pazienti sintomatici con VCF che dovranno comunque sottoporsi a un intervento di cardiochirurgia (IIA-A).
- Anche i pazienti asintomatici che si sottopongono comunque a un intervento di cardiochirurgia dovrebbero essere presi in considerazione per l’ablazione chirurgica, se la procedura comporta pochi rischi aggiuntivi e una buona probabilità di successo, e se la procedura viene eseguita da un chirurgo esperto (IIB-C).
- Pazienti con VCF che non hanno altre indicazioni per la chirurgia cardiaca, o nei quali l’ablazione con catetere non ha avuto successo e l’ablazione chirurgica minimamente invasiva è possibile (IIB-C).
Si applicano le raccomandazioni degli esperti EHRS-EHRA-ECAS del 2012 per l’ablazione chirurgica:
- Per i pazienti con VCF parossistica o persistente sintomatica che hanno qualsiasi altra indicazione alla chirurgia cardiaca (IIa-C).
- Pazienti con VCF resistente ai farmaci (classe antiaritmica 1 o 3), parossistica o persistente, senza altre indicazioni per la chirurgia cardiaca e dopo un’ablazione con catetere non riuscita, o pazienti che preferiscono l’ablazione chirurgica da soli (IIb-C).
Ablazione chirurgica del VHF come intervento concomitante
La prevalenza della VCF nei pazienti sottoposti a chirurgia cardiaca varia da circa il 2% (per la chirurgia di bypass aorto-coronarico) al 60% per la chirurgia della valvola mitrale [31, 32]. Poiché è molto improbabile che una VCF persistente, non trattata e di lunga durata si converta spontaneamente al ritmo sinusale e la VCF da sola può anche influenzare la sopravvivenza a lungo termine, ha senso eseguire un’ulteriore ablazione se la chirurgia cardiaca è comunque indicata [33, 34]. Anche nella VCF indotta dalle valvole, la correzione della patologia valvolare da sola non è sufficiente per trattare l’aritmia. Sembra che l’isolamento elettrico degli orifizi della vena polmonare da solo sia abbastanza efficace per trattare la VCF parossistica [35]. Non è ancora chiaro se l’ablazione bi-atriale sia migliore della sola ablazione atriale sinistra in tutti i casi [36].
Efficienza dell’ablazione chirurgica e follow-up dei pazienti
Il consenso pubblicato nel 2007 tra la Heart Rhythm Society, la Society for Thoracic Surgeons, la European Heart Rhythm Association e la European Cardiac Arrhythmia Society [37] contiene una raccomandazione per rivedere il successo della terapia e l’ulteriore trattamento del paziente dopo l’ablazione chirurgica o interventistica. Tuttavia, la realtà nella pratica clinica e nella maggior parte delle pubblicazioni, soprattutto dopo l’ablazione chirurgica, è diversa: Pochissimi medici adottano le raccomandazioni di cui sopra. Inoltre, sembra che non ci sia consenso nemmeno tra i cardiochirurghi per quanto riguarda l’indicazione, la tecnica chirurgica e la cura post-operatoria. Pertanto, né i chirurghi stessi né gli elettrofisiologi possono dimostrare l’efficacia della terapia chirurgica o delle modifiche introdotte. Per aggirare questo ostacolo, dal febbraio 2009 è stato introdotto all’Inselspital un nuovo algoritmo per il trattamento chirurgico della VCF, con un approccio interdisciplinare che coinvolge elettrofisiologi e internisti. Questo include un concetto uniforme per l’indicazione, la tecnica intraoperatoria, l’assistenza post-operatoria e il follow-up.
Nuovo algoritmo di ablazione chirurgica della fibrillazione atriale
L’ indicazione per l’ ablazione chirurgica come intervento concomitante ad altri interventi di cardiochirurgia e la tecnica chirurgica corrispondente sono riassunte nelle Figure 1 e 2.
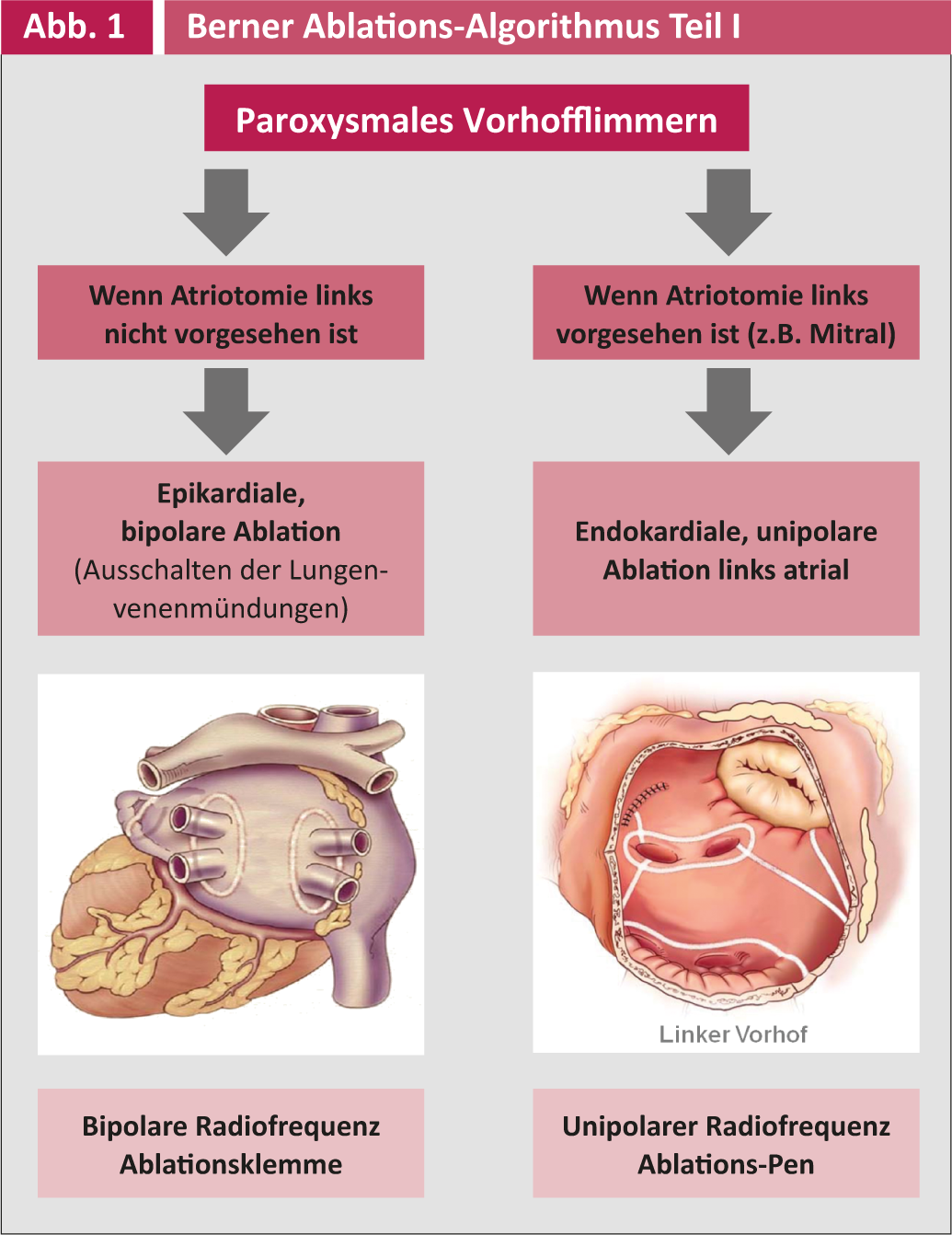
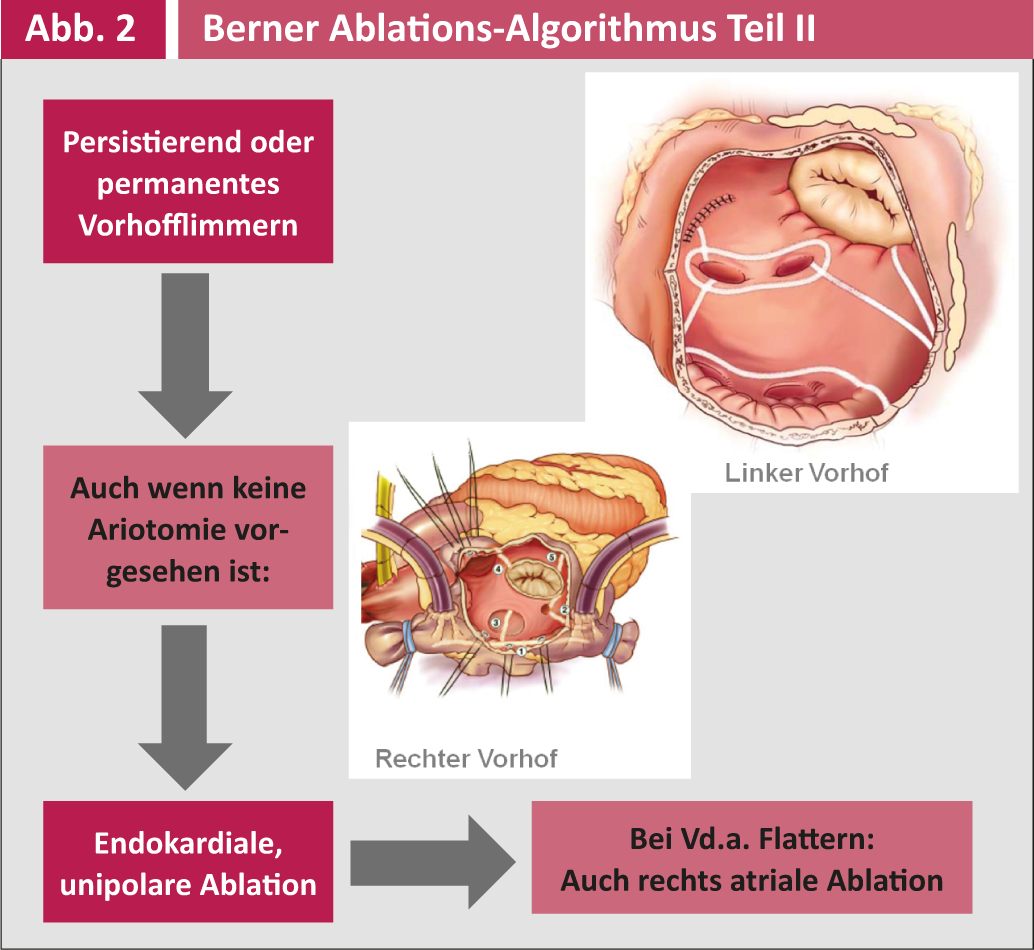
La terapia antiaritmica postoperatoria è gestita dai cardiologi/internisti e comprende principalmente il metroprololo e secondariamente l’amiodarone. Il follow-up post-operatorio viene effettuato tre volte al mese nel primo anno e poi annualmente dagli elettrofisiologi dell’Inselspital o dai cardiologi dello studio privato. Tutti i controlli includono un ECG a lungo termine con registratore di eventi di 7 giorni (R-test) per rilevare gli episodi asintomatici di VCF e regolare di conseguenza la terapia antiaritmica o anticoagulante. Si può parlare di successo elettrico solo se non compare alcuna aritmia VHF o atriale >30 secondi in un periodo di sette giorni. Un successo clinico, invece, è la libertà del paziente dai sintomi, anche se si verificano ancora recidive asintomatiche.
La resezione o l’eliminazione intraoperatoria dell’orecchio atriale sinistro per la profilassi del tromboembolismo viene eseguita se il punteggio CHADS-VASC è ≥2, se il paziente ha un’anamnesi di TIA e/o se la fibrina o un trombo sono localizzati nell’orecchio atriale sinistro mediante ispezione o ecocardiografia. È stato dimostrato che un orecchio atriale intatto contribuisce in modo significativo al trasporto atriale sinistro. Inoltre, il bilancio idrico dell’organismo svolge un ruolo importante [38–44].
L’endpoint primario di quest’analisi continua è la libertà da episodi di fibrillazione atriale nel test R. Gli endpoint secondari sono la libertà dall’anticoagulazione orale, la libertà dai farmaci antiaritmici, il tasso di ictus cerebrale e l’identificazione di possibili fattori predittivi di ritmo sinusale stabile. Un follow-up completo è obbligatorio.
Risultati provvisori e analisi parziale
Dall’introduzione di un nuovo algoritmo di ablazione nel 2009, 144 pazienti che presentavano la VCF in aggiunta alle rispettive patologie cardiache sono stati trattati intraoperatoriamente con l’ablazione chirurgica utilizzando il nuovo algoritmo. Il 64% dei pazienti è stato ablato con radiofrequenza unipolare, il 29% con radiofrequenza bipolare e il 7% con un’altra fonte di energia (criotermia).
Un’analisi parziale dei primi 42 pazienti mostra: prima dell’intervento chirurgico, 21 (50%) pazienti soffrivano di VCF parossistica, 21 (50%) di VCF persistente. La durata media della malattia era di 26 mesi (SD 40,5). L’età media al momento dell’intervento era di 69 anni (SD 7,8). 34 (81%) pazienti erano maschi, otto (19%) femmine. I diversi profili preoperatori dei pazienti sono riepilogati nelle tabelle 1 e 2.
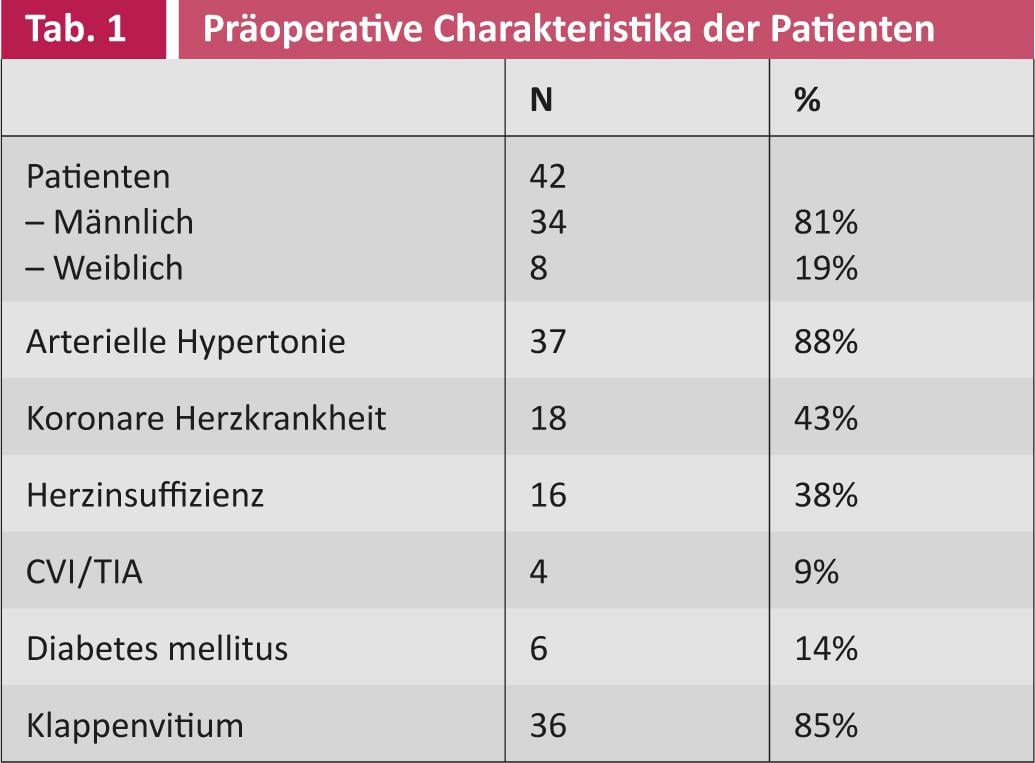
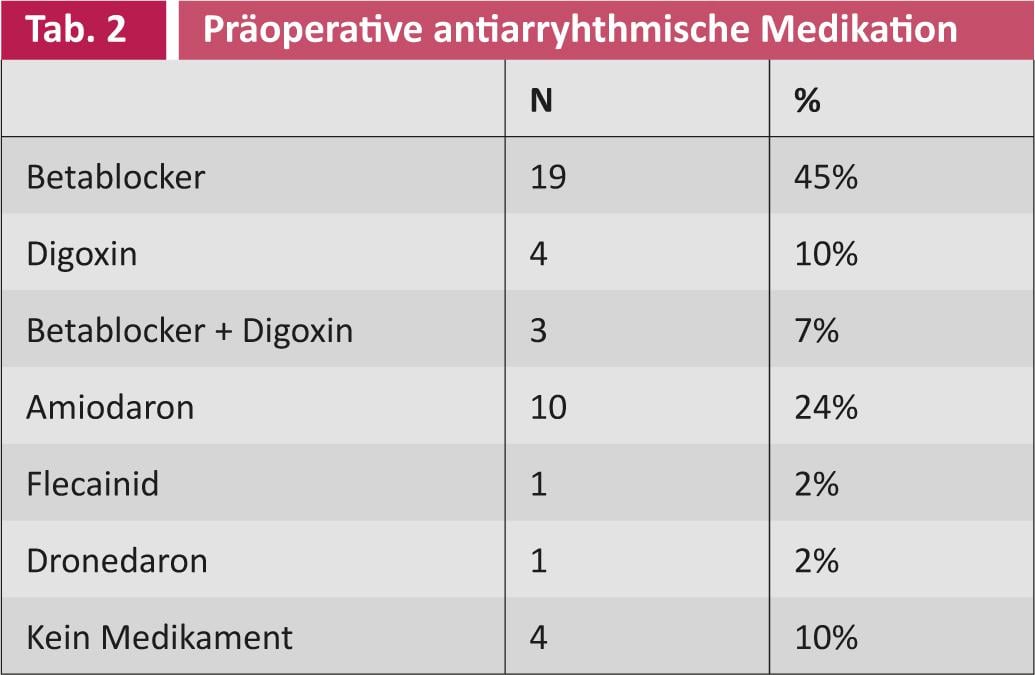
30 (71%) pazienti sono stati anticoagulati per via orale prima dell’ablazione chirurgica. Il punteggio medio CHADS2 e il punteggio CHA2DS2-VASc erano 2 e 2, rispettivamente. 3 (SD 1 risp. 1,5). A causa del rischio di tromboembolia, l’orecchio atriale sinistro è stato legato in 18 (43%) dei pazienti e completamente rimosso in due (5%). Quindi nella maggior parte dei pazienti l’orecchio atriale è stato lasciato intatto. Come già detto, l’ablazione chirurgica è stata eseguita con un’altra procedura sul cuore. Il tempo di funzionamento è solo leggermente prolungato, il tempo aggiuntivo richiesto è di circa 15-20 minuti.
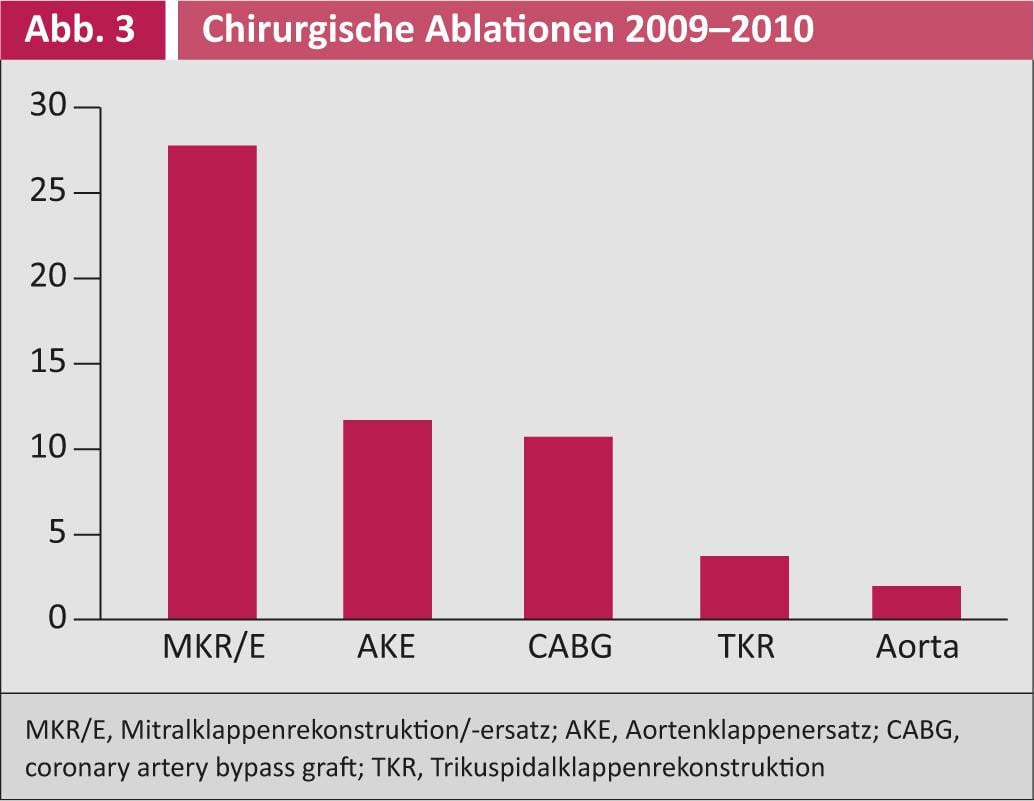
La Figura 3 mostra gli interventi che sono stati combinati con l’ablazione chirurgica tra il 2009 e il 2010. L’ablazione chirurgica è stata utilizzata insieme alla chirurgia della valvola mitrale in oltre il 25% dei casi, seguita dalla chirurgia della valvola aortica e del bypass.
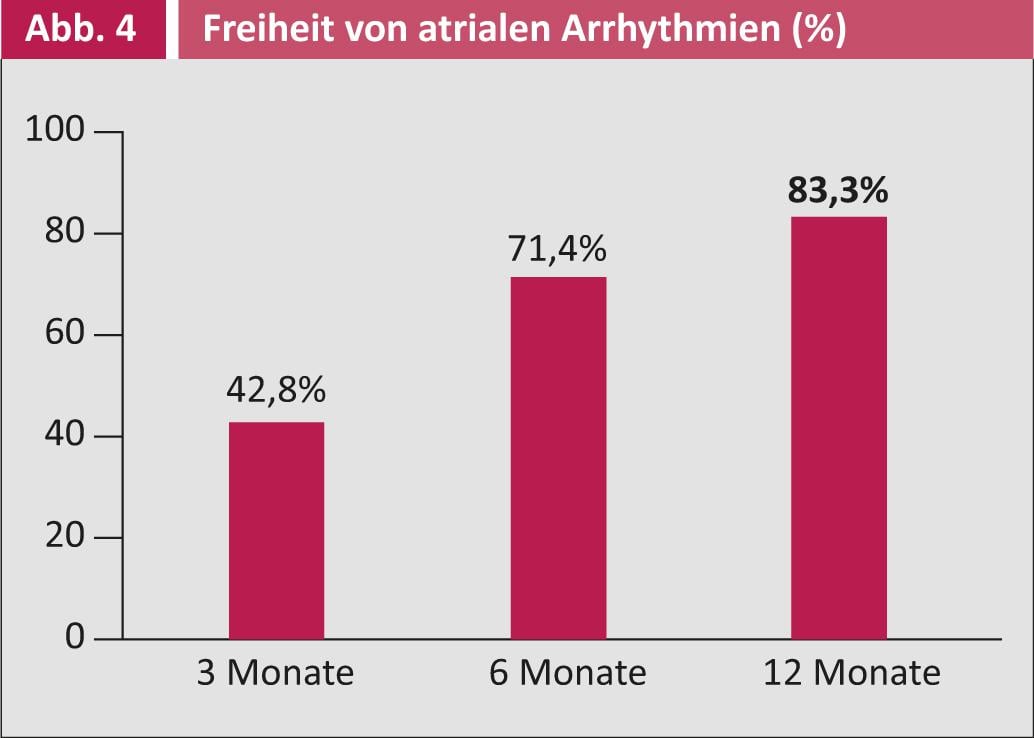
La Figura 4 mostra i rispettivi tassi di successo dell’ablazione chirurgica: dopo tre mesi, il 43% dei pazienti era libero da VCF, dopo sei mesi il tasso di successo sale addirittura al 71%. Dopo dodici mesi, l’83% dei pazienti era completamente libero dalla VCF.
Il successo dell’ablazione è stato espresso anche dal fatto che l’assunzione di farmaci antiaritmici e anticoagulanti è stata ridotta o addirittura completamente eliminata dopo l’intervento. In questa sottoanalisi, l’85% dei pazienti non assumeva più anticoagulanti orali dopo un anno e il 69% era in grado di interrompere i farmaci antiaritmici di classe I e III.
Complicazioni: Le complicazioni si sono verificate in 5 (12%) pazienti dopo l’intervento: Due pazienti hanno subito un insulto cerebrovascolare. Uno di loro aveva un orecchio atriale sinistro spento, mentre l’altro paziente aveva un orecchio atriale intatto. Entrambi erano in anticoagulazione prima e dopo l’intervento.
Un paziente in anticoagulazione ha sviluppato un tamponamento pericardico nel corso del trattamento, ma è stato trattato chirurgicamente con successo. Inoltre, un paziente ha avuto una tachicardia ventricolare con arresto cardiaco, dopo il quale è stata eseguita una cardioversione elettrica di successo ed è stato inserito un ICD. Un altro paziente ha avuto bisogno di un pacemaker definitivo dopo l’intervento (impianti totali di pacemaker dopo l’intervento 4,7%).
Il ritmo sinusale o il ritmo atriale stimolato al termine dell’intervento chirurgico (p=0,001) e la breve durata dell’intervento chirurgico (p=0,02) sono stati precedentemente identificati come predittori positivi di libertà dalla VCF un anno dopo l’intervento.
Discussione: Si pone la domanda se un registratore ECG ad “anello” impiantabile e continuo (Reveal) possa offrire un monitoraggio ancora più accurato e continuo del ritmo cardiaco. I dispositivi attualmente disponibili offrono una resistenza limitata, una sensibilità elevata ma una specificità ridotta e sono ancora molto costosi. Inoltre, non è chiaro come questa registrazione continua con un dispositivo impiantato influisca sulla compliance del paziente.
Conclusione
L’ablazione chirurgica con radiofrequenza per il trattamento della VCF come intervento combinato durante altre operazioni cardiache offre una procedura di successo e sicura. Il monitoraggio ripetuto e prolungato (almeno 7 giorni di ECG con registrazione degli eventi) dei pazienti nel periodo post-operatorio consente di individuare fino al 13% di casi che soffrono di episodi post-operatori di fibrillazione atriale ancora asintomatici. Questi aspetti spesso sfuggono con un’istantanea come quella fornita da un semplice ECG o anche da un Holter ECG di 24 ore. Questo ha un’implicazione significativa per la gestione post-operatoria dei pazienti in termini di impostazione dei farmaci anticoagulanti e antiaritmici. Certamente, è utile per i centri che desiderano offrire una terapia chirurgica per la VCF progettare un algoritmo longitudinale simile. Svolge un ruolo importante nella valutazione dei risultati, ma stimola anche la collaborazione interdisciplinare immensamente importante tra chirurghi ed elettrofisiologi. In definitiva, sono i pazienti a beneficiarne.
Bibliografia dell’editore
PD Dr. med. Alberto Weber
PD Dr. med. Hildegard Tanner
Prof. Dr. med. Thierry Carrel