L’ablazione catetere della fibrillazione atriale parossistica sintomatica è una modalità di trattamento consolidata con buone prospettive di successo e basso rischio. L’isolamento della vena polmonare rimane la base del successo dell’ablazione con catetere. Tuttavia, in una parte dei pazienti con fibrillazione atriale, si riscontra una malattia atriale fibrotica indipendente, che fornisce il substrato per il mantenimento della fibrillazione atriale. Questo vale in particolare (ma non esclusivamente) per i pazienti con fibrillazione atriale persistente. Questa intuizione ha aperto la strada a concetti di ablazione personalizzati per ottenere la stabilizzazione a lungo termine del ritmo sinusale anche in questa popolazione di pazienti difficili. Il trattamento mirato dei “modulatori” della fibrillazione atriale (cioè i fattori favorenti come l’ipertensione arteriosa, l’obesità, l’apnea del sonno, il diabete, ecc.
L’ablazione con catetere della fibrillazione atriale (FA) è diventata una procedura di routine con buoni risultati clinici. I tassi di successo a lungo termine sono attualmente dell’80-90% per la fibrillazione atriale parossistica (PAF) e del 50-60% per la fibrillazione atriale persistente (PersAF) [1,2].
L’ablazione con catetere può migliorare significativamente la qualità di vita dei pazienti. Inoltre, gli studi non solo dimostrano la superiorità dell’ablazione con catetere rispetto ai farmaci antiaritmici per quanto riguarda la recidiva di VCF, ma ora forniscono anche la prova che l’ablazione può influenzare la prognosi di ictus ischemico e mortalità [3].
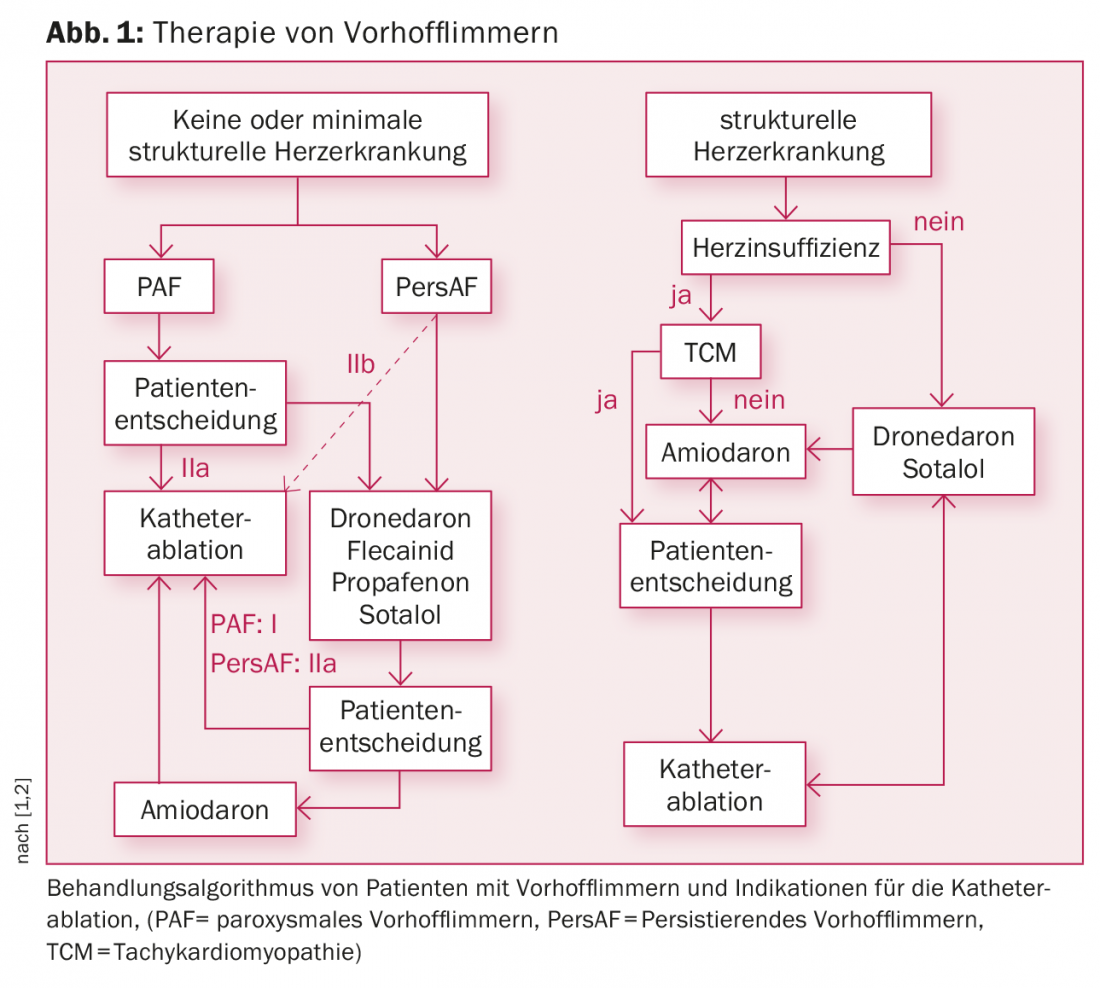
A seconda dell’utilizzo o meno di farmaci antiaritmici, le attuali linee guida elencano un’indicazione di classe I o IIa per la PAF e un’indicazione IIa o IIb per la persAF (Fig. 1) [1,2]. Soprattutto per la PAF, l’ablazione con catetere è già utilizzata come terapia di prima linea.
La fisiopatologia della VCF non valvolare è stata oggetto di indagini intensive negli ultimi anni e la nostra conoscenza del background fisiopatologico è stata notevolmente ampliata.
Il ruolo dei fattori scatenanti
Haissaguerre e collaboratori hanno descritto per la prima volta il ruolo dei trigger della vena polmonare (PV) nell’avvio della VCF quasi due decenni fa [4]. Questa osservazione ha gettato le basi per lo sviluppo dell’isolamento della vena polmonare (PVI) come strategia di trattamento potenzialmente curativa. Da allora, questa è stata la pietra miliare dell’ablazione con catetere della VCF. Raramente, i fattori scatenanti non-PV giocano un ruolo nell’iniziazione. Alcuni di questi ultimi possono avere origine nell’orecchio atriale sinistro, nel seno coronarico o nel setto interatriale.
L’isolamento della vena polmonare
La PVI è parte integrante di qualsiasi ablazione con catetere della VCF e può essere ottenuta con una varietà di strumenti e tecniche (Fig. 2 A-C).
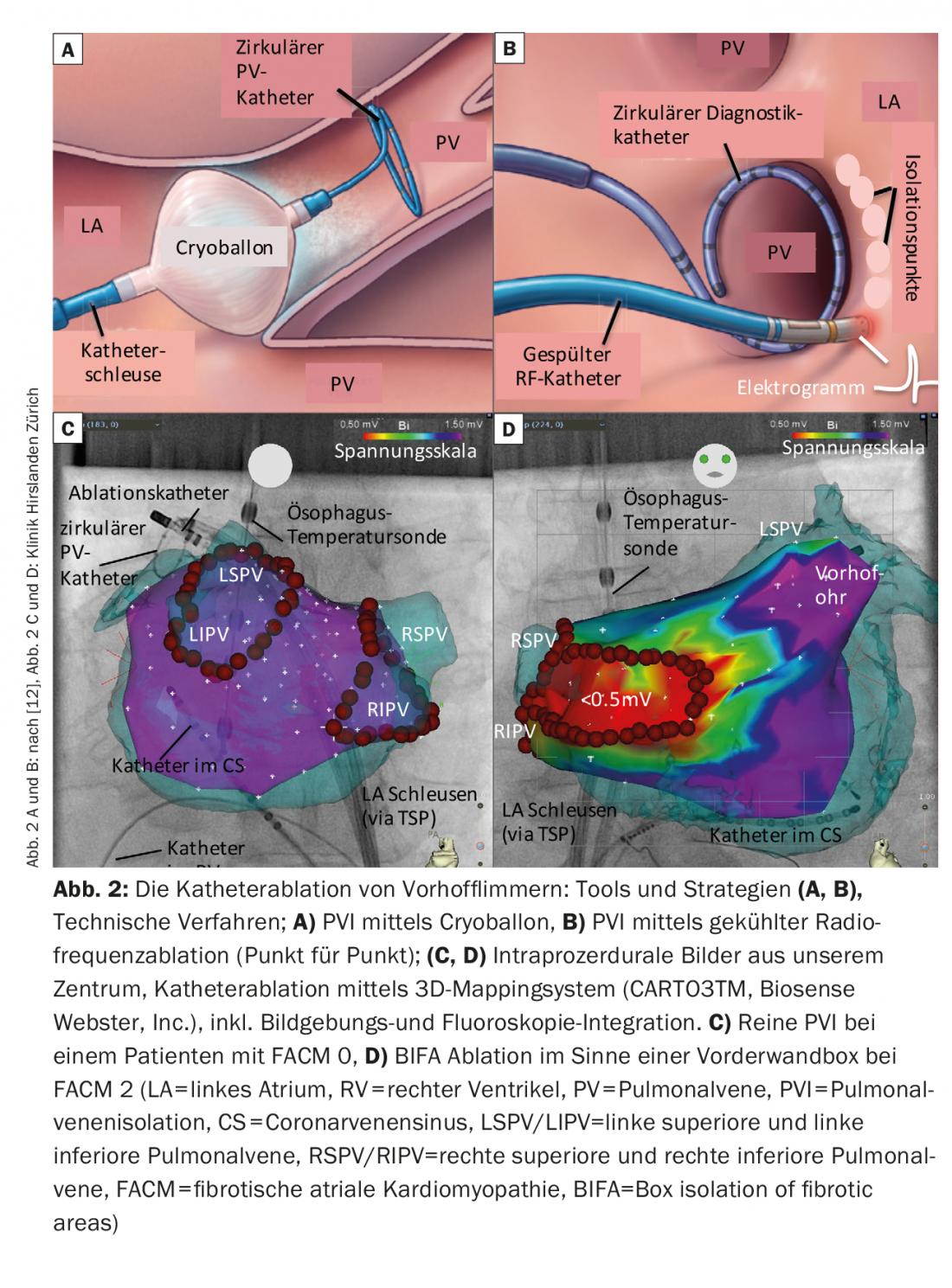
La forma di energia con cui è disponibile la maggior parte dell’esperienza a livello mondiale è la corrente ad alta frequenza (= radiofrequenza, RF). Di solito si crea una linea circonferenziale intorno alla FV omolaterale mediante ablazione punto per punto sulla punta del catetere. L’isolamento elettrico viene solitamente controllato mediante l’uso periprocedurale di cateteri di mappatura circolari. Spesso si utilizzano sistemi di mappatura elettroanatomica o tecniche di imaging per l’integrazione delle immagini (TAC, risonanza magnetica, ecografia intracardiaca). Questi facilitano la navigazione all’interno dell’atrio, contribuiscono alla sicurezza dell’intervento e riducono i tempi di fluoroscopia. La sostenibilità delle lesioni di ablazione è migliorata anche grazie a tecnologie fisiche come le camere d’aria navigabili, varie tecniche di lavaggio del catetere e, in particolare, la misurazione della pressione di contatto del catetere. Di conseguenza, il tasso di recupero delle linee fotovoltaiche potrebbe ridursi.
In alternativa, oltre all’ablazione con radiofrequenza, oggi si ricorre sempre più spesso all’ablazione con crioballo. I 4 FV vengono isolati individualmente e la fluoroscopia con l’ausilio di iniezioni di contrasto viene utilizzata per valutare la posizione ottimale del palloncino. I palloncini sono spesso più facili da maneggiare, ma hanno la limitazione che la diagnosi/terapia dettagliata delle aritmie consecutive o l’analisi degli elettrogrammi dell’atrio sinistro al di fuori della FV non sono possibili durante la procedura.
Molto raramente, l’energia laser viene utilizzata per la PVI. L’esperienza in questo senso è ancora limitata.
Nella PAF, di solito si possono ottenere ottimi risultati a lungo termine con un solo intervento di PVI pura. Invece, nonostante i progressi tecnici e strategici, i tassi di successo della persAF sono limitati, anche dopo procedure multiple. Le recidive dopo l’ablazione non possono sempre essere spiegate dal recupero della conduzione FV.
Il substrato atriale sinistro
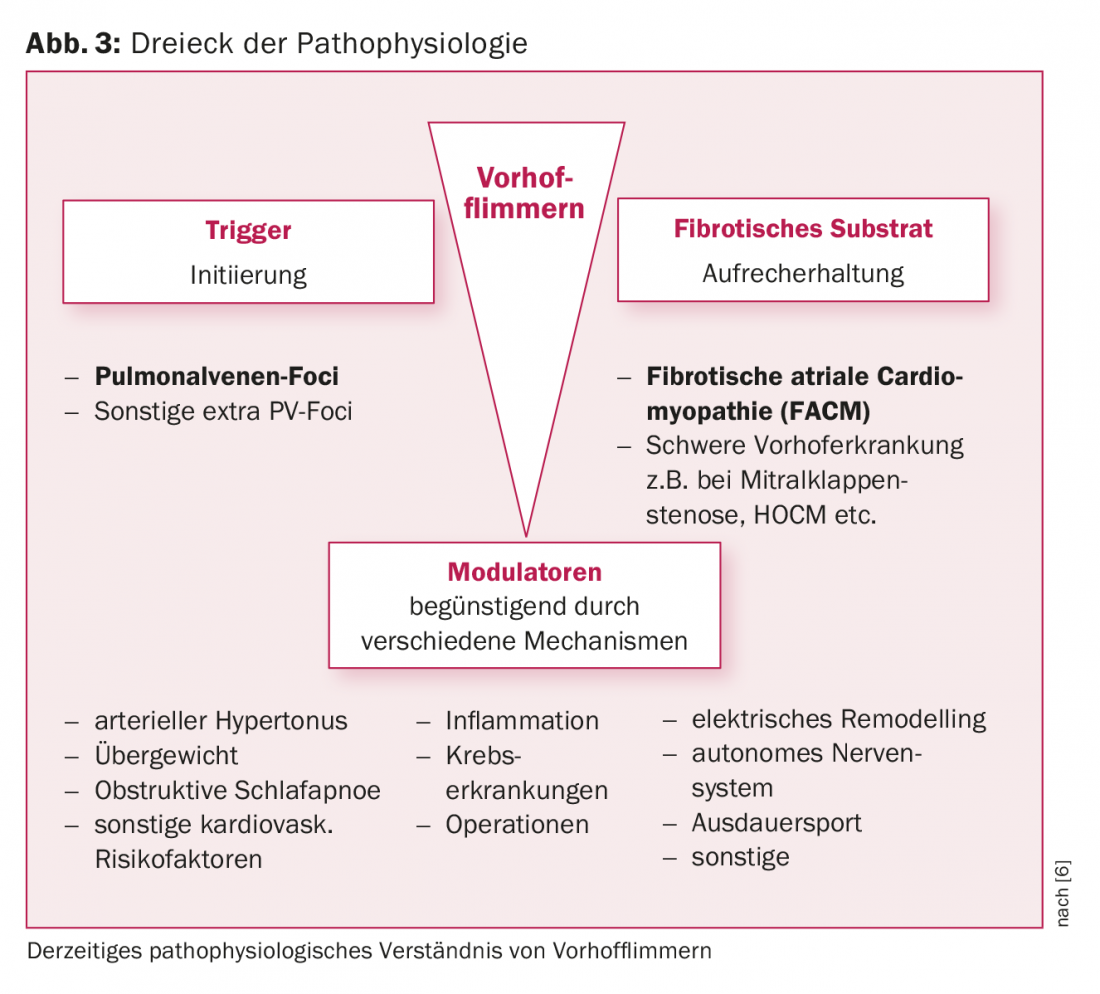
La presenza di fibrosi atriale sinistra è un reperto patologico tipico dei pazienti con VCF. Questo substrato atriale sinistro svolge un ruolo cruciale nel mantenimento della VCF. Quest’ultima può svilupparsi sulla base di una malattia cardiaca strutturale significativa (ad esempio, stenosi della valvola mitrale, HOCM) o può esistere sotto forma di malattia atriale indipendente. Il termine cardiomiopatia atriale fibrotica preesistente (FACM) si è affermato negli ultimi anni [5, 6] (Fig. 3, 4). Studi sperimentali hanno dimostrato che i processi di rimodellamento strutturale fibrotico portano a una situazione elettricamente anisotropa (alterazione delle velocità di conduzione, dei periodi refrattari, dei contatti cellula-cellula), che favorisce il mantenimento della VCF. Oggi sappiamo che i tassi di successo dell’ablazione dipendono in modo significativo dall’estensione della fibrosi atriale sottostante.
La creazione di una mappa di tensione bipolare durante la procedura può mappare bene questo substrato atriale sinistro (le aree sane sono codificate in viola, le aree altamente fibrotiche <0,5 mV in rosso).
Il nostro centro ora divide la FACM in 5 stadi a seconda del grado di gravità (Fig. 4) (FACM 0: nessuna area significativa a bassa tensione nella mappa del voltaggio, FACM 1: fibrosi locale di lieve entità, FACM 2: aree di fibrosi più ampie e confluenti, FACM3: fibrosi atriale pronunciata, ma ancora limitata a livello regionale, FACM 4: fibrosi quasi ubiquitaria).
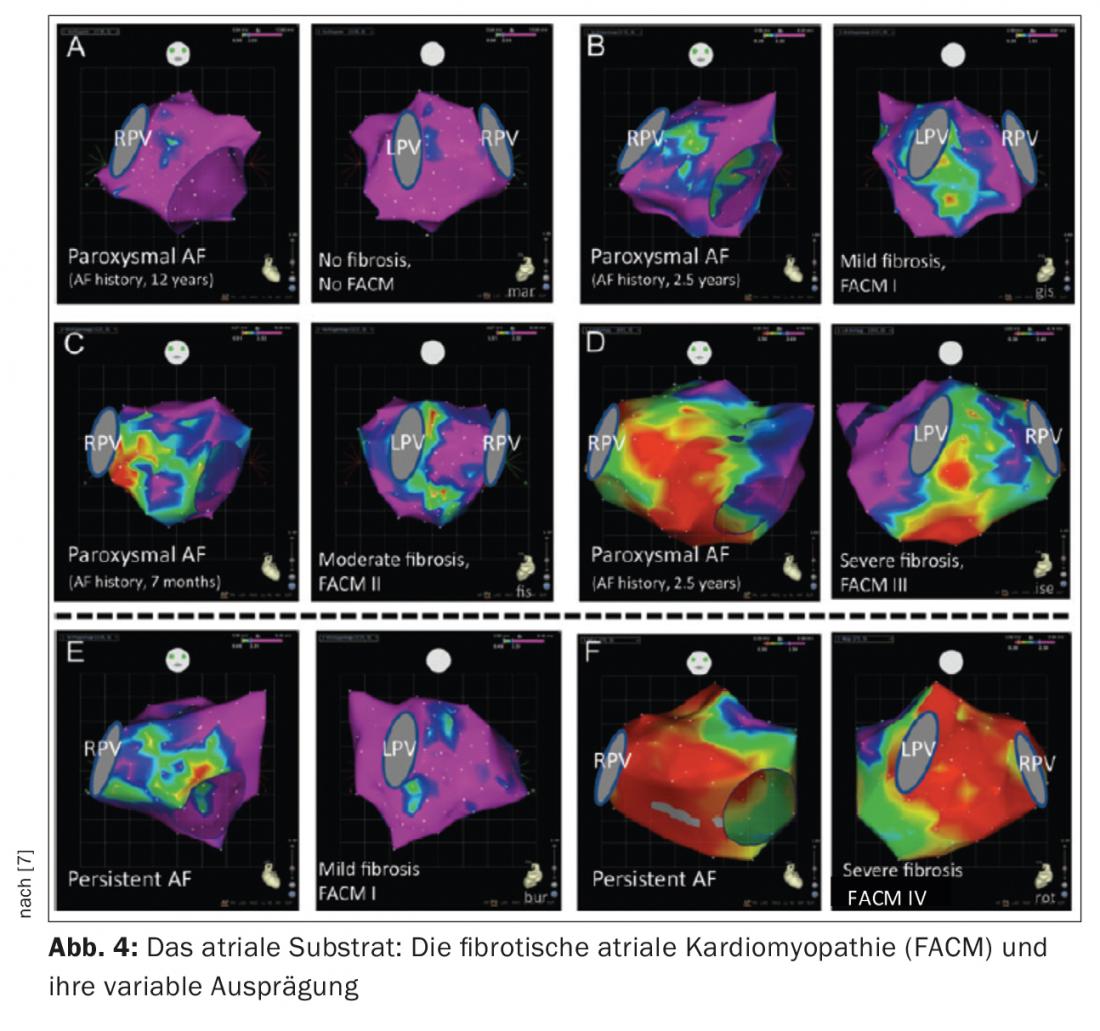
Da tempo si presume che la durata e l’entità degli episodi di fibrillazione atriale forniscano lo stimolo critico per il rimodellamento fibrotico degli atri (“la FA genera la FA”). Nel frattempo, ci sono dubbi su questa teoria. Questo perché è stato dimostrato che sia i pazienti con PAF che con persAF possono avere una malattia atriale significativa. Nei nostri pazienti, le aree di fibrosi possono essere rilevate in quasi il 20% dei pazienti PAF e nel 70% dei pazienti persAF.
Metodi precedenti e nuovi personalizzati per la modifica del substrato
La PVI da sola ha successo solo in poco meno del 50% dei pazienti con persAF. Tuttavia, le precedenti strategie di ablazione che vanno oltre la PVI (ad esempio, l’ablazione di elettrogrammi frazionati complessi, i cosiddetti CFAE, o la creazione di linee, o una combinazione di entrambi) non hanno contribuito a un miglioramento significativo dei risultati dell’ablazione. Quest’ultimo è stato dimostrato in particolare dallo studio prospettico multicentrico STAR AF II [1,8].
Pertanto, sono stati sviluppati concetti di ablazione personalizzati, che (oltre alla PVI) tengono conto dei patomeccanismi sottostanti alla VCF.
Da un lato, da un punto di vista funzionale, i “rotori” atriali sono stati messi a fuoco negli ultimi 5 anni. Le nuove tecniche di mappatura elettrofisiologica consentono di identificare questi “motori” della VCF utilizzando un catetere multielettrodo a forma di cestello, o più raramente in modo non invasivo con la “mappatura della superficie corporea”, e di renderli accessibili per l’ablazione mirata. Tuttavia, il valore clinico, soprattutto nei pazienti con persAF, necessita di ulteriori indagini. I risultati dell’ablazione sono controversi [9].
D’altra parte, oggi esistono concetti di ablazione che si concentrano sui cambiamenti strutturali, cioè sulla fibrosi atriale sinistra. L’isolamento delle aree fibrotiche (BIFA), che va oltre la PVI circonferenziale, è una di queste strategie sviluppate nel nostro centro (Fig. 2B). Sulla base di una mappa di tensione creata dall’atrio in ritmo sinusale, le aree fibrotiche, cioè le “aree a bassa tensione” (<0,5 mV) vengono isolate elettricamente. L’obiettivo è eliminare le aree atriali malate e quindi il substrato potenzialmente aritmogeno.
Nonostante una popolazione di pazienti difficile, il concetto BIFA ottiene buoni risultati di ablazione con tassi di successo iniziali a 1 anno intorno all’85% con solo 1,2 procedure per paziente [10].
A causa dell’espressione altamente variabile del FACM, un concetto di ablazione ottimale può essere scelto individualmente durante la procedura. Le procedure di imaging come metodo di screening preliminare sono attualmente ancora in fase di sperimentazione. Nei pazienti senza FACM rilevabile (FACM 0), la sola PVI sembra sufficiente anche in persAF. Qui c’è una buona probabilità prognostica di conservazione a lungo termine del ritmo sinusale (80-90%) con solo 1,2 procedure/paziente [10]. L’ablazione con catetere è molto più impegnativa nei pazienti con malattia atriale esistente. La misura in cui i pazienti con il grado più alto di fibrosi atriale (FACM 4) possono beneficiare dell’ablazione con catetere a lungo termine non è ancora stata chiarita in modo definitivo.
Modulatori della fibrillazione atriale
Un certo numero di fattori di rischio clinici (età, ipertensione, obesità, apnea del sonno, diabete, alcol, ecc. Anche alcune circostanze concomitanti, come infiammazioni/infezioni o un contesto perioperatorio, favoriscono la recidiva dell’aritmia (Fig. 3).
Negli ultimi anni, è stato dimostrato che il trattamento mirato con i cosiddetti “modulatori della fibrillazione atriale” ha un effetto positivo. Ad esempio, il gruppo di ricerca australiano guidato da Sanders è stato in grado di dimostrare che il trattamento mirato dei fattori di rischio clinici porta a una riduzione dei sintomi associati alla VCF, provoca un rimodellamento cardiaco e può persino migliorare significativamente i risultati dell’ablazione con catetere [11].
La gestione dei fattori di rischio dovrebbe quindi essere una componente essenziale del controllo del ritmo nella pratica, non solo prima ma anche dopo l’ablazione con catetere. Il trattamento interdisciplinare dei pazienti con VCF è quindi auspicabile.
Complicazioni
Le potenziali complicazioni dell’ablazione catetere della VCF dipendono dalle tecnologie e dalle strategie di ablazione utilizzate e dall’esperienza dello sperimentatore.
Il tasso di complicanze complessivo è di circa il 4-5%, con le complicanze vascolari periferiche associate all’accesso inguinale che rappresentano circa la metà [1,12,13]. Le complicazioni gravi sono rare.
I versamenti/tamponamenti pericardici sono segnalati nell’1-2,5% dei casi, con tassi leggermente inferiori, pari allo 0,5% per i crioballoni. Il rischio di complicanze cerebrovascolari (TIA/ictus) è stato ridotto negli ultimi anni grazie a misure come l’esclusione pre-interventistica dei trombi mediante ecocardiografia transesofagea, l’eparinizzazione periprocedurale (guidata dall’ACT) e il lavaggio continuo del catetere/condotto ed è ora pari a circa lo 0,5%.
Le stenosi del FV come effetto termico dell’ablazione non si verificano praticamente più oggi grazie alle nuove strategie di ablazione al di fuori delle aree dell’orifizio FV e sono riportate in letteratura allo 0-0,3%.
La paresi diaframmatica è una complicanza rara ma tipica dell’ablazione con crioballoon (2-5%). Tuttavia, spesso è rilevabile solo temporaneamente, tanto che dopo 3 mesi è descritto solo nello 0,2% dei casi. Una complicanza estremamente rara, ma potenzialmente pericolosa per la vita, è il verificarsi di una fistola atrio-esofagea (segnalazioni di casi singoli o circa lo 0,04%). Le misure profilattiche a questo proposito sono chiaramente raccomandate: Riduzioni di energia sulla parete posteriore dell’atrio e l’uso di sonde di temperatura esofagee che rilevano temperature eccessivamente alte o basse durante l’ablazione.
Uno sguardo al futuro
La VCF è una malattia complessa ed eterogenea. L’ablazione con catetere può trattare efficacemente un’ampia percentuale di pazienti e stabilire un ritmo sinusale stabile a lungo termine. Tuttavia, la gravità della malattia atriale sottostante, che non sempre è correlata all’aspetto clinico (PAF vs. persAF), è di importanza decisiva per la prognosi a lungo termine.
I concetti di ablazione personalizzata “su misura” sono quindi fondamentali per ottenere risultati ottimali. Nuove tecniche diagnostiche, idealmente ad alta risoluzione e con mappatura automatizzata durante l’ablazione con catetere, ci daranno ulteriori informazioni, soprattutto sui meccanismi di mantenimento della VCF. Inoltre, aumenterà l’importanza delle tecniche di imaging (ad esempio, analisi ecografiche specifiche come la deformazione, le risonanze magnetiche cardiache, ecc. Inoltre, i biomarcatori (ad esempio i marcatori della matrice ex-tracellulare) o le predisposizioni genetiche note potrebbero fornire indizi sull’estensione e sulla progressione del substrato atriale a medio termine.
Letteratura:
- Calkins H, et al: Dichiarazione di consenso degli esperti HRS/EHRA/ECAS sull’ablazione catetere e chirurgica della fibrillazione atriale: raccomandazioni per la selezione dei pazienti, le tecniche procedurali, la gestione e il follow-up dei pazienti, le definizioni, gli endpoint e il disegno degli studi di ricerca. Europace. 2012; Apr;14(4): 528-606.
- Kirchhof P, et al.: Linee guida ESC 2016 per la gestione della fibrillazione atriale sviluppate in collaborazione con EACTS: la Task Force per la gestione della fibrillazione atriale della Società Europea di Cardiologia (ESC) Sviluppate con il contributo speciale dell’Associazione Europea per il Ritmo Cardiaco (EHRA) dell’ESConsigliate dalla European Stroke Organisation (ESO). Europace. 2016 Aug 27 [Epub].
- Friberg L, et al: L’ablazione con catetere per la fibrillazione atriale è associata a una minore incidenza di ictus e morte: dati dei registri sanitari svedesi. Eur Heart J. 2016; Mar 16. pii: ehw087. [Epub ahead of print]
- Haïssaguerre M, et al. Inizio spontaneo della fibrillazione atriale da parte di battiti ectopici provenienti dalle vene polmonari. N Engl J Med. 1998; 3 settembre; 339(10): 659-66.
- Kottkamp H, et al: Ablazione catetere della fibrillazione atriale: come modificare il substrato? J Am Coll Cardiol. 2015; 20 gennaio; 65(2): 196-206.
- Kottkamp H, et al.: Il substrato nella fibrillazione atriale “precocemente persistente” Aritmia indotta, fattore di rischio indotto o da una specifica cardiomiopatia atriale fibrotica? JACC CEP 2016; 2: 140-142.
- Kottkamp H: Il substrato della fibrillazione atriale umana: verso una cardiomiopatia atriale fibrotica specifica. Eur Heart J. 2013; Sep;34(35):2731-8.
- Verma A, Jiang CY, et. al.: Investigatori STAR AF II. Approcci all’ablazione con catetere per la fibrillazione atriale persistente. N Engl J Med. 2015; 7 maggio; 372(19): 1812-22.
- Guillem MS, Climent AM, et al: Presenza e stabilità dei rotori nella fibrillazione atriale: prove e implicazioni terapeutiche. Cardiovasc Res. 2016, 109(4): 480-92. [Epub].
- Kottkamp H, et. al.: Box Isolation of Fibrotic Areas (BIFA): Un approccio di modifica del substrato su misura del paziente per l’ablazione della fibrillazione atriale. J Cardiovasc Electrophysiol. 2016; Jan27(1):22-30
- Pathak RK, et al: Studio di riduzione dei fattori di rischio aggressivi per la fibrillazione atriale e implicazioni per l’esito dell’ablazione: lo studio di coorte ARREST-AF. J Am Coll Cardiol 2014;64: 2222-2231.
- Kuck KH, et al: Ablazione con crioballo o radiofrequenza per la fibrillazione atriale parossistica. N Engl J Med. 2016; 374: 2235-45.
- Shah RU, et al: Complicazioni procedurali e procedure ripetute dopo l’ablazione con catetere per la fibrillazione atriale. J Am Coll Cardiol 2012; 59: 143-9.
CARDIOVASC 2016; 15(6): 3-8