Sia per i tumori ovarici a cellule germinali che per quelli epiteliali, la prima linea di terapia è la chirurgia e la chemioterapia. Tuttavia, negli ultimi anni sono cambiate molte cose, soprattutto per quanto riguarda il cancro ovarico. Esiste quindi una crescente base di dati sulla terapia di mantenimento con bevacizumab e/o inibitori PARP.
Mentre gli approcci oncologici mirati non sono ancora riusciti ad affermarsi nei tumori a cellule germinali dell’ovaio, sono ormai consolidati nella pratica quotidiana con gli inibitori PARP nella terapia di mantenimento dei tumori ovarici epiteliali e sono stati approvati dalle autorità. Tuttavia, alcune domande rimangono senza risposta, come la combinazione e la sequenza ideale di principi attivi. Manca anche un confronto diretto tra le diverse sostanze. E non sono solo gli agenti di nuova introduzione ad essere poco chiari, ma anche le terapie standard di prima linea per i tumori ovarici. L’operazione deve essere rimandata a una data successiva per aumentare la possibilità di una resezione R0? E come potrebbe essere possibile migliorare la cura dei pazienti con tumori a cellule germinali, visto il basso numero di casi?
Tumori a cellule germinali: imparare dagli uomini?
Sebbene i tumori a cellule germinali dell’ovaio abbiano una buona prognosi dopo un intervento chirurgico riuscito, gli studi sulla terapia ottimale devono essere migliorati. Per esempio, ci sono pochi dati sul valore della radioterapia e non è certo che la chemioterapia sia effettivamente necessaria in tutti i casi nella misura in cui viene effettuata oggi. Il panorama degli studi è anche scarsamente popolato nel contesto delle recidive – nonostante la prognosi estremamente sfavorevole e quindi l’elevatanecessità medica . Mentre i risultati entusiasmanti sul trattamento del seminoma e del non-seminoma nell’uomo vengono pubblicati di continuo, questi sono rari nei tumori germinali femminili. Una strategia segue quindi l’approccio di trasferire i risultati degli studi da coorti maschili o miste a pazienti di sesso femminile. Questo perché i tumori delle cellule germinali si verificano significativamente più frequentemente negli uomini, con un’incidenza di 6/100.000 all’anno, rispetto alle donne, con un’incidenza di 0,2/100.000/anno. Da un lato, questo approccio è un’opportunità, ma nasconde anche dei pericoli, ha avvertito la Prof.ssa Viola Heinzelmann, Responsabile del Centro Tumori Ginecologici e Primario di Ginecologia/Oncologia Ginecologica presso l’Ospedale Universitario di Basilea, in occasione del Congresso di quest’anno delle Società Tedesca, Austriaca e Svizzera di Ematologia e Oncologia Medica a Berlino. Sotto molti aspetti – come i biomarcatori disponibili, l’età di insorgenza e le strategie di trattamento – i tumori germinali maschili e femminili sono effettivamente simili. Tuttavia, ci sono differenze rilevanti, come l’aumento dell’incidenza nel sesso maschile e la stadiazione.
Attualmente, la terapia di prima linea – in gran parte estrapolata dai dati degli studi sui tumori germinali maschili – consiste in particolare nella chirurgia (laparotomica o minimamente invasiva) e nella chemioterapia. La rottura deve essere evitata per evitare che il tumore si diffonda. Nella maggior parte dei casi, è possibile eseguire un intervento chirurgico di conservazione della fertilità, ma l’isterectomia e l’annessiectomia sono consigliate dopo aver completato la pianificazione familiare [1]. I pazienti con disgerminoma o teratoma immaturo di stadio IA richiedono solo l’osservazione postoperatoria, mentre tutti gli altri pazienti devono ricevere la chemioterapia entro dieci giorni dall’intervento [1]. Questo ha effetti duraturi sulla fertilità e potrebbe non essere necessario nello stadio IA per tutti i tumori a cellule germinali – ma in questo caso mancano dati affidabili.
Anche le recidive devono essere rimosse chirurgicamente, quando possibile. Per il trattamento di seconda linea, si utilizzano in particolare vinblastina/ifosfamide/cisplatino (VeIP) o paclitaxel/ifosfamide/cisplatino. Tuttavia, esistono anche approcci curativi basati sul carboplatino, con buoni risultati [2]. Altre opzioni sperimentali includono la chemioterapia ad alte dosi con trapianto di cellule staminali autologhe, la BEP accelerata o standard (bleomicina/etoposide/platino), il carboplatino/paclitaxel e la sorveglianza attiva [3]. Esiste uno studio di fase II pubblicato nel 2021 sull’uso dell’immunoterapia con inibitori del checkpoint, in cui non è stato osservato alcun beneficio con la somministrazione di pembrolizumab [4]. A causa dell’elevata instabilità genomica, le terapie mirate per i tumori delle cellule germinali non sono un’opzione, secondo il Prof. Heinzelmann. Più promettente è uno studio multicentrico randomizzato in corso che confronta paclitaxel/carboplatino con bleomicina/etoposide/cisplatino nel contesto della recidiva. I risultati di questo studio sono attesi per il 2024.
Al congresso della Società Europea di Oncologia Medica (ESMO) di quest’anno, sono state presentate due interessanti innovazioni, almeno per quanto riguarda i tumori germinali maschili. Pertanto, per il seminoma in stadio IIA/B, sembra giustificata una riduzione dell’intensità della terapia a un singolo ciclo di carboplatino e radioterapia [5]. Il cabazitaxel potrebbe anche fornire un beneficio in termini di sopravvivenza nei tumori a cellule germinali avanzati, dopo due o tre linee di trattamento precedenti [6]. Se i risultati di questo studio siano applicabili anche alle pazienti di sesso femminile, deve essere ancora indagato. La radioterapia non fa parte della terapia standard per le donne, da un lato per motivi di conservazione della fertilità e dall’altro a causa delle condizioni anatomiche. Gli studi randomizzati non hanno ancora studiato questa opzione nelle donne. Per affrontare l’insufficiente base di dati per il trattamento dei tumori germinali femminili, le due reti ENGOT (Rete europea dei gruppi di sperimentazione oncologica ginecologica) e GCIS (Intergruppo Internazionale Cancro Ginecologico Cancro Ovarico) che devono coordinare e avviare studi importanti per fare finalmente chiarezza nel caso di disgerminoma, teratoma e simili nelle donne.
Focus sulla terapia di prima linea del cancro ovarico
Oltre ai tumori delle cellule germinali, il meeting annuale della DGHO, dell’OeGHO, della SSMO e della SGH/SSH si è occupato anche del carcinoma ovarico, molto più comune. In particolare, ci si è concentrati sull’opportunità di somministrare la chemioterapia neoadiuvante prima dell’intervento chirurgico. È stata discussa anche la terapia di mantenimento con bevacizumab e/o inibitore PARP. Oltre alla chirurgia e alla chemioterapia adiuvante, questa fa già parte dello standard di cura in prima linea a partire dallo stadio III [7]. Mentre i benefici corrispondenti in termini di sopravvivenza libera da progressione (PFS) sono già stati dimostrati nei vari studi pivotal, non ci sono ancora dati pubblicati sulla sopravvivenza globale con la nuova terapia di mantenimento raccomandata.
In linea di principio, la resezione macroscopicamente completa è considerata estremamente importante in termini di prognosi [8]. Questo risultato viene raggiunto in circa il 60% dei casi, con un tasso più elevato di resezioni R0 dopo la chemioterapia neoadiuvante. Pertanto, è ovvio considerare di eseguire l’intervento chirurgico solo dopo aver completato la chemioterapia primaria. Tuttavia, questo approccio non sembra migliorare l’esito [9,10]. Secondo i dati attuali, la libertà dal tumore dopo la chirurgia primaria è quindi superiore a quella dopo la chirurgia di intervallo. Questo si riflette anche nelle linee guida, che non prevedono la chemioterapia neoadiuvante [7]. Tuttavia, la sequenza di trattamento è stata finora studiata solo nei tumori avanzati, spesso principalmente inoperabili. La questione della chemioterapia neoadiuvante rimane quindi attualmente senza risposta per quei pazienti che vengono valutati principalmente come operabili. Per questo motivo, è stato lanciato lo studioTRUST (Trial on Radical Upfront Surgical Therapy), che include pazienti in stadio IIIB, IIIC e IV, valutati come liberi da tumore. La valutazione dei dati è in pieno svolgimento e dovrebbe finalmente chiarire se la chirurgia di intervallo potrebbe essere superiore allo standard di cura in alcuni casi. Un fattore da non trascurare è la morbilità e la mortalità associate alla chirurgia. Le pazienti con un rischio elevato di intervento chirurgico dovrebbero essere riconosciute meglio, secondo la Prof.ssa Barbara Schmalfeldt, responsabile del Centro di Cancro Ginecologico presso il Centro Medico Universitario di Amburgo-Eppendorf. Questi pazienti, circa il 10%, trarrebbero maggiore beneficio dalla chemioterapia primaria seguita da una rivalutazione della chirurgia [11–13]. Tuttavia, l’identificazione di questi pazienti fragili è una sfida. Al congresso è stato presentato il cosiddetto metodo delle “4 A” come approccio, in base al quale l’età, l’albumina, lo stadio della malattia (malattia avanzata) e le condizioni generali vengono prese in considerazione nella decisione di trattamento.
Nonostante i dati convincenti per la terapia di mantenimento in prima linea, la chirurgia e, se possibile, la resezione completa rimangono di grande importanza – questo è stato sottolineato anche dal Prof. Schmalfeldt. Pertanto, la PFS dipende fortemente dal resto del tumore, anche in caso di terapia di mantenimento [14].
Il ruolo degli inibitori PARP nel carcinoma ovarico sieroso di alto grado
Le innovazioni più rivoluzionarie nel trattamento del tumore ovarico negli ultimi anni riguardano la terapia di mantenimento di prima linea. Dopo l’introduzione dell’inibitore VEGF bevacizumab in questa indicazione, sono stati aggiunti anche gli inibitori PARP niraparib e olaparib in presenza di una mutazione BRCA o di un altro deficit di ricombinazione omologa (HRD). Il prerequisito per la terapia di mantenimento con bevacizumab e/o inibitore PARP è una risposta alla chemioterapia di prima linea [15]. Il beneficio dell’inibizione del VEGF – in cui bevacizumab viene iniziato contemporaneamente alla chemioterapia e continuato dopo la fine della chemioterapia – è stato confermato al Meeting annuale ASCO di quest’anno. L’estensione del trattamento da 15 a 30 mesi, invece, non ha portato alcun beneficio aggiuntivo [16]. L’uso degli inibitori PARP olaparib e niraparib nella terapia di mantenimento di prima linea porta anche a un comprovato beneficio in termini di PFS nei tumori HRD-positivi rispetto al placebo e alla monoterapia con bevacizumab [17]. Questo ha già portato alle autorizzazioni di Swissmedic e alle corrispondenti modifiche delle linee guida [7,15].
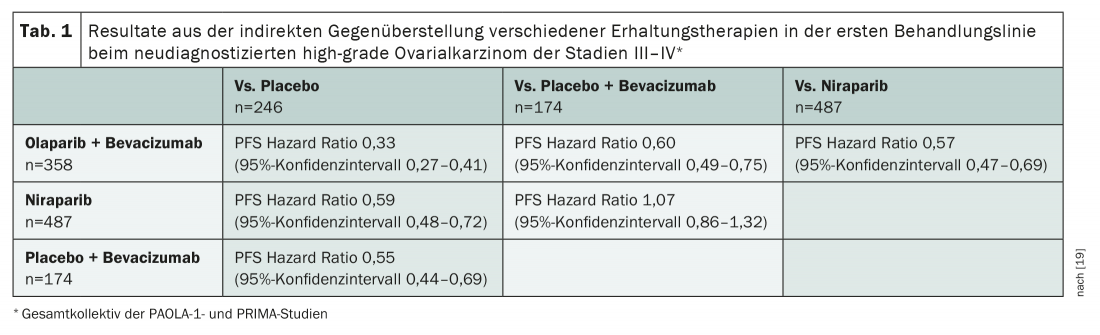
Sebbene il beneficio degli inibitori PARP nel carcinoma ovarico di alto grado HRD-positivo sia ormai poco controverso, ci sono ancora alcune domande da risolvere sul loro utilizzo. Finora non esistono confronti diretti tra i singoli principi attivi. Inoltre, la terapia combinata con bevacizumab è sempre discussa in modo controverso. A questo scopo esistono due confronti indiretti aggiustati per la popolazione sulla base degli studi di registrazione [18,19]. Sono metodologicamente discutibili – ma estremamente interessanti. Da un lato, forniscono la prova che la somministrazione simultanea di un inibitore PARP con bevacizumab presenta dei vantaggi rispetto alla monoterapia con inibitore PARP in termini di PFS. Questa opzione sembra anche funzionare meglio rispetto alla somministrazione del solo bevacizumab (tab. 1) . Se non ci sono controindicazioni al bevacizumab, la sostanza deve essere utilizzata – nei casi HRD-positivi integrata da un inibitore PARP. Se ci sono controindicazioni al bevacizumab, la terapia di mantenimento con la sola inibizione di PARP può essere iniziata dopo la chemioterapia nei pazienti HRD-positivi. Gli inibitori PARP – in questo caso olaparib, niraparib e rucaparib – sono approvati anche per il carcinoma ovarico recidivante sensibile al platino, indipendentemente dallo stato di mutazione.
Con l’aumento dell’uso di agenti mirati, la questione della strategia di test ottimale sta diventando sempre più importante. Una cosa è chiara: il test genetico dovrebbe essere offerto in ogni caso [7]. Mentre alcuni centri eseguono prima la diagnosi del tumore e poi quella della linea germinale, altri preferiscono l’approccio opposto. Manca uno standard stabilito.
Fonte: Simposio scientifico “Update Ovarian Tumours” presieduto da Sigrun Greil-Ressler e Hans Tesch, 04.10.2021, Riunione annuale delle Società tedesche, austriache e svizzere di ematologia e oncologia medica, Berlino (D).
Letteratura:
- Brown J, et al: Revisione di consenso del Gynecologic Cancer Intergroup (GCIG) per i tumori ovarici a cellule germinali. Int J Gynecol Cancer. 2014; 24(9 Suppl 3): S48-54.
- De Giorgi U, et al.: Chemioterapia di salvataggio ad alte dosi in pazienti donne con tumori germinali recidivati/refrattari: un’analisi retrospettiva del Gruppo Europeo per il Trapianto di Sangue e Midollo (EBMT). Ann Oncol. 2017; 28(8): 1910-1916.
- Uccello M, et al.: Trattamento antitumorale sistemico nei tumori ovarici maligni a cellule germinali (MOGCT): gestione attuale e approcci promettenti. Ann Transl Med. 2020; 8(24): 1713.
- Tsimberidou AM, et al: Pembrolizumab nei pazienti con tumori a cellule germinali metastatici avanzati. Oncologo. 2021; 26(7): 558-e1098.
- Papachristofilou A, et al: Carboplatino a dose singola seguito da radioterapia del nodo coinvolto come trattamento curativo per il seminoma in stadio IIA/B: risultati di efficacia dello studio multicentrico internazionale di fase II SAKK 01/10. Congresso ESMO 2021, Sessione Proffered Paper – Tumori genitourinari, non prostata 2, Abstract #LBA30.
- Baciarello G, et al.: Uno studio prospettico di fase II sul cabazitaxel in pazienti maschi con tumori metastatici a cellule germinali pretrattati con chemioterapia: lo studio CABA-GCT. Congresso ESMO 2021, Mini sessione orale – Tumori genitourinari, non prostatici, abstract #655MO.
- AWMF S3-Leitlinie: Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren, Versione 5.0, settembre 2021.
- du Bois A, et al: Ruolo dell’esito chirurgico come fattore prognostico nel carcinoma ovarico epiteliale avanzato: un’analisi esplorativa combinata di 3 studi multicentrici di fase 3 randomizzati in modo prospettico: da parte dell’Arbeitsgemeinschaft Gynaekologische Onkologie Studiengruppe Ovarialkarzinom (AGO-OVAR) e del Groupe d’Investigateurs Nationaux Pour les Etudes des Cancers de l’Ovaire (GINECO). Cancer. 2009; 115(6): 1234-1244.
- Vergote I, et al: Chemioterapia neoadiuvante o chirurgia primaria nel carcinoma ovarico in stadio IIIC o IV. N Engl J Med. 2010; 363(10): 943-953.
- Kehoe S, et al: Chemioterapia primaria rispetto alla chirurgia primaria per il carcinoma ovarico avanzato di nuova diagnosi (CHORUS): uno studio in aperto, randomizzato, controllato, di non inferiorità. Lancet. 2015; 386(9990): 249-257.
- Vergote I, et al.: Chemioterapia neoadiuvante nel carcinoma ovarico avanzato: su cosa siamo d’accordo e in disaccordo? Gynecol Oncol. 2013; 128(1): 6-11.
- Aletti GD, et al: Approccio multidisciplinare nella gestione delle pazienti con carcinoma ovarico avanzato: un approccio personalizzato. Risultati di un’unità specializzata in cancro ovarico. Gynecol Oncol. 2017; 144(3): 468-473.
- Ataseven B, et al.: L’albumina sierica pre-operatoria è associata al tasso di complicanze post-operatorie e alla sopravvivenza globale nelle pazienti con carcinoma ovarico epiteliale sottoposte a chirurgia citoriduttiva. Gynecol Oncol. 2015; 138(3): 560-565.
- Harter P, et al: Efficacia di olaparib di mantenimento più bevacizumab in base allo stato dei biomarcatori nelle pazienti a rischio clinico più elevato e più basso con carcinoma ovarico avanzato di nuova diagnosi nello studio PAOLA-1. Giornale internazionale del cancro ginecologico. 2020; 30: A13-A4.
- Informazioni sui farmaci di Swissmedic: www.swissmedicinfo.ch (ultimo accesso 28.10.2021).
- Pfisterer J, et al.: Durata ottimale del trattamento con bevacizumab (BEV) in combinazione con carboplatino e paclitaxel in pazienti (pts) con carcinoma ovarico epiteliale primario (EOC), tube di Falloppio (FTC) o peritoneale (PPC): Uno studio multicentrico open-label randomizzato a 2 bracci ENGOT/GCIG di fase 3 del Gruppo di Studio AGO, GINECO e NSGO (AGO-OVAR 17/BOOST, GINECO OV118, ENGOT Ov-15, NCT01462890). Riunione annuale ASCO 2021, Sessione di abstract orali sul cancro ginecologico, abstract #5501.
- Ray-Coquard I, et al: Olaparib più bevacizumab come mantenimento di prima linea nel carcinoma ovarico. N Engl J Med. 2019; 381(25): 2416-2428.
- Vergote I, et al: Confronto indiretto aggiustato per la popolazione degli studi SOLO1 e PAOLA-1/ENGOT-ov25 di olaparib con o senza bevacizumab, bev da solo e placebo nel trattamento di mantenimento delle donne con carcinoma ovarico di nuova diagnosi di stadio III/IV con mutazione BRCA. Riunione annuale SGO 2020, abstract #35.
- Hettle R, et al: Confronto terapeutico indiretto aggiustato per popolazione (PAITC) tra un inibitore PARP di mantenimento (PARPi) con o senza bevacizumab rispetto a bevacizumab nelle donne con carcinoma ovarico (OC) di nuova diagnosi. Riunione annuale ASCO 2020, Sessione Poster Cancro Ginecologico, abstract #6052.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(6): 19-22 (pubblicato il 7.12.21, prima della stampa).