Nel trattamento del diabete mellito di tipo 2, gli ultimi anni hanno portato alcune innovazioni in termini di diagnosi, obiettivi terapeutici e scelta dei farmaci antidiabetici. “Un approccio centrato sul paziente” sono le parole chiave del documento di posizione congiunto delle società di diabetologia americane ed europee, in cui si propone una maggiore individualizzazione degli obiettivi terapeutici per quanto riguarda il controllo della glicemia e i fattori di rischio cardiovascolare [1]. La durata del diabete, l’età del paziente, il rischio di ipoglicemia, le comorbidità e la compliance devono essere presi in considerazione nel determinare gli obiettivi terapeutici. L’implementazione di modifiche dello stile di vita è ancora la misura più importante nel trattamento del diabete mellito. I farmaci antidiabetici disponibili consentono una terapia adattata alle esigenze e alle comorbidità del paziente. Tuttavia, il numero crescente di farmaci antidiabetici richiede anche una costante formazione ed esperienza per i medici curanti. Questo articolo si propone di fornire una panoramica degli obiettivi e delle opzioni di trattamento per i pazienti con diabete di tipo 2.
L’HbA1c è stata introdotta di recente come criterio diagnostico per il diabete nel 2009. È meno sensibile della glicemia a digiuno, ma è uno strumento pratico grazie al test indipendente dall’ora del giorno. I criteri diagnostici per il diabete mellito pre- e manifesto sono elencati nella Tabella 1. Lo screening è consigliato in tutti i pazienti di età superiore ai 45 anni e nei soggetti in sovrappeso con un IMC ≥25 kg/m2 con un fattore di rischio aggiuntivo per il diabete mellito [1].

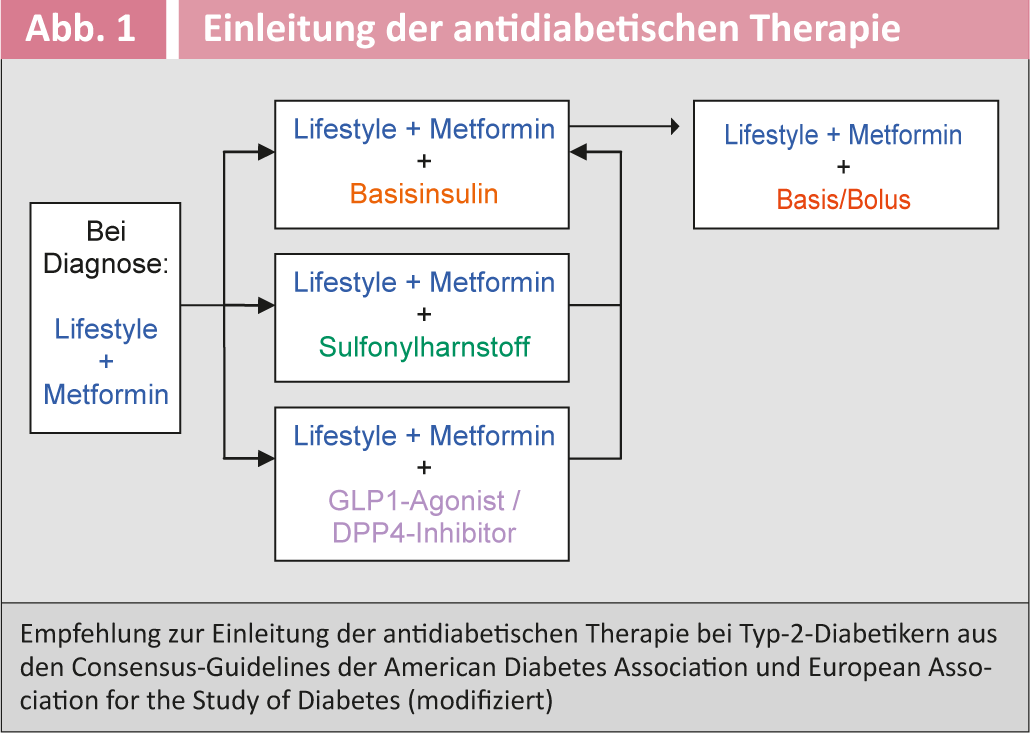
Poiché un disturbo della tolleranza al glucosio di solito esisteva già da anni quando il diabete mellito è stato diagnosticato per la prima volta, lo screening delle complicanze secondarie associate al diabete e delle comorbidità cardiovascolari è raccomandato al momento della diagnosi (Tab. 2) . Lo screening deve essere ripetuto a intervalli annuali.
Obiettivi della terapia
Ampi studi clinici come l’UK Prospective Diabetes Study (UKPDS) o lo studio Steno-2 hanno dimostrato che un controllo glicemico ottimale, insieme al trattamento degli altri fattori di rischio cardiovascolare, porta a una riduzione significativa delle complicanze micro e macrovascolari [2–6]. I dati di follow-up a 10 anni dell’UKPDS ci hanno insegnato che un controllo glicemico rigoroso dopo la diagnosi iniziale di diabete continua a ridurre le complicanze tardive e la mortalità per un decennio dopo la fine dello studio (“memoria metabolica”) [5]. Tre grandi studi con obiettivi di trattamento molto più aggressivi (HbA1c <6% vs. 7-7,9% [7]) rispetto, ad esempio, all’UKPDS (7% vs. 7,9% [2]) hanno mostrato un aumento della mortalità, per cui un obiettivo “individualizzato” è ora favorito [1, 2, 7, 8]. La durata del diabete, l’età del paziente, le comorbidità e la compliance devono essere prese maggiormente in considerazione. Per la maggior parte dei pazienti (cioè quelli con una lunga aspettativa di vita, una breve durata del diabete, nessuna comorbidità grave e una buona aderenza alla terapia), un’HbA1c di <7% è ancora considerata l’obiettivo terapeutico, evitando l’ipoglicemia. In presenza di comorbilità significative, in particolare di comorbilità cardiovascolari, di una breve aspettativa di vita, di un elevato rischio di ipoglicemia e di rischio di cadute, si dovrebbe riconsiderare un allentamento dell’obiettivo di HbA1c al 7-8%.
Opzioni terapeutiche
La terapia del diabete mellito di tipo 2 deve avere un approccio olistico, cioè si deve sempre puntare alla riduzione del peso, all’ottimizzazione del profilo di rischio cardiovascolare e alla prevenzione dell’ipoglicemia. L’ipoglicemia ricorrente, come l’iperglicemia, è probabilmente responsabile delle complicanze a lungo termine e deve essere evitata.
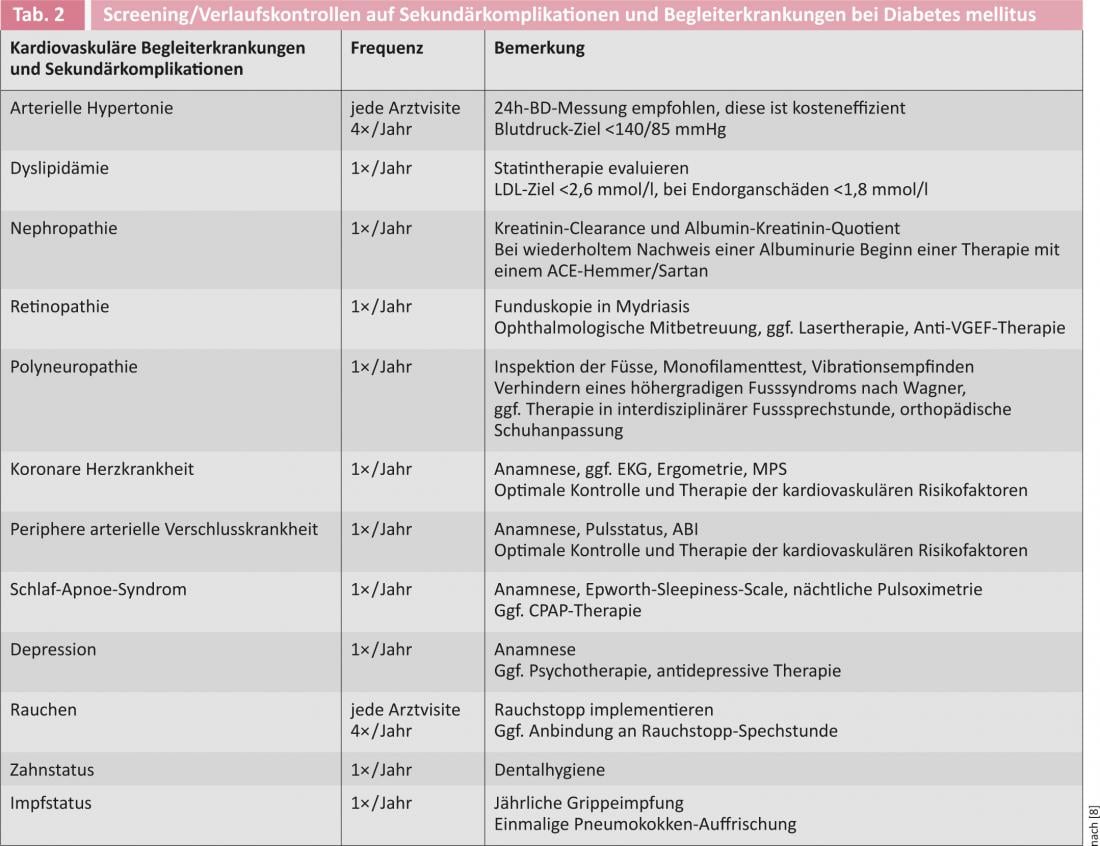
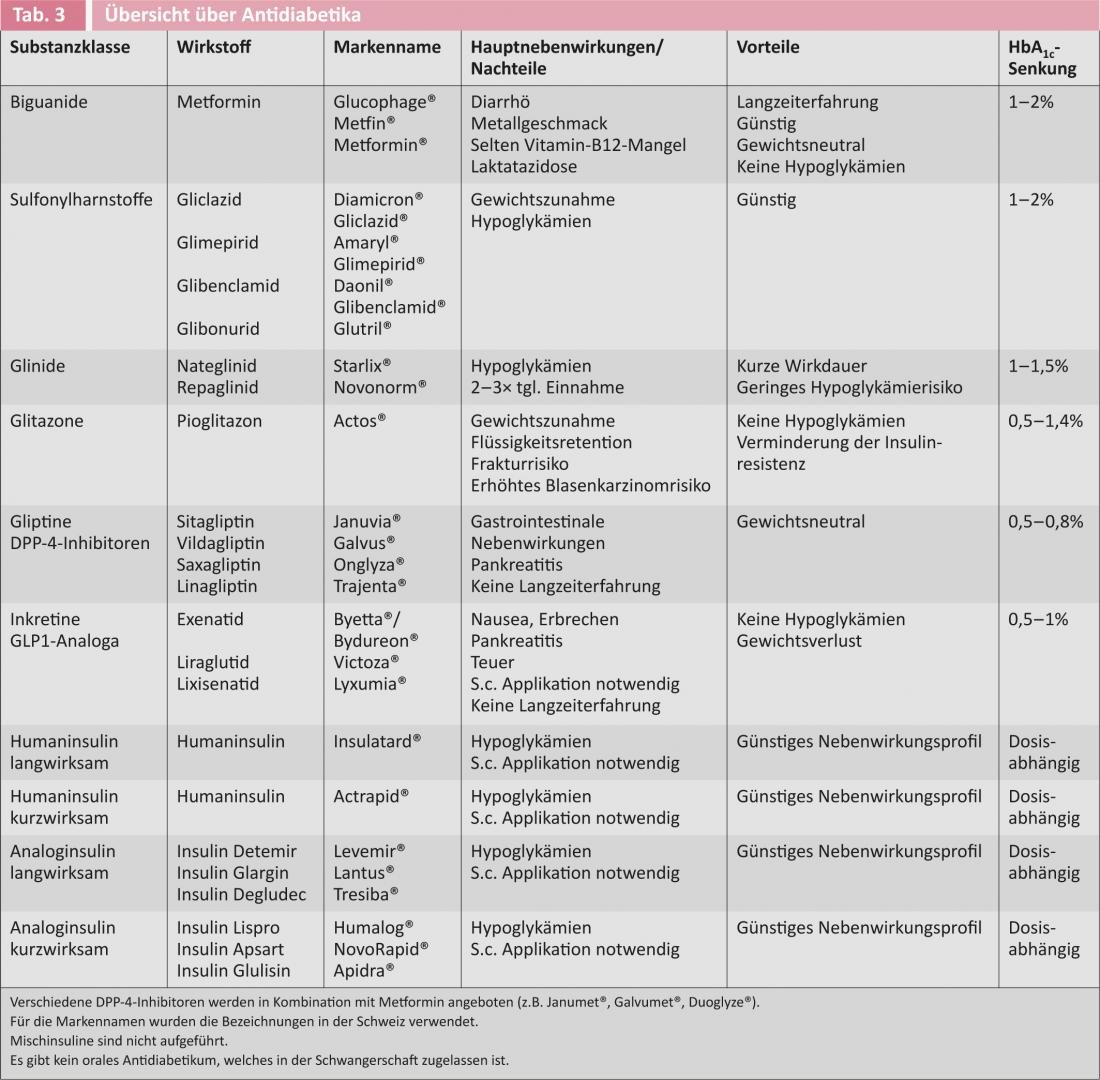
La Figura 1 mostra le attuali raccomandazioni per l’inizio della terapia antidiabetica nei diabetici di tipo 2 da parte delle società di diabetologia americane ed europee [6]. La Tabella 3 offre una panoramica dei farmaci antidiabetici disponibili.
Intervento sullo stile di vita, sport
L’inattività fisica e la sovralimentazione, che portano all’obesità e alla resistenza all’insulina, sono i principali fattori ambientali che aumentano il rischio di diabete. Anche una perdita di peso moderata, pari al 5-10% del peso corporeo, porta a un miglioramento significativo dello stato metabolico del diabetico e del profilo di rischio cardiovascolare e può rendere superflua la terapia farmacologica per il diabete. Le modifiche dello stile di vita comprendono una dieta sana, equilibrata e a ridotto contenuto calorico per tutta la vita e un’attività fisica regolare (ad esempio, almeno 150 minuti a settimana) [8]. Gli interventi di accompagnamento nutrizionale e sportivo hanno spesso effetti sostenibili (ad esempio, Diafit.ch).
Metformina
Se non ci sono controindicazioni, la metformina è l’antidiabetico orale di prima scelta, grazie al suo profilo di efficacia favorevole e ai molti anni di esperienza. La metformina è da neutra a leggermente dimagrante e non provoca ipoglicemia. I suoi effetti principali sono la riduzione della gluconeogenesi epatica, il miglioramento dell’assorbimento del glucosio nelle cellule muscolari e adipose e la riduzione dei trigliceridi [9]. Recentemente, il suo uso è stato raccomandato per i pazienti con scarse prospettive di cambiamenti drastici dello stile di vita già al momento della diagnosi. Gli studi attuali ipotizzano una riduzione dell’incidenza del cancro e della mortalità in caso di terapia con metformina. I principali effetti collaterali sono i disturbi gastrointestinali, che possono essere ridotti introducendo lentamente il farmaco e fornendo buone informazioni al paziente [9]. In casi estremamente rari (<1 caso/100.000 pazienti), è stata descritta la comparsa di acidosi lattica in pazienti con grave insufficienza renale, per cui la metformina è controindicata nei pazienti con una clearance della creatinina <30 ml/min.
Sulfoniluree
Le sulfoniluree (glibenclamide, gliclazide, glimepiride, glibonuride) stimolano la secrezione di insulina indipendentemente dall’assunzione di cibo, aumentando così il rischio di ipoglicemia e spesso portando ad un aumento di peso. L’ipoglicemia si verifica soprattutto nelle persone anziane e in presenza di grave insufficienza renale (clearance della creatinina <30 ml/min), con il rischio più elevato con le glibenclamide. Il vantaggio delle sulfoniluree è che sono state introdotte da molti anni e i loro effetti collaterali sono quindi ben noti. I pazienti in terapia con sulfoniluree devono essere in grado di misurare la glicemia e devono essere istruiti sull’ipoglicemia e sulle misure comportamentali prima di guidare [1, 6].
Glinide
Come le sulfoniluree, anche le glinidi (nateglinide/repaglinide) stimolano la secrezione di insulina, quindi non è consigliabile combinare questi preparati. Le glinidi hanno un’emivita più breve e vengono somministrate ad ogni pasto. Il grado di aumento di peso è simile a quello delle sulfoniluree e il rischio di ipoglicemia è inferiore [1, 6].
Glitazoni
I glitazoni sono chiamati anche “sensibilizzatori di insulina”, perché migliorano la sensibilità all’insulina di muscoli, grasso e fegato. Il rosiglitazone è stato ritirato dal mercato in Svizzera nel 2010 a causa dell’aumento del rischio cardiovascolare, per cui il pioglitazone è l’unica sostanza approvata in Svizzera. Oltre al noto aumento di peso, la terapia con glitazoni può portare a ritenzione di liquidi, edema periferico e conseguente insufficienza cardiaca, nonché a una diminuzione della densità ossea, a un aumento del rischio di fratture e a una maggiore incidenza di carcinomi della vescica [1, 6]. La Società Svizzera di Endocrinologia e Diabetologia raccomanda l’uso di pioglitazone solo in pazienti selezionati con grave resistenza all’insulina e senza controindicazioni, in particolare l’insufficienza cardiaca.
Incretini
Agonisti del recettore GLP1: il cosiddetto effetto incretina descrive il fenomeno per cui l’assunzione di glucosio per via orale induce un maggiore rilascio di insulina rispetto alla somministrazione di glucosio per via endovenosa. L’effetto delle incretine è responsabile di circa il 60% della secrezione postprandiale di insulina. Le due note incretine glucagone-simile-peptide-1 (GLP1) e glucosio-dipendente-insulinotropo-peptide (GIP) sono rilasciate dalle cellule enteroendocrine della parete intestinale dopo l’assunzione di cibo perorale. Questi attivano le cellule β del pancreas e quindi portano a un aumento della secrezione di insulina. Inoltre, inibiscono la gluconeogenesi attraverso il loro effetto sulle cellule α, ritardano lo svuotamento gastrico e inibiscono centralmente l’appetito. Poiché l’effetto delle incretine è glucosio-dipendente, l’ipoglicemia non si verifica con la monoterapia. Come ulteriore effetto positivo, gli agonisti del GLP1 favoriscono la riduzione del peso. Gli analoghi del GLP1 sono costosi e devono essere applicati per via sottocutanea. I principali effetti collaterali sono nausea, vomito e diarrea [1, 6].
Gliptine/inibitori della DPP-4: il GIP e il GLP1 vengono rapidamente degradati dalla dipetidil peptidasi-4 (DPP-4), per cui gli inibitori della DPP-4 sono stati sviluppati come un’ulteriore classe di sostanze. L’ipoglicemia non si verifica durante la terapia con gli inibitori del DDP-4 e il loro peso è neutro. La tollerabilità degli inibitori della DPP-4 è buona, raramente si verificano disturbi gastrointestinali. Tuttavia, ci sono prove di un aumento del rischio di tumore al pancreas e al pancreas. Sono attesi a breve studi a lungo termine con endpoint rigidi e con l’occorrenza di effetti collaterali. Nell’insufficienza renale, è necessario un aggiustamento della dose per la maggior parte degli inibitori della DPP-4 [1, 6].
Insulina
La carenza di insulina esiste in tutte le forme di diabete, per cui la sostituzione dell’insulina è sempre un’opzione terapeutica adeguata in linea di principio. Tutti i pazienti che vengono adattati alla terapia insulinica devono essere addestrati alla consulenza sul diabete per quanto riguarda l’automonitoraggio della glicemia e il comportamento in caso di ipoglicemia. Per i diabetici di tipo 2, l’insulina viene iniziata prima di andare a letto a 0,2 E/kgKG o 10 E e viene titolata lentamente fino a quando i livelli di glucosio a digiuno sono inferiori a 7 mmol/l. L’insulina di base può essere combinata con un antidiabetico orale, preferibilmente la metformina. La combinazione con le sulfoniluree non ha un effetto additivo significativo sulla riduzione dell’HbA1c. Se l’HbA1c è ancora >7%, passi a un regime base/bolus [1, 6].
Operazioni bariatriche
L’intervento più comunemente eseguito è il bypass gastrico (cosiddetto Roux-en-Y), in cui lo stomaco viene ridotto in modo significativo e l’intestino tenue viene collegato direttamente allo stomaco. I risultati di questi interventi sono molto convincenti a breve termine, con una perdita di peso a lungo attesa fino al 30-40% in molti casi. Gli effetti collaterali includono segni di malassorbimento, soprattutto carenza di ferro e vitamina B12, che devono essere sostituiti. Dopo l’intervento, spesso si verificano problemi psicologici, in parte dovuti alla perdita dell’effetto gratificante del cibo. La mortalità dell’intervento di bypass gastrico è di circa lo 0,5%. Se la chirurgia bariatrica sia la panacea nella lotta contro il diabete mellito non si può ancora rispondere, poiché non sono disponibili dati a lungo termine sulla remissione del diabete e sulla riduzione della mortalità. In un documento di posizione della Federazione Internazionale del Diabete (IDF) del 2011, la chirurgia bariatrica è raccomandata principalmente per i diabetici di tipo 2 obesi (BMI ≥35kg/m2) che non raggiungono gli obiettivi di trattamento con le misure convenzionali e che presentano comorbidità cardiovascolari [10]. La chirurgia bariatrica non dovrebbe essere valutata come “ultima spiaggia” nei diabetici obesi con resistenza all’insulina, ma come opzione di trattamento in una fase iniziale.
Procedura nella pratica clinica quotidiana
Quando viene diagnosticato il diabete mellito, è necessario avviare interventi sullo stile di vita insieme alla terapia con metformina. Per quanto riguarda l’intervento sullo stile di vita, esistono programmi di educazione ambulatoriale per i diabetici. Inoltre, in questo momento devono essere valutati tutti i fattori di rischio cardiovascolare e deve essere ricercato il danno agli organi terminali. Se il diabete è ancora insufficientemente controllato con queste misure (HbA1c >7,0%), la metformina deve essere combinata con una sulfonilurea o un’incretina o, in alternativa, con un’insulina da assumere a letto. Se il controllo del diabete è ancora inadeguato, è indicata l’implementazione di un’insulina a letto o di un sistema di bolo di base. Raccomandiamo che i diabetici obesi che non riescono a ridurre il peso da soli siano indirizzati a un centro per l’obesità con esperienza. In questo caso, è possibile partecipare a un gruppo sull’obesità o a un gruppo di persone con obesità. viene valutata l’opzione dell’intervento bariatrico.
Bibliografia dell’editore
Stefanie Meyer, MD
CARDIOVASC 2013; 12(4): 20-24