La crescente prevalenza dell’insufficienza cardiaca è un problema medico ed economico importante. Il numero di pazienti trattati in ospedale per insufficienza cardiaca è in aumento da anni. Il quadro clinico dell’insufficienza cardiaca è complesso. I sintomi tipici includono dispnea, riduzione delle prestazioni, affaticamento e ritenzione di liquidi.
La crescente prevalenza dell’insufficienza cardiaca è un problema medico ed economico importante [1]. Il numero di pazienti trattati in ospedale per insufficienza cardiaca è in aumento da anni. I costi associati per il sistema sanitario sono elevati [1,2].
L’insufficienza cardiaca è definita come l’incapacità del cuore di fornire all’organismo sangue e ossigeno sufficienti a garantire un metabolismo stabile in condizioni di riposo e di sforzo. Il quadro clinico dell’insufficienza cardiaca è complesso. I sintomi tipici includono dispnea, riduzione delle prestazioni, affaticamento e ritenzione di liquidi [1,2].
Le attuali raccomandazioni ESC distinguono tra insufficienza cardiaca con frazione di eiezione ventricolare sinistra ridotta (HFrEF; EF <40%), insufficienza cardiaca con frazione di eiezione intermedia (HFmrEF; EF 40-50%) e insufficienza cardiaca con frazione di eiezione conservata (HFpEF; LV-EF >50%) [1]. Ognuna di queste tre categorie di insufficienza cardiaca è associata a una prognosi sfavorevole con un aumento della morbilità e della mortalità [1,2].
Insufficienza cardiaca con frazione di eiezione ventricolare sinistra ridotta (HFrEF)
Nonostante gli enormi progressi con un’ampia gamma di opzioni terapeutiche nella farmacologia e nella terapia con dispositivi (ICD, CRT) fino alle procedure interventistiche o chirurgiche (clip Mitra, VAD), la prognosi dei pazienti con HFrEF rimane scarsa [1]. Durante un follow-up mediano di 47 mesi, la mortalità è stata del 32% nei pazienti HFrEF con LV-EF del 35-50%. Con un LV-EF <35% la mortalità aumenta al 41% [1–3].
La capacità di esercizio cardiopolmonare, misurata dalla captazione massima di ossigeno nella spiroergometria (VO2 di picco ml/min-1/kg-1) è significativamente ridotta nei pazienti con HFrEF. È più basso nelle donne che negli uomini e diminuisce in modo ancora più significativo in età avanzata e dopo lo scompenso [3].
Il VO2 di picco è considerato un predittore significativo della mortalità per tutte le cause [3] e un VO2 di picco inferiore di 1 ml/min-1/kg-1 è associato a una mortalità per tutte le cause superiore del 16% [3]. Le cause della riduzione della capacità di esercizio nell’HFrEF includono la riduzione della funzione di pompa del ventricolo sinistro, la riduzione della capacità polmonare causata dalla disfunzione cardiaca e il marcato decondizionamento del muscolo scheletrico periferico con riduzione della massa muscolare [1,3]. La sarcopenia (deperimento muscolare) è presente nel 30-50% dei pazienti con HFrEF [3]. Inoltre, la mancanza di adattamento della frequenza cardiaca (incompetenza cronotropa) e l’insufficiente flusso sanguigno alla muscolatura periferica a causa della vasocostrizione periferica nella sovrastimolazione neuroendocrina e simpaticotonica possono limitare ulteriormente le prestazioni fisiche.
Insufficienza cardiaca con frazione di eiezione ventricolare sinistra conservata (HFpEF)
La fisiopatologia dell’insufficienza cardiaca con LV-EF conservato (HFpEF) è complessa, eterogenea e non ancora completamente compresa [2]. L’HFpEf è spesso associata a comorbidità come il diabete mellito e l’ipertensione. L’attenzione iniziale si concentra su un disturbo di riempimento del ventricolo sinistro (disfunzione diastolica), di solito con ipertrofia ventricolare sinistra e funzione di pompa inizialmente preservata. I disturbi microvascolari possono portare a un danno miocardico e a una riduzione della funzione sistolica del ventricolo sinistro [2]. Oltre ai sintomi clinici (dispnea, riduzione delle prestazioni, ritenzione di liquidi), l’HFpEF è definita da una LV-EF ≥50%, da peptidi natriuretici elevati (BNP >35 pg/ml, NT-proBNP >125 pg/ml) e dall’evidenza ecocardiografica di una cardiopatia strutturale (ipertrofia ventricolare sinistra, ingrandimento atriale sinistro) o di una disfunzione diastolica [1,4]. La proporzione di pazienti con HFpEF nella popolazione totale di insufficienza cardiaca si presume sia di circa il 50%. La prognosi di questi pazienti è comparabilmente scarsa rispetto a quella dei pazienti con HFrEF [1,4]. A differenza dell’HFrEF, la terapia farmacologica dei pazienti con HFpEF non è assicurata. La morbilità e la mortalità dei pazienti con HFpEF non potevano essere ridotte dalla farmacoterapia basata sulla terapia dell’HFrEF finora [1,4]. Questo rende la prevenzione e il trattamento dei fattori di rischio cardiovascolare e delle comorbidità nell’HFpEF proporzionalmente ancora più importante.
I pazienti con HFpEF tendono ad essere più anziani, più spesso di sesso femminile, con maggiore probabilità di avere il diabete di tipo 2 e/o l’ipertensione e con più comorbidità. Questi pazienti sono spesso altamente sintomatici, la loro capacità di recupero fisico nella vita quotidiana è fortemente limitata e la loro qualità di vita è significativamente ridotta come risultato [1,3,4], nonostante un LV-EF normale! Studi recenti dimostrano che l’insufficienza cardiaca nei pazienti con HFpEF è associata a meccanismi di adattamento periferico paragonabili a quelli dei pazienti con HFrEF, ossia a un marcato decondizionamento dei muscoli scheletrici e a una ridotta massa muscolare periferica [6].
Nei pazienti con HFpEF, una ridotta capacità di esercizio è associata a un aumento significativo della morbilità e della mortalità [3]. Tuttavia, gli studi iniziali mostrano che il miglioramento delle prestazioni fisiche è stato associato anche a una diminuzione della mortalità per tutte le cause [5]. In questo contesto e in presenza di una farmacoterapia non provata, l’allenamento fisico è di fondamentale importanza nella terapia dei pazienti con HFpEF [1,4].
Attività fisica ed esercizio fisico nell’insufficienza cardiaca (HFrEF e HFpEF)
Come conseguenza dell’insufficienza cardiaca con dispnea da sforzo, affaticamento ed esaurimento, la prevalenza dell’inattività fisica prolungata è molto alta in questa popolazione [3]. Gli interventi di allenamento adattati individualmente possono contrastare efficacemente il decondizionamento dei muscoli scheletrici con i suoi effetti negativi sulle attività della vita quotidiana. In questo modo, l’attività fisica regolare può essere molto efficace per stabilizzare le prestazioni fisiche e migliorare la qualità della vita nei pazienti con HFrEF e HFpEF [3].
Per decenni, l’allenamento fisico nella terapia dei pazienti con HFrEF è stato studiato in molti studi e valutato in revisioni sistematiche e meta-analisi. Questi dati confermano costantemente la sicurezza e l’elevata efficacia degli interventi di formazione nei pazienti con HFrEF [3]. Solo negli ultimi anni l’allenamento fisico nei pazienti con HFpEF è diventato oggetto di attenzione scientifica. Gli studi confermano analogamente la sicurezza e l’efficacia dell’allenamento adattato in questo gruppo di pazienti [3].
I risultati di questi studi e delle meta-analisi dimostrano un miglioramento significativo della qualità di vita, nonché delle prestazioni cardiopolmonari e della mobilità nella vita quotidiana (ad esempio, nel test del cammino di 6 minuti) [3]. La partecipazione a programmi di riabilitazione basati sull’esercizio fisico ha anche ridotto in modo significativo il tasso di ospedalizzazione dovuto al peggioramento dell’insufficienza cardiaca. Tuttavia, non è stato possibile dimostrare una riduzione della mortalità attraverso l’intervento di formazione in nessuna delle meta-analisi attuali [3]. Pertanto, le attuali linee guida delle società professionali raccomandano l’uso di un allenamento fisico adattato individualmente per tutti i pazienti con insufficienza cardiaca clinicamente stabile con HFrEF e HFpEF, e questo per ogni gruppo di età [1,3].
I pazienti con insufficienza cardiaca cronica stabile sono fondamentalmente da classificare come pazienti a rischio aumentato. I prerequisiti per iniziare un intervento di esercizio fisico sono quindi la stabilità clinica e una terapia ottimale con farmaci, dispositivi o interventi. L’ischemia miocardica e l’aritmia indotte dall’esercizio, così come l’exsiccosi o l’ipervolemia, devono essere escluse prima di iniziare l’esercizio fisico [3]. Le raccomandazioni di formazione devono sempre essere fatte sulla base di un’accurata stratificazione del rischio, compreso un test da sforzo. Il test da sforzo preferito è la spiroergometria con esercizio submassimale, se necessario in collaborazione con uno studio medico adeguatamente attrezzato [3]. I risultati consentono di valutare la tolleranza individuale all’esercizio e di prescrivere forme di allenamento e intensità adattate. Le raccomandazioni di formazione stabilite nelle linee guida (Tab. 1-3) forniscono dei “corridoi” per i limiti inferiori e superiori tra i quali la formazione è sicura ed efficace. Le raccomandazioni di allenamento individuali devono rientrare in questi limiti.
La formazione deve essere avviata nell’ambito di programmi strutturati guidati dal terapeuta specializzato e supervisionati da un medico. Tutte le misure di formazione dovrebbero essere continuate a lungo termine, ad esempio nei gruppi di pazienti ambulatoriali con insufficienza cardiaca. I pazienti clinicamente stabili e addestrati possono anche eseguire l’allenamento a casa. Nell’ambito dei programmi di allenamento guidato, il paziente deve essere informato sull’importanza di un’attività fisica regolare sul decorso della malattia e ricevere consigli per una routine quotidiana e di tempo libero più attiva. Il monitoraggio iniziale e la supervisione della formazione da parte dei professionisti è importante affinché i pazienti possano valutare correttamente i sintomi che possono verificarsi durante la formazione e riconoscere la loro rilevanza per il proseguimento della formazione. In questo modo, i pazienti imparano a valutare realisticamente la loro resilienza e i loro limiti di stress anche nella vita quotidiana [3].
Allenamento di resistenza aerobica moderata secondo il metodo della resistenza (MDT)
Gli effetti meglio studiati sono quelli dell’allenamento di resistenza aerobica moderata con il metodo della durata (MDT). Questa forma di allenamento influenza la progressione e la sintomatologia dell’HFrEF in molti modi. Gli effetti ben documentati includono un’influenza positiva sulla funzione autonomica del cuore, con una riduzione dell’attivazione simpatica, un miglioramento della funzione endoteliale, una riduzione del postcarico cardiaco, un miglioramento della LV-EF, una riduzione delle dimensioni del ventricolo sinistro e un miglioramento della capacità ossidativa dei muscoli scheletrici [3]. I risultati delle meta-analisi confermano il miglioramento significativo della capacità di esercizio cardiopolmonare (da +2,82 a +3,10 ml/min-1/kg-1) attraverso l’allenamento di resistenza aerobica. Le intensità di allenamento più elevate sono associate a miglioramenti maggiori [3]. I risultati di uno studio pubblicato di recente forniscono prove dell’efficacia dell’allenamento nei pazienti con HFrEF, indipendentemente dalle prestazioni cardiopolmonari all’inizio dell’allenamento [3]. Ciò significa che anche i pazienti più deboli ne traggono beneficio! Un aumento significativo del VO2 di picco derivante dall’allenamento è stato associato a una riduzione del rischio dell’81% per l’endpoint primario del ricovero ospedaliero e/o della mortalità nei pazienti con un VO2 di picco basale elevato e a una riduzione del rischio del 59% nei pazienti con un VO2 basale basso [3]. Questi risultati supportano la rilevanza dell’aumento del VO2 di picco attraverso l’allenamento adattato nei pazienti con HFrEF.
Nei pazienti con HFpEF, i risultati di una meta-analisi recentemente pubblicata di studi sull’efficacia di una MDT mostrano un aumento significativo delle prestazioni cardiopolmonari (+1,67 ml/min-1/kg-1), della mobilità (6MWD: +33,9 m) e della qualità di vita. La MDT, invece, non ha dimostrato di avere un effetto positivo sulla funzione diastolica o sulla LV-EF [7].
L’allenamento di resistenza aerobica moderata secondo il metodo della resistenza (MDT) è quindi raccomandato come allenamento di base per tutti i gruppi di pazienti. Dopo il test da sforzo sul cicloergometro, la potenza massima (Wattmax) e la frequenza cardiaca (HFmax) raggiunte possono essere utilizzate per determinare il carico di allenamento individuale. Una percentuale della FCmax o della riserva di frequenza cardiaca (HFR) viene indicata come raccomandazione di allenamento. Il controllo dell’esercizio fisico come percentuale dell’HFR è raccomandato per l’incompetenza cronotropa e, se appropriato, la terapia con bloccanti dei recettori beta. L’indicazione in percentuale di Wattmax è utile per i pazienti per i quali la FC non può essere utilizzata per il controllo dell’allenamento, ad esempio la fibrillazione atriale. Come supporto o alternativa, la sensazione soggettiva di sforzo tramite la scala di Borg e la frequenza respiratoria possono essere utilizzate per il controllo del carico [3] (Tab. 1).
Dopo il test spiroergometrico, la raccomandazione di allenamento può essere data come percentuale del VO2 di picco. La determinazione delle soglie ventilatorie (VT) e del punto di compensazione respiratoria (VT2) consente una valutazione oggettiva della prestazione aerobica e un controllo più mirato dell’allenamento [3].
L’allenamento per la resistenza aerobica deve essere inizialmente incorporato sotto forma di brevi sessioni di esercizio (5-10 minuti ≥2 volte/settimana) a intensità da bassa a moderata (40-50% VO2 di picco, 40% HFR, scala Borg 10). Con una buona tolleranza all’esercizio, si consiglia di aumentare prima la frequenza dell’allenamento (≥5 volte/settimana, preferibilmente tutti i giorni) e di aumentare la durata dell’esercizio (20-30 minuti). Questo approccio prudente è molto importante soprattutto per i pazienti decondizionati e poco resistenti all’inizio dell’allenamento. I pazienti con una buona tolleranza all’esercizio fisico devono essere introdotti gradualmente all’esercizio di resistenza più intenso, in modo individuale [3] (Tab. 1).
Allenamento di resistenza secondo il metodo a intervalli
L’allenamento secondo il metodo a intervalli è caratterizzato da un’alternanza costante di brevi periodi di sforzo e recupero. Questa forma di allenamento consente di mantenere ripetutamente un’intensità da alta a molto alta durante le fasi di carico. L’efficacia e la sicurezza a breve termine dell’interval training nei pazienti con insufficienza cardiaca sono ormai ben studiate. La discussione scientifica si concentra sull’allenamento a intervalli da intensivo ad alta intensità. Si tratta di ripetute sessioni di esercizio da brevi (≤45 s) a lunghe (2-4 min) ad intensità da alta a molto alta, ma non massimale (≥90% VO2 di picco), alternate a sessioni di recupero ad intensità da moderata a bassa.
Allenamento a intervalli con brevi fasi di carico intensivo (IT)
L’allenamento a intervalli con brevi fasi di esercizio intenso (20-30 secondi) alternate a fasi di recupero (40-60 secondi) (IT) di durata doppia (tab. 2) porta a miglioramenti comparabili nelle prestazioni cardiopolmonari e nella mobilità rispetto alla MDT nei pazienti HFrEF [3].
Questo tipo di interval training è solitamente molto ben tollerato dai pazienti con insufficienza cardiaca cronica stabile ed è considerato adatto e sicuro per tutti i gruppi di pazienti. Viene utilizzato di routine in molti programmi di riabilitazione cardiaca. Può essere fatto come alternativa o complementare alla MDT. L’uso dell’IT è particolarmente raccomandato per i pazienti anziani e/o particolarmente decondizionati con scarsa forza muscolare, nonché per i pazienti che soffrono di comorbidità come i disturbi circolatori periferici delle gambe e/o la broncopneumopatia cronica ostruttiva [3]. L’IT deve essere sempre utilizzato quando i pazienti non possono tollerare diversi minuti di esercizio continuo (dispnea o muscolatura).
Allenamento a intervalli con lunghi periodi di esercizio ad alta intensità (HIIT)
Un protocollo con lunghe fasi di carico che viene spesso utilizzato è il cosiddetto protocollo 4×4. Dopo una breve fase di riscaldamento a intensità moderata (60% HRmax), quattro intervalli di carico di 4 minuti (85-95% HRmax) si alternano a fasi di recupero di 3 minuti (60-70% HRmax). I risultati sull’efficacia e l’idoneità di questo interval training ad alta intensità (HIIT) per i pazienti con HFrEF sono ancora controversi. I risultati delle meta-analisi mostrano una maggiore efficacia dell’HIIT nel migliorare il VO2 di picco rispetto alla MDT (da +0,73 a +2,13 ml/min-1/kg-1). Tuttavia, questa superiorità dell’HIIT non ha potuto essere confermata in un grande RCT prospettico multicentrico [8]. I risultati di questo studio dimostrano un’efficacia comparabile di HIIT e MDT con aumenti significativi del VO2 di picco (HIIT +1,4 vs. MDT +1,8 ml/min-1/kg-1), senza differenze significative tra i due gruppi di allenamento. L’HIIT non ha avuto un’influenza positiva sulla LV-EF o sulle dimensioni della LV [8]. Durante l’intervento di formazione, gli eventi avversi erano equamente distribuiti in entrambi i gruppi. Tuttavia, durante il periodo di follow-up di 52 settimane, c’è stata una tendenza non significativa verso un maggior numero di eventi avversi non fatali e fatali nel gruppo HIIT [8]. Inoltre, diversi autori riferiscono che molti pazienti hanno problemi a raggiungere l’intensità di esercizio molto elevata desiderata durante l’HIIT o a mantenerla durante la fase di esercizio.
I risultati di questo studio hanno portato a non raccomandare completamente l’allenamento a intervalli ad alta intensità (HIIT) per i pazienti con HFrEF. Questa forma di allenamento dovrebbe piuttosto essere presa in considerazione nel corso a lungo termine della terapia di allenamento nei pazienti stabili con una buona tolleranza all’esercizio, se necessario in aggiunta alla MDT, oppure l’HIIT dovrebbe essere eseguito in alternativa con fasi di esercizio più brevi e possibilmente meno intense [3] (Tab. 2).
Per i pazienti con HFpEF, una meta-analisi pubblicata di recente ha dimostrato la sicurezza, la buona tolleranza e l’efficacia dell’HIIT per aumentare il picco di VO2. Non è ancora chiaro se questo metodo di allenamento sia più efficace nel migliorare il VO2 di picco rispetto alla MDT. Quando i protocolli di allenamento isocalorici vengono confrontati in uno studio, l’efficacia di entrambi i metodi è paragonabile [9].
In sintesi, il metodo di interval training offre molte possibilità di progettazione. Può essere adattato alle esigenze individuali attraverso la durata e l’intensità degli intervalli di esercizio e di recupero, nonché il rapporto tra esercizio e recupero [3]. Per tutti i protocolli di allenamento di resistenza, l’allenamento su un cicloergometro (preferibilmente con monitoraggio ECG) offre il vantaggio dell’esenzione dal peso corporeo, dell’esatta dosabilità e della riproducibilità del carico. In alternativa o a complemento dell’allenamento sulla bicicletta ergometro, l’allenamento della resistenza aerobica può essere svolto sotto forma di camminata e/o di cammino (camminata veloce con un maggiore uso delle braccia) o camminata con l’uso di bastoncini (nordic walking) su un percorso pianeggiante, cross-trainer o su un tapis roulant [3].
Allenamento dinamico della forza
I benefici e la sicurezza dell’allenamento di forza dinamica moderata nei pazienti con insufficienza cardiaca sono ben studiati. L’allenamento della forza non ha effetti negativi sulla funzione cardiaca sistolica. La risposta emodinamica centrale al carico di forza dinamico moderato è paragonabile a quella dell’allenamento di resistenza aerobica [3].
Come forma di allenamento a sé stante, l’allenamento della forza nei pazienti HFrEF porta a un miglioramento della forza muscolare e contrasta la perdita di massa muscolare causata dalla malattia. Ha anche un’influenza positiva sulla mobilità, sulle prestazioni cardiopolmonari e sulla qualità della vita [3]. Inoltre, l’allenamento dinamico della forza è adatto come prevenzione delle cadute.
Nei pazienti con HFrEF, la combinazione di allenamento di forza e resistenza porta a un aumento maggiore delle prestazioni cardiopolmonari (+2,48 ml/min-1/kg-1) e della mobilità (+50,05 m) rispetto al solo allenamento di resistenza [3].
Nei pazienti con HFpEF, tre mesi di allenamento combinato di resistenza aerobica (MDT: 50-70% VO2 di picco) in combinazione con un moderato allenamento di forza dinamica (50-60% “1-repetition maximum” [1RM]) hanno prodotto un aumento significativo del VO2 di picco (+3,3 ml/min-1/kg-1) e un miglioramento della funzione diastolica determinata ecocardiograficamente rispetto a un gruppo di controllo non attivo [10].
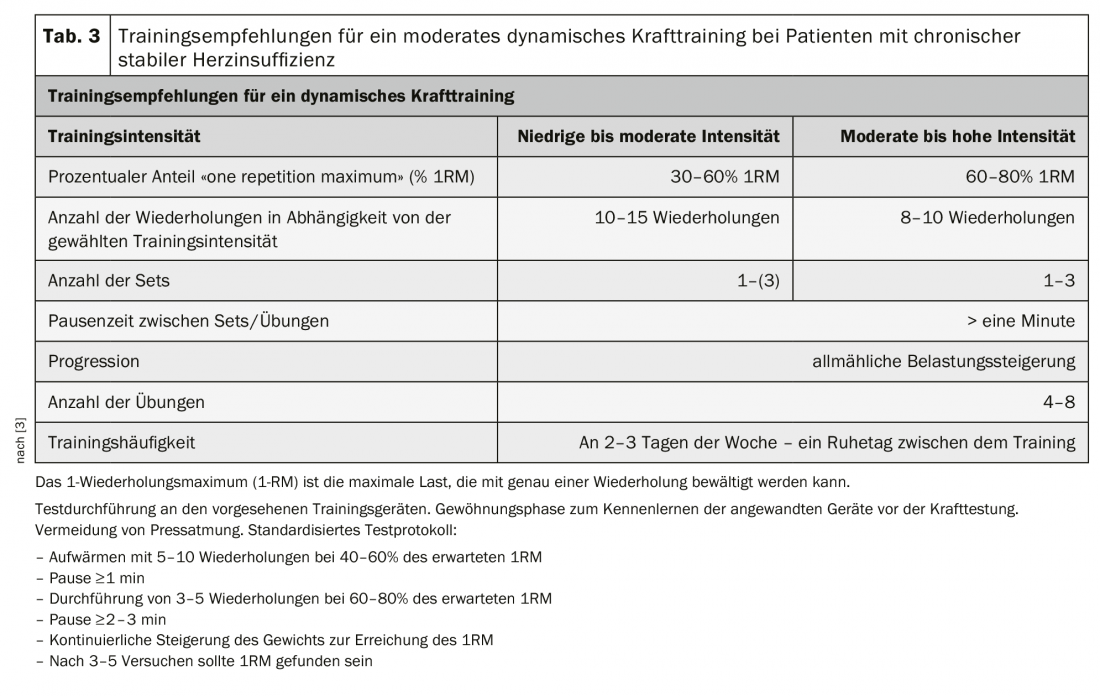
L’allenamento dinamico della forza con un’intensità da bassa a moderata e una bassa componente isometrica è quindi raccomandato come complemento all’allenamento aerobico di resistenza sia nei pazienti HFrEF che HFpEF [3]. Un’introduzione dolce all’allenamento della forza con un’intensità molto bassa, un numero ridotto di ripetizioni e una velocità di movimento lenta serve per imparare e praticare la corretta esecuzione degli esercizi e la respirazione. La respirazione pressata con le labbra chiuse deve essere evitata a tutti i costi. I pazienti devono inspirare ed espirare lentamente con la bocca aperta, a ritmo con il movimento. L’allenamento della forza deve essere iniziato con un carico da basso a moderato <30-50 1RM. Con una buona tolleranza all’esercizio, l’intensità può essere gradualmente aumentata individualmente nel corso del programma di allenamento [3] (Tab. 3).
Letteratura:
- Ponikowski P, Voors AA, Anker SD, et al.: Linee guida ESC 2016 per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica: La Task Force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica della Società Europea di Cardiologia (ESC). Sviluppato con il contributo speciale della Heart Failure Association (HFA) dell’ESC. Eur J Heart Fail 2016; 18: 891-975.
- Associazione Medica Tedesca (BÄK), Associazione Nazionale dei Medici di Assicurazione Sanitaria Statutaria (KBV), Associazione delle Società Mediche Scientifiche (AWMF). Linea guida nazionale sull’insufficienza cardiaca cronica – versione lunga, Terza edizione. Versione 2. 2019 [citato: 17-06-2020]; doi: 10.6101/AZQ/000467. www.herzinsuffizienz.versorgungsleitlinien.de.
- S3 – Linea guida sulla riabilitazione cardiaca (LL-KardReha) nell’Europa di lingua tedesca, Germania, Austria, Svizzera (D-A-CH), Versione lunga – Parte 1, 2019; Numero di registro AWMF: 133/001, www.awmf.org.
- Tschöpe C, Birner C, Böhm M, et al.: Insufficienza cardiaca con frazione di eiezione conservata: gestione attuale e strategie future: parere di esperti a nome del Nucleo del “Gruppo di lavoro sull’insufficienza cardiaca” della Società tedesca di cardiologia (DKG). Clin Res Cardiol 2018; 107: 1-19.
- Orimoloye OA, Kambhampati S, Hicks AJ, et al: Una maggiore forma fisica cardiorespiratoria predice la sopravvivenza a lungo termine nei pazienti con insufficienza cardiaca e frazione di eiezione conservata: il Progetto Henry Ford Exercise Testing (FIT). Arch Med Sci 2019; 15: 350-358.
- Tucker WJ, Haykowsky MJ, Seo Y, et al: Tolleranza all’esercizio compromessa nell’insufficienza cardiaca: ruolo della morfologia e della funzione del muscolo scheletrico. Curr Heart Fail Rep 2018; 15: 323-331.
- Fukuta H, Goto T, Wakami K, et al: Effetti dell’allenamento sulla funzione cardiaca, sulla capacità di esercizio e sulla qualità di vita nell’insufficienza cardiaca con frazione di eiezione conservata: una meta-analisi di studi controllati randomizzati. Heart Fail Rev 2019; 24: 535-547.
- Ellingsen Ø, Hall M, Conraads V, et al: L’interval training ad alta intensità nei pazienti con insufficienza cardiaca con frazione di eiezione ridotta. Circolazione 2017; 135: 839-849.
- Gomes Neto M, Durães AR, Conceição LSR, et al: L’interval training ad alta intensità rispetto all’allenamento continuo a moderata intensità sulla capacità di esercizio e sulla qualità della vita nei pazienti con insufficienza cardiaca con frazione di eiezione ridotta: una revisione sistematica e una meta-analisi. Int J Cardiol 2018; 261: 134-141.
- Edelmann F, Gelbrich G, Düngen HD, et al: L’allenamento all’esercizio migliora la capacità di esercizio e la funzione diastolica nei pazienti con insufficienza cardiaca con frazione di eiezione conservata: risultati dello studio pilota Ex-DHF (Exercise training in Diastolic Heart Failure). J Am Coll Cardiol 2011; 58: 1780-1791.
PRATICA GP 2020; 15(9): 11-16