L’anticoagulazione orale con gli anticoagulanti orali non vitamina K-dipendenti (NOAK) nei pazienti con fibrillazione atriale è una storia di successo. Dall’introduzione di queste sostanze in Svizzera, quasi 10 anni fa, si sono affermate come la terapia preferita nella prevenzione dell’ictus. Qual è l’esperienza nella pratica?
L’anticoagulazione orale con gli anticoagulanti orali non vitamina K-dipendenti (NOAK) nei pazienti con fibrillazione atriale è una storia di successo. Dall’introduzione di queste sostanze in Svizzera, quasi 10 anni fa, si sono affermate come la terapia preferita nella prevenzione dell’ictus; dati più recenti provenienti da ampi registri, che sono ora disponibili, possono anche confermare i risultati degli studi di registrazione nei pazienti nella vita quotidiana. In questa breve rassegna riassumiamo alcuni aspetti nuovi e rilevanti per la pratica.
Nuove linee guida ESC sulla fibrillazione atriale
Al congresso di quest’anno della Società Europea di Cardiologia, che si è tenuto virtualmente a causa della pandemia COVID 19, è stata presentata la raccomandazione della linea guida adattata per la gestione della fibrillazione atriale, che è stata pubblicata contemporaneamente sull’European Heart Journal [1]. Una novità importante è l’adattamento “semplificato” nella diagnosi e nella gestione di questa aritmia cardiaca; la semplice regola empirica è “da CC a ABC” (Tab. 1) . All’inizio, la fibrillazione atriale deve essere diagnosticata correttamente (Confermare la fibrillazione atriale) e poi deve essere fatta una caratterizzazione oggettiva di quanto sia avanzato il problema (Caratterizzare la fibrillazione atriale). Per quest’ultima, si applicano le “4S”: valutazione del rischio di ictus, gravità dei sintomi, frequenza/severità della FA e infine analisi del substrato della FA (cambiamenti morfologici già avvenuti nell’atrio). Una volta fatto questo, viene avviata la terapia. Evitare l’ictus è particolarmente importante, ma anche un migliore controllo dei sintomi e il trattamento delle comorbidità e dei fattori di rischio cardiovascolare sono fattori importanti nel trattamento integrativo dei pazienti con FA. L’ultimo aspetto in particolare non deve essere sottovalutato; la riduzione del peso non è solo quoad vitam, ma anche cruciale per quanto riguarda il controllo del ritmo nella fibrillazione atriale [2]. La situazione è molto simile a quella di altri fattori di rischio cardiovascolare, come l’ipertensione arteriosa [3], il diabete mellito [4] e la sindrome da apnea ostruttiva del sonno [5]. Tutte queste comorbilità devono essere affrontate se si vuole che la fibrillazione atriale sia trattata in modo completo e appropriato per il paziente.
Diagnosi di fibrillazione atriale
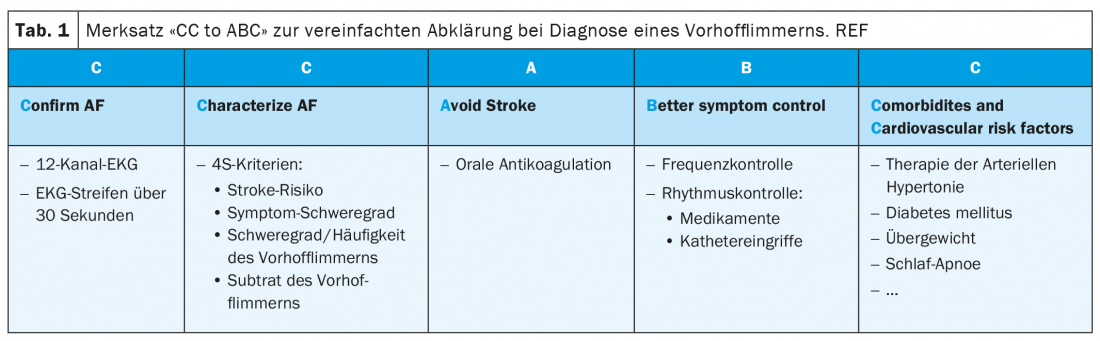
Secondo le nuove linee guida, la fibrillazione atriale è definita come un’aritmia sopraventricolare con attivazione elettrica atriale non coordinata e quindi contrazione atriale insufficiente. È importante distinguere la fibrillazione atriale clinica dalla fibrillazione atriale subclinica e dai cosiddetti episodi di alta frequenza atriale (AHRE). La fibrillazione atriale clinica è presente, indipendentemente dalla presenza di sintomi, se viene registrata su un ECG a 12 derivazioni o documentata per almeno 30 secondi su una registrazione ECG semplice (scheda 2) . Per la registrazione dell’ECG, oggi si utilizzano tecnologie diagnostiche più moderne, come i telefoni cellulari e/o gli orologi specializzati, oltre ai classici esami Holter a lungo termine. In effetti, due grandi studi pubblicati di recente su una popolazione sana di diverse centinaia di migliaia di persone con un ECG mobile (tramite un telefono cellulare o un orologio) hanno dimostrato che lo 0,23-0,5% di questa popolazione ha avuto episodi di polso irregolare [6,7]. Il successivo work-up cardiaco ha confermato la presenza di FA nell’84 e nell’87% di queste persone. Si parla di fibrillazione atriale subclinica quando una registrazione automatica – ad esempio utilizzando un pacemaker o uno smartwatch – suggerisce una fibrillazione atriale in un paziente asintomatico, ma questo non può essere confermato da un ECG standard [1]. Gli episodi di alta frequenza atriale sono menzionati nelle linee guida come una forma speciale di fibrillazione atriale subclinica. Questi corrispondono a tachicardie atriali parossistiche documentate da un pacemaker o defibrillatore impiantato. Di norma, queste sono definite come tachicardie con una frequenza atriale superiore a 175/min e una durata minima di 5 minuti. Se tali episodi vengono riscontrati e documentati su un ECG durante il decorso e interpretati come fibrillazione atriale, si può fare la diagnosi di fibrillazione atriale clinica. La gestione dei pazienti con fibrillazione atriale subclinica, sia in termini di OAK che di possibile terapia dell’aritmia, non è attualmente chiarita in modo definitivo. L’anticoagulazione orale è solitamente consigliata per un rischio elevato di ictus e per episodi frequenti/di lunga durata (ad esempio >24 ore), ma non per un rischio basso o medio con episodi piuttosto rari (<6 minuti). Nell’ampia zona grigia intermedia, gli studi attualmente ancora in corso faranno chiarezza nell’ulteriore corso [8,9].
Indicazione per l’anticoagulazione orale nella fibrillazione atriale
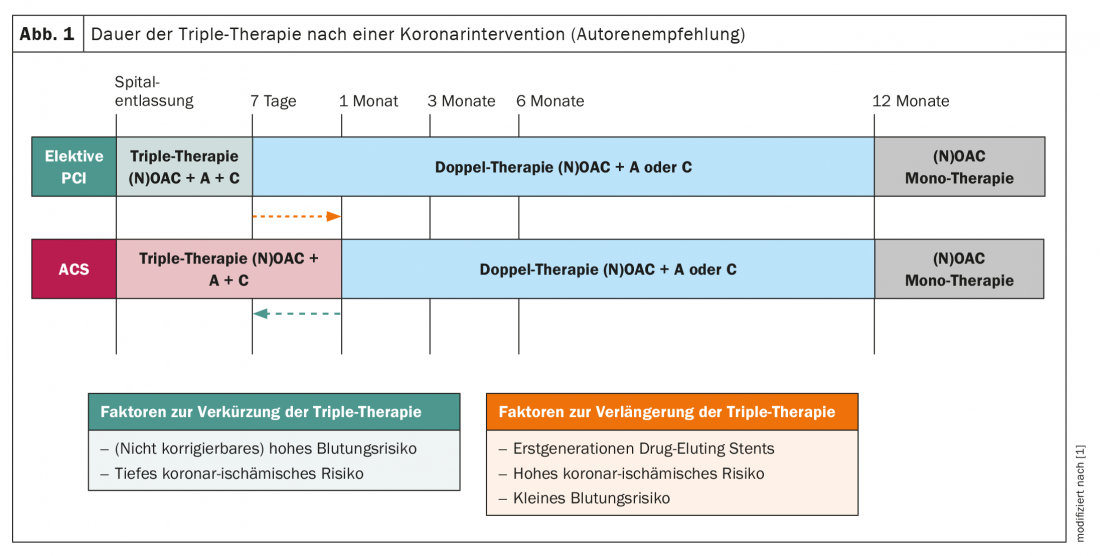
La necessità di fluidificare il sangue nei pazienti con FA clinica si basa sul rischio, calcolato con il punteggio CHA2DS2-VASC (scheda 3). È importante notare che la durata e la frequenza della FA non sono incluse nel punteggio CHA2DS2-VASC. Sebbene i dati dei registri confermino che il rischio di eventi tromboembolici aumenta con il peso della FA (AHRE/frequenza subclinica < FA parossistica < FA permanente) [10–12], solo i fattori di rischio descritti nel punteggio CHA2DS2-VASC sono determinanti per l’indicazione dell’anticoagulazione orale. [1]. Con un punteggio CHA2DS2-VASC ≥2 negli uomini o ≥3 nelle donne, è indicata l’anticoagulazione orale, preferibilmente mediante un NOAK (raccomandazione di Classe I, “Livello di evidenza” A). Se il punteggio CHA2DS2-VASC è 0 negli uomini o 1 nelle donne, non si deve eseguire alcuna fluidificazione del sangue; se il punteggio è 1 (o 2 nelle donne), le linee guida raccomandano l’anticoagulazione orale con una raccomandazione di classe IIa (Livello di evidenza B) [1,13]. Nelle attuali linee guida, la valutazione del rischio di emorragia mediante il punteggio HAS-BLED è diventata più importante (tab. 3) [1]. È importante notare che il punteggio HAS-BLED non viene utilizzato per sospendere l’anticoagulazione orale (in quanto non è mai stato studiato in uno studio randomizzato a tale scopo), ma piuttosto per identificare e trattare i rischi di emorragia modificabili (ad esempio, pressione arteriosa non adeguatamente controllata, pazienti difficili da controllare che assumono antagonisti della vitamina K) in caso di rischio di emorragia elevato (punteggio HAS-BLED ≥3), o per monitorare tali pazienti in modo ancora più regolare, a seconda del contesto clinico, al fine di poter reagire a possibili problemi di emorragia in una fase precoce [1].
NOAKs nella fibrillazione atriale e nella cardiopatia coronarica
La presenza contemporanea di malattia coronarica (CHD) e fibrillazione atriale è comune ed è associata ad un aumento del rischio di eventi cardiovascolari. Bisogna distinguere due scenari diversi: I pazienti con una sindrome coronarica acuta o con un intervento coronarico e quelli con una situazione coronarica cronica (precedentemente chiamata “stabile”).
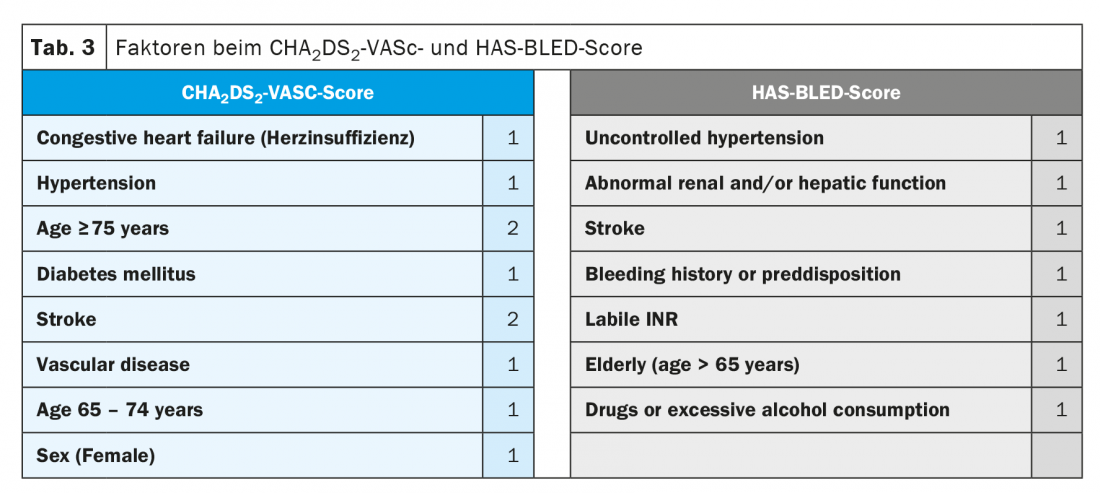
Pazienti con fibrillazione atriale e sindrome coronarica acuta o con intervento coronarico: in passato, i pazienti con fibrillazione atriale che soffrono di una sindrome coronarica acuta o richiedono un intervento coronarico elettivo sono stati tradizionalmente trattati con tripla anticoagulazione a base di antagonisti della vitamina K, spesso per un periodo fino a un anno. Lo studio WOEST ha dimostrato che il danno (eventi emorragici) è spesso significativamente superiore al beneficio incrementale (protezione da nuovi eventi tromboembolici) rispetto alla doppia anticoagulazione (warfarin e un solo agente antiaggregante), soprattutto se la triplice terapia viene effettuata per 12 mesi [14]. Pertanto, questo lungo periodo di anticoagulazione più intensiva è stato abbandonato da tempo; tuttavia, il ruolo delle NOAK in questa situazione clinica non era chiaro fino a poco tempo fa. Nel frattempo, sono disponibili studi randomizzati per tutte e quattro le sostanze che hanno studiato i singoli NOAK, compresa la durata della terapia in questo scenario (PIONEER AF-PCI per rivaroxaban [15], RE-DUAL PCI per dabigatran [16], ENTRUST AF-PCI per edoxaban [17], e AUGUSTUS per apixaban [18]). Tutti e quattro gli studi hanno dimostrato che l’incidenza di emorragie rilevanti era significativamente più bassa con la combinazione di un NOAK con un inibitore piastrinico rispetto alla tripla combinazione con un antagonista della vitamina K, anche se non era rilevabile un effetto sulla mortalità per tutte le cause (a differenza dello studio WOEST). Questi dati dimostrano che la combinazione di farmaci antiaggreganti con un NOAK è sicura nei pazienti con fibrillazione atriale e intervento coronarico/ACS (Fig. 1). Allo stesso tempo, però, va detto che un segnale coerente per un tasso forse leggermente aumentato di infarto miocardico e trombosi dello stent si è presentato in tutti gli studi [19]. Per quanto riguarda la durata della tripla anticoagulazione, le nuove linee guida ESC raccomandano che dopo l’ACS o dopo un intervento elettivo, questa dovrebbe essere effettuata per <7 giorni e poi passare alla terapia duale (NOAK e solitamente clopidogrel). Tuttavia, in caso di aumento del rischio ischemico coronarico, questo periodo può essere esteso fino a 1 mese, il che sembra abbastanza giustificabile alla luce del segnale sopra citato di un discreto aumento del rischio di infarto miocardico in questi pazienti. Successivamente, la duplice terapia deve essere continuata in entrambi gli scenari clinici fino al mese 12 incluso (mese 6 se c’è un alto rischio di sanguinamento) (Fig. 1).
Pazienti con fibrillazione atriale e malattia coronarica cronica: dalle Linee Guida ESC del 2010, sulla base di studi più vecchi in questo contesto, si raccomanda di trattare i pazienti con CAD cronica e VCF con i soli antagonisti della vitamina K senza l’aggiunta di aspirina. Gli studi pivotali sui NOAK per i pazienti con FA hanno incluso una percentuale rilevante di pazienti con CHD. Questa popolazione non si è comportata in modo diverso dagli altri partecipanti allo studio, il che ha portato alla conclusione che i NOAK possono essere somministrati anche come monoterapia nella CHD cronica. Lo studio AFIRE, specificamente progettato in Giappone, ha arruolato 2236 pazienti con CHD cronica e FA e li ha randomizzati a rivaroxaban (alla dose approvata in Giappone di 15 mg) più aspirina o alla monoterapia con rivaroxaban [20]. Come previsto, la monoterapia è stata superiore alla terapia combinata in termini di eventi emorragici (HR 0,59; p=0,01); allo stesso tempo, non si è verificato un aumento degli eventi tromboembolici (al contrario, il numero di questi eventi è stato addirittura numericamente inferiore del 30%). Questi dati supportano la raccomandazione di utilizzare i NOAK come monoterapia (senza combinazione con un agente antiaggregante) nei pazienti con CHD cronica e FA.
Excursus: Anticoagulazione nei pazienti con cardiopatia coronarica cronica SENZA fibrillazione atriale
I pazienti con CHD cronica senza VHF sono stati trattati con aspirina per la profilassi secondaria [21]. Contrariamente alla designazione precedente, tuttavia, questi pazienti non sono affatto considerati “stabili”, ma continuano ad avere un rischio rilevante di eventi cardiovascolari e una mortalità complessiva più elevata. Per ridurre questo tasso, lo studio COMPASS ha esaminato se l’inibizione simultanea delle piastrine (con l’aspirina) e della cascata della coagulazione plasmatica – quest’ultima utilizzando rivaroxaban a dosi molto basse di 2× 2,5 mg al giorno – mostrasse un beneficio [22]. Nei quasi 24.000 pazienti inclusi, la terapia combinata ha mostrato una riduzione significativa del 24% dell’endpoint primario (ictus, infarto miocardico, morte cardiovascolare) rispetto alla sola aspirina. A causa del beneficio pronunciato, lo studio ha dovuto essere interrotto prematuramente un anno prima del termine previsto. Sebbene l’incidenza di emorragie sia aumentata del 70% con la combinazione, non c’è stata alcuna differenza nelle emorragie maggiori clinicamente rilevanti o nella temuta emorragia intracranica. Questo dimostra che la maggior parte degli eventi emorragici non erano clinicamente pericolosi – a differenza degli eventi ischemici che sono stati prevenuti. Al fine di comparare i simili con i simili, nello studio COMPASS è stato predefinito il cosiddetto beneficio clinico netto. Questo riassume gli eventi tromboembolici ed emorragici più gravi. Il tasso di eventi è stato del 20% inferiore con la terapia combinata rispetto alla monoterapia. È anche importante notare che questo beneficio clinico netto aumenta nel tempo, poiché gli eventi di sanguinamento si sono verificati principalmente al basale – ma il rischio di eventi ischemici aumenta costantemente negli anni [23]. Infine, va ricordato che la mortalità per tutte le cause era più bassa nella terapia combinata rispetto alla monoterapia con aspirina (anche se lo studio non era più alimentato per questo a causa dell’interruzione prematura) [22]. Questi dati sono stati inseriti nelle nuove raccomandazioni ESC sulla profilassi secondaria nella CHD cronica, dove la combinazione di aspirina e rivaroxaban 2× 2,5 mg può essere considerata una nuova opzione di trattamento [24].
Messaggi da portare a casa
- Gli anticoagulanti orali non dipendenti dalla vitamina K sono oggi il gold standard nella prevenzione dell’ictus nella fibrillazione atriale.
- La terapia completa della fibrillazione atriale comprende l’anticoagulazione e il controllo del ritmo/frequenza, oltre alla terapia dei fattori di rischio cardiovascolare.
- Anche i dispositivi moderni, come i telefoni cellulari e gli orologi digitali con il software appropriato, possono essere utilizzati a scopo diagnostico.
- I NOAK da soli possono essere utilizzati anche nei pazienti con cardiopatia coronarica in stato cronico.
Letteratura:
- Hindricks G, Potpara T, Dagres N, et al: Linee guida ESC 2020 per la diagnosi e la gestione della fibrillazione atriale sviluppate in collaborazione con l’Associazione Europea di Chirurgia Cardio-Toracica (EACTS). Eur Heart J. 2020.
- Pathak RK, Middeldorp ME, Meredith M, et al: Effetto a lungo termine della gestione del peso mirata in una coorte di pazienti affetti da fibrillazione atriale: uno studio di follow-up a lungo termine (LEGACY). J Am Coll Cardiol. 2015;65: 2159-2169.
- Dzeshka MS, Shantsila A, Shantsila E, Lip GYH: Fibrillazione atriale e ipertensione. Ipertensione. 2017;70: 854-861.
- Chang SH, Wu LS, Chiou MJ, et al: Associazione della metformina con un minor rischio di fibrillazione atriale tra i pazienti con diabete mellito di tipo 2: una coorte dinamica basata sulla popolazione e studi in vitro. Cardiovasc Diabetol. 2014; 13: 123.
- Li L, Wang ZW, Li J, et al: Efficacia dell’ablazione con catetere della fibrillazione atriale nei pazienti con apnea ostruttiva del sonno con e senza trattamento con pressione positiva continua delle vie aeree: una meta-analisi di studi osservazionali. Europace. 2014;16: 1309-1314.
- Guo Y, Wang H, Zhang H, et al: Tecnologia fotopletismografica mobile per rilevare la fibrillazione atriale. J Am Coll Cardiol. 2019;74: 2365-2375.
- Perez MV, Mahaffey KW, Hedlin H, et al: Valutazione su larga scala di uno smartwatch per identificare la fibrillazione atriale. N Engl J Med. 2019;381: 1909-1917.
- Lopes RD, Alings M, Connolly SJ, et al: Razionale e disegno dello studio Apixaban for the Reduction of Thrombo-Embolism in Patients With Device-Detected Sub-Clinical Atrial Fibrillation (ARTESiA). Am Heart J. 2017;189: 137-145.
- Kirchhof P, Blank BF, Calvert M, et al: Sondaggio dell’anticoagulazione orale nei pazienti con episodi di alta frequenza atriale: Razionale e disegno dello studio Anticoagulanti orali non antagonisti della vitamina K in pazienti con episodi di alta frequenza atriale (NOAH-AFNET 6). Am Heart J. 2017;190: 12-18.
- Mahajan R, Perera T, Elliott AD, et al: Fibrillazione atriale subclinica rilevata dal dispositivo e rischio di ictus: una revisione sistematica e una meta-analisi. Eur Heart J. 2018;39: 1407-1415.
- Perera KS, Sharma M, Connolly SJ, et al: Tipo di ictus e gravità nei pazienti con fibrillazione atriale subclinica: un’analisi dello studio Asymptomatic Atrial Fibrillation and Stroke Evaluation in Pacemaker Patients and the Atrial Fibrillation Reduction Atrial Pacing Trial (ASSERT). Am Heart J. 2018;201: 160-163.
- Ogawa H, An Y, Ikeda S, et al: La progressione da fibrillazione atriale parossistica a sostenuta è associata a un aumento degli eventi avversi. Ictus. 2018;49: 2301-2308.
- Fauchier L, Clementy N, Bisson A, et al: I pazienti con fibrillazione atriale con un solo fattore di rischio CHA2DS2-VASc non correlato al sesso dovrebbero essere anticoagulati? Ictus. 2016;47: 1831-1836.
- Dewilde WJ, Oirbans T, Verheugt FW, et al: Uso di clopidogrel con o senza aspirina nei pazienti che assumono una terapia anticoagulante orale e che si sottopongono a un intervento coronarico percutaneo: uno studio controllato, randomizzato e in aperto. Lancet. 2013;381: 1107-1115.
- Gibson CM, Mehran R, Bode C, et al: Prevenzione del sanguinamento nei pazienti con fibrillazione atriale sottoposti a PCI. N Engl J Med. 2016;375: 2423-2434.
- Cannon CP, Bhatt DL, Oldgren J, et al: Doppia terapia antitrombotica con Dabigatran dopo PCI nella fibrillazione atriale. N Engl J Med. 2017;377: 1513-1524.
- Vranckx P, Valgimigli M, Eckardt L, et al: Regime antitrombotico basato su Edoxaban rispetto a quello basato su antagonisti della vitamina K dopo uno stenting coronarico di successo in pazienti con fibrillazione atriale (ENTRUST-AF PCI): uno studio randomizzato, in aperto, di fase 3b. Lancet. 2019;394: 1335-1343.
- Lopes RD, Heizer G, Aronson R, et al: Terapia antitrombotica dopo sindrome coronarica acuta o PCI nella fibrillazione atriale. N Engl J Med. 2019; 380: 1509-1524.
- Gargiulo G, Goette A, Tijssen J, et al: Sicurezza e risultati di efficacia della terapia antitrombotica doppia rispetto a quella tripla nei pazienti con fibrillazione atriale dopo un intervento coronarico percutaneo: una revisione sistematica e una meta-analisi di studi clinici randomizzati basati su anticoagulanti orali non antagonisti della vitamina K. Eur Heart J. 2019;40: 3757-3767.
- Yasuda S, Kaikita K, Akao M, et al: Terapia antitrombotica per la fibrillazione atriale con malattia coronarica stabile. N Engl J Med. 2019; 381: 1103-1113.
- Antithrombotic Trialists C, Baigent C, Blackwell L, et al: Aspirina nella prevenzione primaria e secondaria delle malattie vascolari: meta-analisi collaborativa dei dati dei singoli partecipanti agli studi randomizzati. Lancet. 2009;373: 1849-1860.
- Eikelboom JW, Connolly SJ, Bosch J, et al: Rivaroxaban con o senza Aspirina nella malattia cardiovascolare stabile. N Engl J Med. 2017;377: 1319-1330.
- Steffel J, Eikelboom JW, Anand SS, et al: The COMPASS Trial: Net Clinical Benefit of Low-Dose Rivaroxaban Plus Aspirin as compared with Aspirin in Patients With Chronic Vascular Disease. Circolazione. 2020;142: 40-48.
- Knuuti J, Wijns W, Saraste A, et al: Linee guida ESC 2019 per la diagnosi e la gestione delle sindromi coronariche croniche. Eur Heart J. 2020; 41: 407-477.
- Steffel, et al: European Heart Journal 2018; 39: 1330-1393.
CARDIOVASC 2020: 19(4): 6-10