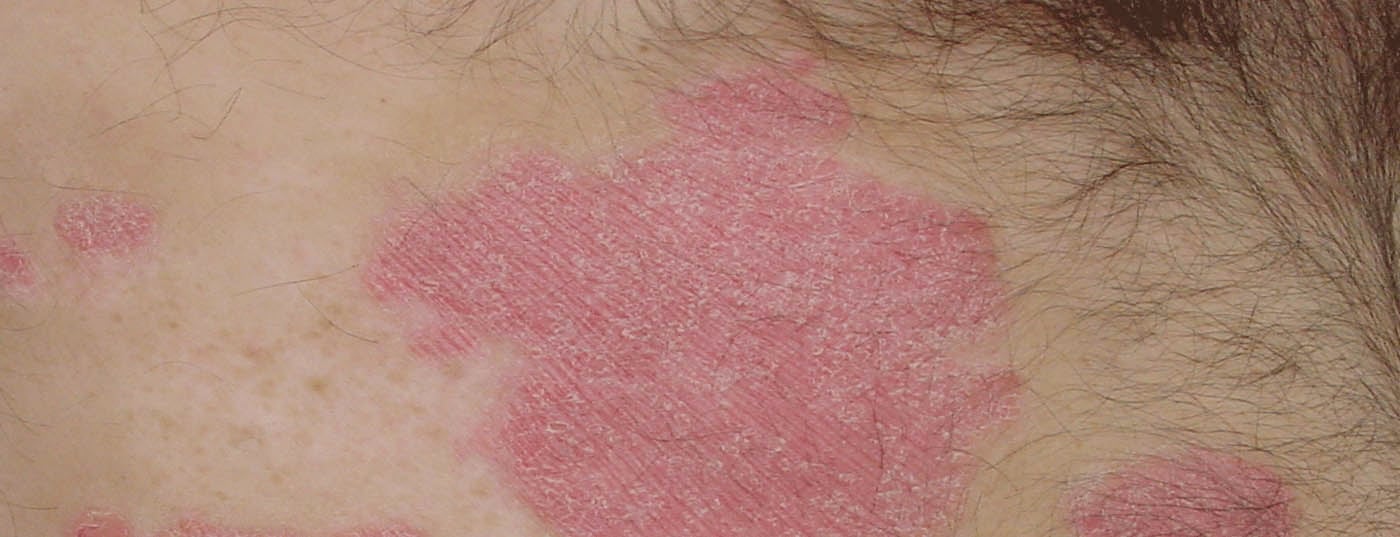
In un’intervista con DERMATOLOGIE PRAXIS, il Dr. med. Simon Müller, medico senior in dermatologia presso l’Ospedale Universitario di Basilea, parla dell’argomento “Terapia della psoriasi a placche”. Fornisce una panoramica completa degli sviluppi degli ultimi anni, discute i vantaggi e gli svantaggi dell’era dei biologici e parla delle sue esperienze in clinica. Vengono affrontati anche la selezione dei pazienti, la marcia psoriasica e l’aderenza.
Dottor Müller, come valuta personalmente gli sviluppi della terapia della psoriasi dall’inizio del millennio? O più specificamente, quali vantaggi e svantaggi decisivi ha portato l’era dei biologici per lei come medico?
Dottor Müller:
L’introduzione dei biologici ha stimolato la ricerca clinica e di base sulla psoriasi. Di conseguenza, sono stati fatti grandi progressi nella comprensione della patogenesi, ma anche nella cura. L’enorme attività di ricerca sulla psoriasi negli ultimi 15 anni è certamente dovuta in gran parte all’enorme volume di mercato globale, che deriva in parte dalla prevalenza di circa il 2% nella popolazione normale e dalla cronicità.
Nel frattempo, come medico ho quasi un problema di lusso: posso scegliere tra diverse terapie sistemiche ben e molto efficaci. Può essere difficile tenere il conto e decidere quale terapia sia la più adatta per quale paziente. Oltre alla buona efficacia e alla minore tossicità per gli organi rispetto al metotrexato o alla ciclosporina, i biologici ci hanno portato anche un nuovo profilo di effetti collaterali e una moltiplicazione dei costi dei farmaci rispetto a queste terapie sistemiche convenzionali – entrambi aspetti che devo considerare come medico.
Come decide nella clinica dermatologica di Basilea quando utilizzare la terapia locale, UV o sistemica (segue rigorosamente la gravità o i valori PASI/BSA/DLQI)?
In linea di principio, seguiamo già le raccomandazioni del Programma di Consenso Europeo del 2010 – cioè PASI >10 o BSA >10, a condizione che anche il DLQI sia >10. In ultima analisi, naturalmente, anche le esigenze del paziente e i fattori individuali, come le co-morbilità, influiscono sulla pianificazione della terapia. Le raccomandazioni includono anche criteri “morbidi” per situazioni speciali che consentono un certo margine di manovra, come la resistenza al trattamento di piccole aree, l’infestazione delle unghie, dei genitali o palmoplantare. La valutazione di una terapia di sistema nei pazienti con artrite psoriasica, nei bambini, nelle donne in gravidanza, nei pazienti con malattie consumistiche o infettive, nella demenza o nella malcompliance viene effettuata nel nostro team o nella nostra clinica. interdisciplinare.
Come si comporta il Dermatology Life Quality Index (DLQI) come strumento decisionale nella classificazione della gravità? Secondo lei, ha senso dare così tanto valore alla valutazione soggettiva della malattia rispetto alla valutazione clinica del medico per quanto riguarda la decisione terapeutica?
La maggior parte degli studi misura la risposta PASI-75 o, negli studi più recenti, la risposta PASI-90 o addirittura la clearance come endpoint primario. Questo è utile anche per poter confrontare gli studi almeno approssimativamente in modo oggettivo. D’altra parte, il PASI non riflette la valutazione soggettiva del paziente, risultando in una valutazione di gravità unilaterale centrata sul medico. Questo è il motivo per cui personalmente considero il DLQI molto utile come “strumento decisionale”, perché una risposta PASI-50 può già portare un miglioramento soggettivo maggiore per un paziente rispetto, ad esempio, a una risposta PASI-75 per un altro. Inoltre, sebbene il PASI sia adatto agli studi clinici, secondo la mia esperienza non è sempre praticabile nella pratica clinica quotidiana ed è soggetto a una significativa variabilità inter-rater.
Tuttavia, il fatto che il DLQI sia addirittura valutato più alto del PASI secondo il suddetto Programma di Consenso Europeo è considerato in modo controverso, perché i pazienti sottotrattati hanno un rischio maggiore di “marcia psoriasica” o “eruzione cutanea psoriasica” accelerata. sarebbe possibile un aumento dell’artrite psoriasica. Inoltre, il DLQI chiede solo gli ultimi sette giorni, quindi potrebbe essere solo un’istantanea insufficiente.
Sulla terapia locale: come e con quali vantaggi i corticosteroidi topici possono essere combinati con analoghi della vitamina D3 o con l’acido salicilico?
La terapia combinata di corticosteroidi topici con analoghi della vitamina D3 o acido salicilico è più potente della rispettiva monoterapia e risparmia gli steroidi. Con gli analoghi della vitamina D3, è importante notare che si deve utilizzare al massimo un tubo da 100 g alla settimana, a causa del potenziale di ipercalcemia. Secondo il compendio farmaceutico, non dovrebbero essere utilizzati nei bambini a causa della mancanza di esperienza, anche se non viene definito un limite di età. L’effetto cheratolitico dell’acido salicilico è utile finché c’è una desquamazione significativa, tra l’altro per migliorare la penetrazione dei corticosteroidi topici. Nei bambini, l’applicazione su larga scala di acido salicilico non deve essere effettuata a causa della potenziale neurotossicità e nefrotossicità.
Quanto è importante la terapia UV oggi (soprattutto dopo l’introduzione dei biologici)?
Le terapie UV sono state per decenni un pilastro del trattamento della psoriasi da moderata a grave. Tuttavia, come abbiamo potuto dimostrare sulla base dei nostri dati, la loro importanza è chiaramente diminuita dopo l’introduzione dei biologici per questa indicazione. Nella nostra clinica, il numero di trattamenti con la terapia UV si è approssimativamente dimezzato negli ultimi 15 anni, e da diversi anni non eseguiamo più la PUVA sistemica. Tuttavia, la terapia con i raggi UV ha ancora un ruolo importante nelle forme lievi o inizialmente nelle forme da moderate a gravi, fino a quando la terapia sistemica non fa effetto. Un’ulteriore combinazione con la terapia sistemica è controindicata a causa del rischio potenzialmente aumentato di fotocarcinogenesi. Occasionalmente, la terapia UV può ancora offrire un’alternativa alla terapia sistemica – ad esempio, durante la gravidanza o in caso di determinate controindicazioni, come l’epatopatia grave.
Quali sono i nuovi sviluppi o principi attivi nel campo dei biologici e delle piccole molecole e come li classifica?
Negli ultimi tre anni, molti di questi prodotti, come gli antagonisti dell’IL-17 secukinumab e brodalumab o le piccole molecole apremilast, un inibitore della fosfodiesterasi-4, e tofacitinib, un inibitore della janus chinasi, hanno raggiunto la maturità del mercato e, in alcuni casi, sono già stati approvati per la psoriasi e l’artrite psoriasica in alcuni Paesi. Di questi, solo Cosentyx® (secukinumab) è attualmente approvato in Svizzera. Anche gli altri riceveranno probabilmente l’approvazione in questo Paese nei prossimi uno o due anni.
L’autorizzazione all’immissione in commercio di brodalumab ha subito una svolta inaspettata il 22 maggio 2015. A causa di segnalazioni di pensieri e azioni suicide durante la fase di “estensione open-label”, Amgen ha interrotto l’ulteriore sviluppo di brodalumab con effetto immediato. La responsabilità di brodalumab è ora di AstraZeneca e il futuro di questo prodotto è incerto. Dopo Efalizumab e Briakinumab, questo è un altro esempio di ritiro improvviso di un farmaco biologico a causa di problemi di sicurezza poco prima o addirittura dopo l’approvazione del mercato.
Numerosi altri farmaci biologici e piccole molecole sono attualmente in fase di sperimentazione II e III e probabilmente ci terranno occupati nel medio termine. Il vero valore di tutti questi nuovi prodotti sarà chiaro solo dopo cinque o dieci anni di esperienza di mercato. Negli studi clinici, tuttavia, almeno alcuni di essi sono promettenti, in quanto potrebbero funzionare in modo più rapido ed efficiente rispetto ai biologici consolidati. Anche le terapie orali come l’apremilast possono offrire nuovi benefici.
Oltre alle nuove terapie di sistema, gli inibitori della Janus chinasi, gli inibitori della fosfodiesterasi e i nuovi analoghi della vitamina D sono attualmente oggetto di studi clinici come prodotti topici. Alcune voci affermano che la saturazione del mercato è già stata raggiunta per gli antipsoriasici – e ci sono ancora nuovi farmaci in cantiere. Così, diventa sempre più difficile per un singolo prodotto distinguersi dagli altri. Forse questa saturazione del mercato avrà un effetto favorevole sui prezzi di queste terapie da un punto di vista economico-sanitario, il che sarebbe benvenuto. Ci si aspettano anche nuove prospettive, soprattutto per quanto riguarda i prezzi, con i cosiddetti biosimilari, che stimoleranno il mercato degli antipsoriatici nei prossimi anni, quando scadrà la protezione brevettuale di etanercept e adalimumab.
Con quale frequenza viene utilizzato il metotrexato nella sua clinica (rispetto agli altri farmaci sistemici convenzionali o ai biologici)?
Il metotrexato è ben sperimentato, molto spesso efficace con una buona tolleranza e, allo stesso tempo, è il più conveniente di tutti i farmaci sistemici per la psoriasi. Per questo motivo, è ancora la terapia di prima linea di scelta per la psoriasi da moderata a grave – controindicazioni incluse. Gravidanza esclusa.
Come si decide quale biologico è più adatto a quale paziente?
Essenzialmente sulla base delle seguenti sei domande: 1. Esiste l’artrite psoriasica? 2. Il paziente è obeso? 3. è più importante iniziare il trattamento rapidamente? 4. è importante la massima efficacia (ad esempio, a causa dell’eritroderma)? 5. Quanto è buona la conformità? Le interruzioni della terapia sono prevedibili?
Le “Raccomandazioni svizzere per il trattamento con biologici nella psoriasi” aiutano quindi a trovare il biologico più adatto a seconda della situazione. Nel frattempo, ustekinumab ha ricevuto l’approvazione per l’artrite psoriasica in Svizzera e l’Agenzia Europea dei Medicinali ha valutato positivamente l’uso di adalimumab nei bambini con psoriasi a partire dai quattro anni. Resta da vedere dove si posizionerà il nuovo secukinumab nelle condizioni di tutti i giorni, ma la superiorità dimostrata rispetto a etanercept e ustekinumab negli studi di fase III è quantomeno promettente.
Quanto sono efficaci i singoli biologici approvati per la psoriasi nel confronto a breve e a lungo termine (ci sono abbastanza studi testa a testa in questo settore)?
L’interpretazione dei confronti di efficacia dei farmaci biologici è complessa e ogni produttore può citare almeno uno studio che spiega perché il proprio prodotto è il migliore. Un problema è che non ci sono abbastanza studi testa a testa. Questo cambierà, tuttavia, perché i nuovi biologici e le piccole molecole devono confermare la loro ragione d’essere in questi confronti diretti. Per i biologici consolidati, la risposta PASI-75 viene spesso confrontata da studi diversi con disegni di studio differenti. La maggior parte degli studi di registrazione randomizzati e controllati sono limitati a un periodo di 12-24 settimane. In seguito, la comparabilità diventa ancora più difficile, perché si confrontano terapie combinate, differenze di dose, dati di registro non controllati ed endpoint diversi.
Come regola empirica, ritengo che nei primi quattro-sei mesi l’infliximab sia il biologico più efficace, l’etanercept (2× 50 mg/settimana) il più debole e l’adalimumab e l’ustekinumab una via di mezzo. Tuttavia, anche l’aderenza al trattamento e la perdita di efficacia, che si verifica in circa un quarto dei pazienti, sono fondamentali per l’efficacia a lungo termine. Etanercept tende a recuperare terreno in questo caso.
La sua esperienza personale: i biologici sono sicuri da usare e sono ben tollerati? Dobbiamo distinguere tra gli inibitori del TNF alfa e gli anticorpi dell’interleuchina a questo proposito?
Ritengo che la tolleranza e la sicurezza degli inibitori del TNF alfa e di ustekinumab siano complessivamente molto buone, mentre vedo alcuni punti deboli nell’efficacia in alcuni casi. Personalmente non ho sperimentato nessuno dei tanto discussi effetti collaterali potenzialmente gravi dei biologici, come infezioni gravi, fenomeni autoimmuni, “eventi cardiovascolari maggiori”, malattie demielinizzanti o tumori maligni nei nostri pazienti. Da un lato, questo ha a che fare con il fatto che selezioniamo attentamente i pazienti. Inoltre, stiamo esaurendo il sistema terapeutico convenzionale e quindi forse trattiamo meno pazienti con i biologici rispetto ad altri ospedali universitari. Il motivo principale, tuttavia, è che questi effetti collaterali gravi sono molto rari, con cinque-otto eventi ogni 100 anni-paziente, e diventano misurabili solo in popolazioni più numerose.
Come funziona effettivamente l’applicazione delle sostanze locali? A volte è necessario applicare quotidianamente fino a tre sostanze attive diverse (corticosteroidi + analoghi della vitamina D3 o acido salicilico + prodotti liporestitutivi). Il paziente è interessato solo alla cura della pelle o l’aderenza non soffre molto con queste terapie combinate?
La praticabilità e l’accettazione della terapia locale è di fondamentale importanza, altrimenti non verrà utilizzata. Raccomando la ricarica al mattino dopo la doccia, la terapia locale medicinale alla sera, almeno 30 minuti prima di dormire. Per le prime due settimane, raccomando un prodotto combinato come l’unguento/gel Daivobet® a questo scopo, alternato quotidianamente con, ad esempio, l’unguento Diprosalic® in caso di desquamazione spessa. L’uso di corticosteroidi topici due volte non è raccomandato, in quanto aumenta gli effetti collaterali. Se necessario, raccomando un’occlusione con un foglio di cellophane. Dopo queste due settimane, i corticosteroidi topici possono essere ridotti a circa 2-3×/settimana e gli analoghi della vitamina D3 possono essere utilizzati come monoterapia in questi giorni, insieme al refatting. Per le aree intertriginose, si consigliano gli inibitori della calcineurina topici 1-2×/d.
Che cos’è la cosiddetta “marcia psoriasica” e quali conseguenze ha per la terapia?
Questo si riferisce al concetto che la psoriasi, in quanto malattia infiammatoria, “va anche sotto la pelle” e non induce solo processi infiammatori a livello delle articolazioni e dei tendini. A causa delle citochine proinfiammatorie, porta anche all’insulino-resistenza, che può causare disfunzione endoteliale con aterosclerosi e, infine, eventi cardiovascolari. Ci sono prove crescenti che la psoriasi può essere un fattore di rischio cardiovascolare indipendente. Tuttavia, la prova del concetto è ancora in sospeso ed è resa più difficile dal fatto che molti pazienti affetti da psoriasi presentano anche gli altri classici fattori di rischio cardiovascolare. L’obesità di per sé può anche portare a un aumento delle citochine proinfiammatorie.
Quindi la “marcia psoriasica” è ancora un po’ ipotetica, ma per me è un indicatore del buon controllo dei fattori di rischio cardiovascolare nei pazienti affetti da psoriasi, perché hanno mostrato un aumento della morbilità e della mortalità cardiovascolare in alcuni grandi studi epidemiologici. Tuttavia, ci sono stati anche studi con risultati contrari, quindi la situazione dei dati è ancora controversa.
Intervista: Andreas Grossmann
PRATICA DERMATOLOGICA 2015; 25(3): 10-13