L’Ufficio federale della sanità pubblica (UFSP) e la Commissione federale per le questioni vaccinali (ECIF) raccomandano la vaccinazione contro l’herpes zoster con il nuovo vaccino ricombinante inattivato, composto dai due componenti attivi glicoproteina E (subinit del virus) e AS01B (adiuvante), per le persone sane di età pari o superiore a 65 anni e per i pazienti con immunodeficienza di età pari o superiore a 50 anni o immunodeficienza grave di età pari o superiore a 18 anni. Ora è approvato per l’uso da parte delle compagnie di assicurazione sanitaria ed è disponibile in Svizzera.
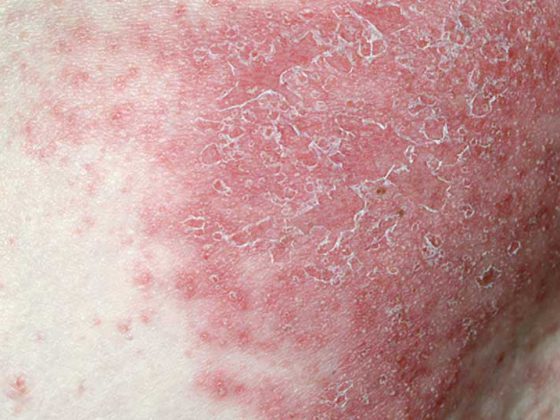
Con l’avanzare dell’età, il numero e la funzionalità delle cellule immunitarie che impediscono la riattivazione del virus della varicella-zoster (VZV) diminuiscono [2,6,7,9,10]. Ciò comporta un aumento dell’incidenza e della gravità dell’herpes zoster. Ogni anno in Svizzera si registrano tra i 17.000 e i 30.000 casi di herpes zoster [2]. Circa il 99% degli adulti di età pari o superiore a 50 anni sono infettati dal virus che causa l’herpes zoster, e in una persona su tre il VZV latente si riattiva e causa l’herpes zoster [2,3]. Alcune condizioni preesistenti, come l’artrite reumatoide, la malattia infiammatoria cronica intestinale, il diabete, la BPCO, l’asma, il lupus eritematoso sistemico o la depressione, comportano un aumento del rischio di herpes zoster. Il rischio di herpes zoster è più elevato nelle malattie che comportano una grave immunodeficienza, come il linfoma o il mieloma, e il rischio è addirittura 13 volte superiore durante la chemioterapia [2,5,6,11,12].
L’herpes zoster e le complicanze potenzialmente gravi
L’herpes zoster è una malattia dolorosa che può essere associata a complicazioni gravi e di lunga durata, che includono la nevralgia post-erpetica (PHN) e lo zoster oftalmico [2]. La PHN colpisce fino al 30% dei pazienti affetti da herpes zoster ed è caratterizzata da dolore ai nervi, che a volte dura per anni [2,4]. Lo zoster oftalmico colpisce circa il 20% dei pazienti con zoster. Questo può portare a complicazioni oftalmologiche e, in rari casi, alla cecità [2,13]. Il tasso di recidiva dell’herpes zoster dopo otto anni è stimato al 6,2% secondo Yawn et al. Le recidive erano più frequenti nei soggetti con dolore che durava >30 d e nei soggetti immunosoppressi. A causa dei tassi di recidiva relativamente elevati, la vaccinazione dovrebbe essere offerta anche ai pazienti che hanno già sofferto di herpes zoster [14].
Prevenzione attraverso il nuovo vaccino ricombinante inattivato
SHINGRIX® è il primo e unico vaccino contro l’herpes zoster che induce una risposta immunitaria forte e sostenuta grazie alla combinazione di un antigene ricombinante e di un sistema adiuvante [1,15–19]. L’antigene (glicoproteina E [gE]) scatena una risposta immunitaria specifica contro il VZV. La gE è espressa sulla superficie delle cellule infettate dal VZV ed è fondamentale per la replicazione del virus. Il sistema adiuvante (AS01B) provoca un potenziamento della risposta immunitaria all’antigene del vaccino. Induce una risposta immunitaria antigE forte e sostenuta. La combinazione unica di MPL e QS-21 potenzia le risposte immunitarie sia umorali che cellulari contro la gE* [1,17–22]. Questa proprietà la rende adatta anche ai pazienti immunodeficienti o immunosoppressi [1].
* VZV = Varicella-Zoster-Virus; MPL: 3-O-desacil-4′-monofosforil lipide A di Salmonella minnesota; QS-21: frazione di saponina QS-21 dell’albero della corteccia di sapone.
Profilo di efficacia e sicurezza
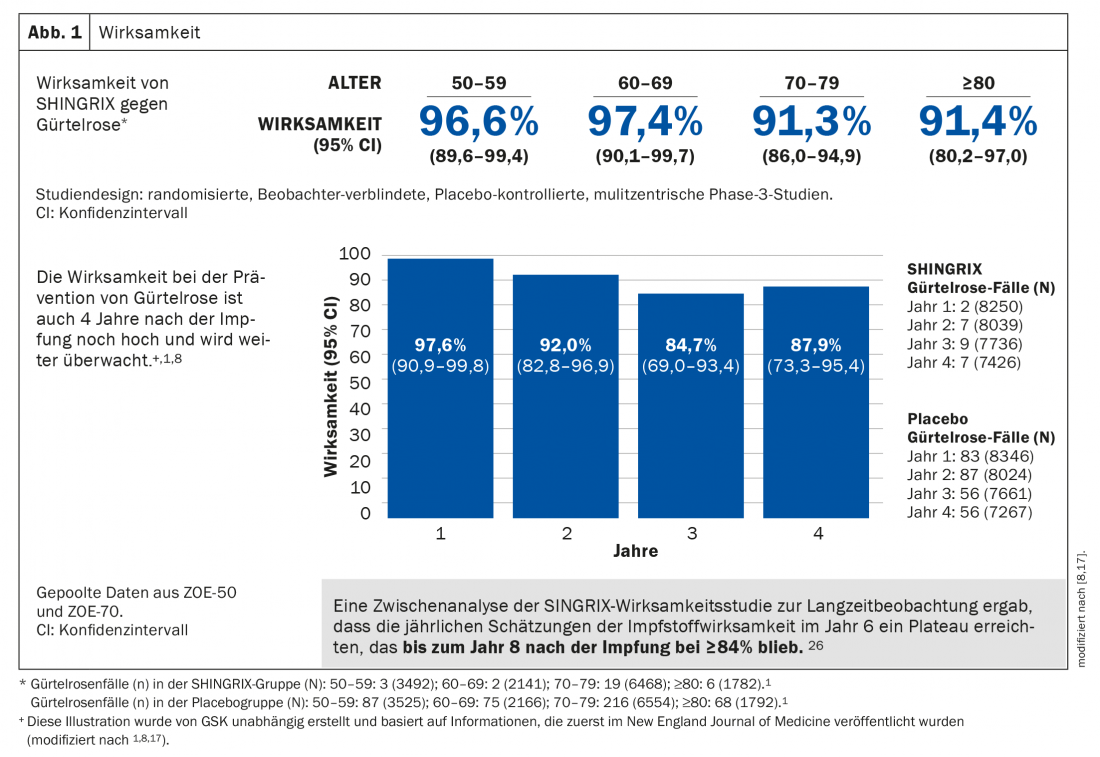
Il vaccino a subunità adiuvato ha dimostrato un’efficacia superiore al 90% nella prevenzione dell’herpes zoster in tutte le fasce d’età dai 50 anni in su, rimanendo ad un livello molto alto anche dopo più di sette anni. Allo stesso modo, il rischio di sviluppare la PHN è significativamente ridotto (Fig. 1) [1]. La sicurezza è stata studiata in modo approfondito in due studi clinici di fase 3 su larga scala. La maggior parte degli eventi avversi è stata di gravità lieve o moderata e ha incluso dolore, arrossamento e gonfiore nel sito di iniezione. I pazienti possono anche soffrire di dolori muscolari, affaticamento, mal di testa, brividi, febbre o disturbi allo stomaco. Negli studi clinici, questi effetti avversi sono durati una mediana di 2 o 3 giorni [1,8,17].
Raccomandazione di vaccinazione BAG e EKIF
La vaccinazione contro l’herpes zoster con due dosi e un intervallo minimo di 1-2 mesi viene fornita in due categorie di raccomandazioni [25]: A Raccomandazione di vaccinazione supplementare: la vaccinazione è raccomandata a tutte le persone immunocompetenti di età ≥65 anni, indipendentemente dalla loro storia individuale di varicella e herpes zoster. Si consigliano due dosi con un intervallo minimo di due mesi.
B Raccomandazione di vaccinazione per due gruppi di rischio definiti:
B1: La vaccinazione è raccomandata a tutti i pazienti di età ≥50 anni con immunodeficienza attuale o futura (soprattutto cellulare) associata a un aumento del rischio di herpes zoster. Si consigliano due dosi con un intervallo minimo di due mesi.
B2: La vaccinazione è raccomandata per i pazienti di età ≥18 anni che sono attualmente affetti da immunodeficienza grave o che stanno ricevendo un trattamento immunosoppressivo o che lo riceveranno nel prossimo futuro. La prima dose dovrebbe idealmente essere somministrata ≥4 settimane prima di un’insorgenza presunta, prevista o programmata di immunosoppressione grave. La seconda dose con un intervallo minimo di uno o due mesi dopo la prima dose o il prima possibile in un momento successivo favorevole dal punto di vista medico durante o dopo la terapia.
SHINGRIX® è destinato esclusivamente all’iniezione intramuscolare e solo per uso profilattico e non per il trattamento di una malattia clinica confermata. Il vaccino può essere somministrato contemporaneamente a un vaccino antinfluenzale stagionale non adiuvato, a un vaccino polisaccaridico 23-valente (PPV23) o a un vaccino contro la pertosse acellulare difterica-tetanica a ridotto contenuto di antigene (dTpa) (sito di iniezione diverso). La risposta immunitaria (2 dosi) non è stata influenzata dalla precedente vaccinazione con un vaccino HZ vivo attenuato [1]. Non è richiesto un intervallo minimo tra la vaccinazione con COVID mRNA e la somministrazione di altri vaccini, come per tutti gli altri vaccini non vivi [24].
Fonte: GlaxoSmithKline AG
Letteratura:
- Foglietto illustrativo di Shingrix. www.swissmedicinfo.ch, consultato nell’ottobre 2021.
- Commissione federale per le questioni di immunizzazione (EKIF). Valutazione della vaccinazione contro l’herpes zoster secondo i criteri di analisi per le raccomandazioni nazionali di vaccinazione in Svizzera. 14 dicembre 2015; 1-34.
- Hillebrand K, Bricout H, Schulze-Rath R, et al: Incidenza dell’herpes zoster e delle sue complicanze in Germania 2005-2009. Journal of Infection 2015 Feb; Vol 70: 178-186.
- Kawai K, Gebremeskel BG, Acosta CJ: Revisione sistematica dell’incidenza e delle complicanze dell’herpes zoster: verso una prospettiva globale. BMJ Open 2014 Jun;4(6): e004833.
- Mahalingam R, Wellish M, Wolf W, et al.: DNA virale latente della varicella-zoster nei gangli trigeminali e toracici umani. N Engl J Med 1990 Sep; 323(10): 627-631.
- Weinberg A, Lazar AA, Zerbe GO, et al: Influenza dell’età e della natura dell’infezione primaria sulle risposte immunitarie cellulo-mediate specifiche del virus della varicella-zoster. J Infect Dis. 2010; 201(7): 1024-1030.
- Kimberlin DW, Whitley RJ: Vaccino Varicella-zoster per la prevenzione dell’herpes zoster. N Engl J Med. 2007 Mar; 356(13): 1338-1343.
- Cunningham AL, Lal H, Kovac M, et al: Efficacia del vaccino a subunità dell’herpes zoster negli adulti di 70 anni o più. N Engl J Med 2016 Sep; 375(11): 1019-1032.
- Levin MJ: Senescenza immunitaria e vaccini per prevenire l’herpes zoster nelle persone anziane. Curr Opin Immunol 2012 Aug; 24(4): 494-500.
- Patterson-Bartlett J, Levin MJ, Lang N, et al: Caratterizzazione fenotipica e funzionale delle risposte delle cellule T ex vivo al vaccino vivo attenuato dell’herpes zoster. Vaccino 2007 ottobre; 25(41): 7087-7093.
- Lungu O, Annunziato PW, Gershon A, et al: Virus della varicella-zoster riattivato e latente nei gangli spinali umani. Proc Natl Acad Sci USA 1995 Nov; 92(24): 10980-10984.
- Furuta Y, Takasu T, Fukuda S, et al.: Rilevamento del DNA del virus varicella-zoster nei gangli genicolati umani mediante reazione a catena della polimerasi. J Infect Dis 1992 Nov; 166(5): 1157-1159.
- Volpi A: Gravi complicazioni dell’herpes zoster. Herpes 2007 Sep; 14 Suppl 2: 35-39.
- Yawn BP, Wollan P, Kurland MJ, et al: Le recidive di Herpes Zoster sono più frequenti di quanto riportato in precedenza. Mayo Clin Proc. febbraio 2011; 86(2): 88-93.
- Chlibek R, Smetana J, Pauksens K, et al: Sicurezza e immunogenicità di tre diverse formulazioni di un candidato vaccino a subunità del virus varicella-zoster adiuvato negli adulti anziani: uno studio di fase II, randomizzato e controllato. Vaccino 2014 Mar; 32(15): 1745-1753.
- Bharucha T, Ming D, Breuer J: Una valutazione critica di ‘Shingrix’, un nuovo vaccino a subunità herpes zoster (HZ/Su o GSK1437173A) per il virus della varicella zoster. Hum Vaccin Immunother. 2017 Aug;13(8): 1789-1797.
- Lal H, Cunningham AL, Godeaux O, et al: Efficacia di un vaccino adiuvato con subunità di herpes zoster negli adulti anziani. N Engl J Med 2015 maggio; 372(22): 2087-2096.
- Schwarz TF, Volpe S, Catteau G, et al: Persistenza della risposta immunitaria a un vaccino a subunità del virus della varicella-zoster adiuvato fino al nono anno negli adulti anziani. Hum Vaccin Immunother 2018 Jun; 14(6): 1370-1377.
- Merck Sharp & Dohme. Relazione di valutazione pubblica europea di Zostavax, Allegato I: Riassunto delle caratteristiche del prodotto: EMA; [aggiornato a gennaio 2019; accesso a dicembre 2020]. Disponibile su: www.ema.europa.eu/en/documents/product-information/zostavaxepar-product-information_en.pdf.
- Lecrenier N, Beukelaers P, Colindres R, et al.: Sviluppo del vaccino ricombinante adiuvato contro lo zoster e sue implicazioni per la prevenzione dell’herpes zoster. Expert Review of Vaccines 2018; 17(7): 619-634.
- Dendouga N, Fochesato M, Lockman L, et al.: Risposte immunitarie cellulo-mediate a un vaccino con glicoproteina E del virus della varicella-zoster, utilizzando un agonista TLR e QS21 nei topi. Vaccino 2012 Apr;30(20): 3126-3135.
- Leroux-Roels G, Marchant A, Levy J, et al: Impatto degli adiuvanti sulle risposte delle cellule T CD4(+) e delle cellule B a un vaccino antigenico proteico: risultati di uno studio di fase II, randomizzato e multicentrico. Clin Immunol 2016 Aug; 169: 16-27.
- US Food and Drug Administration; Comitato consultivo per i vaccini e i prodotti biologici correlati. Documento informativo: Shingrix (vaccino Zoster ricombinante, adiuvato). 2017 [accessed December 2020]. Disponibile su: www.fda.gov/media/107553/download.
- BAG: Raccomandazione di vaccinazione per i vaccini mRNA contro Covid-19 (al 14.09.2021), consultato su%20gegen%nel mese di settembre. 2021.
- UFSP: Nuove raccomandazioni per la vaccinazione contro l’herpes zoster: vaccino SHINGRIX. Bollettino BAG 47/2021;22: 9-15.
- Boutry C, et al.: Il vaccino zoster ricombinante adiuvato conferisce una protezione a lungo termine contro l’herpes zoster: risultati intermedi di uno studio di estensione degli studi clinici pivotali di fase III (ZOE-50 e ZOE-70). Clin Inf Dis 2021: 1-30.
PRATICA GP 2022; 17(3): 32-33