L’obbligo di manutenzione dei dispositivi medici spetta a chi li utilizza e a terzi. Le violazioni dell’obbligo di manutenzione sono sanzionate da Swissmedic come reato. La pubblicità del medico deve essere obiettiva, soddisfare un’esigenza pubblica e non deve essere fuorviante o invadente. Le informazioni che servono principalmente a un fine in sé sono inammissibili.
Le seguenti domande sull’interfaccia tra medicina e diritto sono dedicate a tre aspetti frequenti: L’obbligo di manutenzione e i difetti dei dispositivi medici, le questioni relative all’ammissibilità della pubblicità per i medici e i medicinali o i trattamenti, e le questioni relative all’assunzione dei costi dei medicinali e dei trattamenti da parte delle casse malattia.
Chi è responsabile della manutenzione?
Secondo l’Art. 4 comma 1 lit. b HMG, i dispositivi medici sono “…prodotti, compresi strumenti, apparecchi, dispositivi medico-diagnostici in vitro, software e altri articoli o sostanze che sono destinati o pubblicizzati per uso medico e il cui effetto principale non è ottenuto da un medicinale”.
L’obbligo di manutenzione dei dispositivi medici spetta alla persona che utilizza il dispositivo medico e a terzi [1]. La manutenzione deve essere eseguita secondo le istruzioni del distributore iniziale. È consigliabile registrare i dispositivi medici in un registro che riporti la chiara identificazione dei dispositivi, il tipo e la frequenza della manutenzione e le persone e gli enti responsabili della manutenzione. Oltre a questo registro, è utile tenere un cosiddetto giornale dell’apparecchiatura, in cui vengono elencate le misure di manutenzione pianificate, i difetti o i malfunzionamenti, le misure adottate e il risultato della manutenzione [2].
Solo in questo modo è possibile fornire in seguito la prova completa che l’obbligo di mantenimento è stato adempiuto in conformità alla legge. Le violazioni dell’obbligo di manutenzione sono sanzionate da Swissmedic come reato [3].
Uno studio ha bisogno di un responsabile della sicurezza laser?
Se in uno studio vengono eseguiti trattamenti con laser di classe 3B o 4, la direzione deve nominare un responsabile della sicurezza laser. L’addetto ai laser deve redigere un concetto di sicurezza e informare tutte le persone che lavorano con i laser delle classi corrispondenti sui pericoli e sulla corretta gestione dei dispositivi [4]. A scopo probatorio, è consigliabile redigere delle specifiche per il responsabile della sicurezza laser e documentare il concetto di sicurezza [5].
Cosa si deve fare in caso di un dispositivo medico difettoso?
L’acquirente ha l’obbligo di ispezionare il prodotto al momento dell’accettazione e di denunciare immediatamente alla parte contraente eventuali difetti esistenti. Un avviso di difetto deve contenere quanto segue: una descrizione del difetto, il più possibile circostanziata, e l’affermazione che l’articolo è riconosciuto come non conforme al contratto a causa del difetto e che la controparte ne è responsabile [6]. È consigliabile inviare un avviso di difetti alla parte contraente tramite raccomandata a scopo probatorio e conservare una copia della lettera e la prova di consegna da parte dell’ufficio postale. La tracciabilità della spedizione è accessibile sul sito web della Posta solo per un certo periodo di tempo. Dopodiché, i dati vengono cancellati. Pertanto, ha senso archiviare anche il tracciamento elettronico della spedizione in forma stampata o elettronica come PDF dopo la consegna. L’onere della prova della tempestività e dell’esistenza dei difetti al momento della conclusione del contratto spetta all’acquirente. Anche i difetti che possono essere rilevati solo in un momento successivo (i cosiddetti difetti nascosti) devono essere contestati immediatamente dopo la scoperta con un avviso di difetto. In ogni caso, la notifica dei difetti deve essere effettuata immediatamente. Secondo la giurisprudenza, questo significa solitamente un reclamo entro due o tre giorni o, a seconda del difetto, entro sette giorni dall’ispezione dell’articolo o dalla scoperta del difetto [7]. Senza un reclamo immediato, tutti i diritti dell’acquirente in relazione ai difetti decadono [8].
Cosa si intende per pubblicità illecita e quali sono le conseguenze?
La MedBG stabilisce che la pubblicità dei medici deve essere obiettiva, rispondere a un’esigenza pubblica e non essere né fuorviante né invasiva [9].
Se una pubblicità medica non soddisfa questi criteri, si tratta di una violazione dei doveri professionali, che viene sanzionata con un rimprovero, un avvertimento o una multa fino a 20.000 franchi svizzeri o addirittura con l’interdizione dall’esercizio della professione da parte dell’autorità di vigilanza cantonale [10]. Il Codice di Condotta Professionale può essere consultato per l’interpretazione dei doveri professionali [11]. Tuttavia, una violazione del Codice di condotta professionale della FMH non comporta necessariamente conseguenze disciplinari ai sensi della Legge sulla professione medica. Questo perché il Codice di Condotta Professionale costituisce il diritto associativo, il che significa che può essere applicato solo ai membri dell’associazione – a differenza dei doveri professionali, che costituiscono il diritto pubblico e devono essere rispettati da tutti gli esercenti della professione. Il Codice di condotta professionale prevede sanzioni come il rimprovero, una multa fino a 50.000 franchi svizzeri, la sospensione dell’affiliazione per un certo periodo di tempo, l’espulsione dalla società/FMH, la pubblicazione negli organi di pubblicazione delle società mediche cantonali, della VSAO, della VLSS o della FMH, la notifica alla direzione sanitaria competente o agli organi di assicurazione sanitaria appropriati e la nomina di un supervisore. Le singole sanzioni possono anche essere collegate o combinate tra loro [12].
Il Codice di condotta professionale della FMH definisce le informazioni consentite come segue: Le donne medico possono “[…] divulgare le loro qualifiche professionali e tutte le altre informazioni necessarie per il paziente e per il paziente o per il collega in maniera contenuta e non invadente”. [13] e dovranno ” […] astenersi, nell’ambito della loro attività medica, da qualsiasi pubblicità non obiettiva, basata su affermazioni non veritiere o lesiva della reputazione della professione medica […] “. [14] e per garantire “[…] che una terza parte non si impegni in una pubblicità illegale a suo vantaggio diretto o indiretto”. [15].
L’informazione è considerata necessaria se la sua conoscenza facilita al paziente la scelta del medico adatto [16]. Le linee guida “Informazioni e pubblicità” ( Tab. 1) menzionano esplicitamente diverse informazioni considerate necessarie.

Le informazioni che, ad esempio, servono all’autopromozione del medico e hanno principalmente uno scopo pubblicitario sono inammissibili [17]. La pubblicazione di informazioni sotto forma di invii di massa, come quelli postali o elettronici, alla popolazione non è consentita [18]. Dal punto di vista dell’etica professionale, sarebbe probabilmente problematico se un medico rendesse note al pubblico informazioni generali sul suo studio attraverso un account Twitter pubblico [19]. In base al Codice di Condotta Professionale, potrebbe anche non essere consentito offrire trattamenti su piattaforme di shopping digitale.
Inoltre, secondo la Legge sui Prodotti Terapeutici, la pubblicità al pubblico per i farmaci con obbligo di prescrizione non è consentita [20]. Anche le relazioni che pubblicizzano una malattia e l’indicazione di un medicinale – senza menzionarne il nome – possono essere qualificate come pubblicità inammissibile al pubblico se il quadro clinico è indissolubilmente legato al rimedio, in modo che un termine suggerisca inevitabilmente l’altro [21]. Il criterio decisivo è l’impressione generale di come il pubblico si rivolge in modo oggettivo [22]. La pubblicità non autorizzata di medicinali è sanzionata da Swissmedic come un’infrazione [23].
Qual è la pubblicità consentita per i trattamenti con la tossina botulinica?
Le norme sulla pubblicità della tossina botulinica sono severe. Ad esempio, un sito web che pubblicizzava i possibili usi ed effetti della tossina botulinica e rimandava a testi di stampa e pubblicità è stato qualificato come pubblicità inammissibile al pubblico. L’operatore del sito web è stato accusato di aver promosso la tossina botulinica come un affascinante principio attivo e l’uso off-label come metodo “moderno e particolarmente efficace”, oltre al fatto che gli effetti collaterali non corrispondevano alle informazioni sul farmaco corrispondente e quindi il principio attivo veniva minimizzato per convincere i clienti a sottoporsi a trattamenti contro le rughe con prodotti contenenti il principio attivo della tossina botulinica [24]. Swissmedic dichiara ammissibili “solo le informazioni di carattere generale sulla salute o sulle malattie” [25]. È importante che le informazioni non si riferiscano direttamente o indirettamente a un medicinale specifico. La denominazione del principio attivo “Tossina botulinica” può essere utilizzata come titolo di una rubrica o nella spiegazione del termine “trattamento Botox” all’interno di un testo continuo [25]. In nessun caso, tuttavia, sono consentite campagne pubblicitarie speciali per i trattamenti con la tossina botulinica, che hanno un effetto sul prezzo dei trattamenti [26].
Quali farmaci sono coperti dall’assicurazione sanitaria?
Quali farmaci sono coperti dall’assicurazione di base è esplicitamente regolamentato dalla legge. L’Ufficio federale della sanità pubblica redige l’elenco delle specialità, che elenca i prodotti e i relativi costi che sono coperti dall’assicurazione sanitaria di base. Si tratta di un elenco esaustivo, vale a dire che se un prodotto non è presente nell’elenco, l’assicurazione di base rifiuterà di coprire i costi. Tuttavia, non è esclusa l’assunzione dei costi da parte di un’assicurazione complementare conclusa. La copertura dei costi dipende dalla rispettiva assicurazione complementare.
L’elenco attuale delle specialità è disponibile online su www.spezialitätenliste.ch. La funzione di ricerca include i nomi dei preparati, i titolari delle autorizzazioni all’immissione in commercio o i principi attivi.
Quali trattamenti sono coperti dall’assicurazione sanitaria?
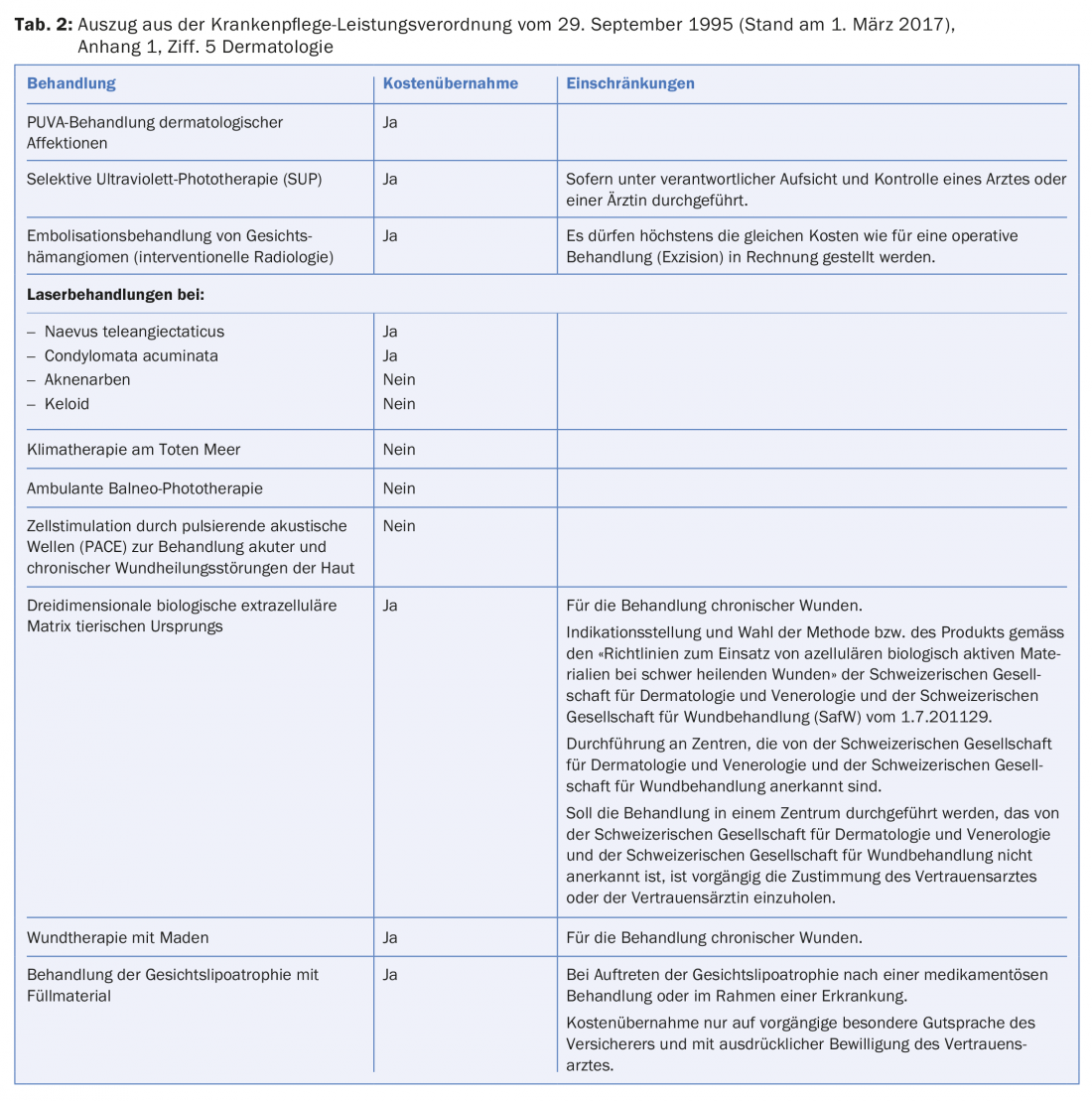
Non esiste un elenco esaustivo di servizi medici. Tuttavia, in linea di principio, la cassa malattia deve coprire una prestazione dermatologica perché si presume che soddisfi i criteri di efficacia, convenienza ed efficienza economica. Questi criteri sono un prerequisito per l’assunzione dei costi da parte dell’assicurazione di base [27]. La cassa malattia può rifiutare la prestazione dimostrando che questi criteri non sono soddisfatti. Tuttavia, l’Allegato 1 dell’Ordinanza sui servizi sanitari contiene un elenco di trattamenti, che è un elenco vincolante non esaustivo di servizi obbligatori o non medici. Ad esempio, il trattamento PUVA delle affezioni dermatologiche è coperto dall’assicurazione sanitaria, mentre la balneo-fototerapia ambulatoriale non lo è (Tab. 2) [28].
Messaggi da portare a casa
- L’obbligo di manutenzione dei dispositivi medici spetta a chi li utilizza e a terzi.
- Le violazioni dell’obbligo di manutenzione sono sanzionate da Swissmedic come reato.
- Gli studi che eseguono trattamenti laser di classe 3B o 4 devono nominare un responsabile della sicurezza laser.
- La pubblicità del medico deve essere obiettiva, soddisfare un’esigenza pubblica e non deve essere fuorviante o invadente. Le informazioni che servono principalmente a un fine in sé sono inammissibili.
- È necessaria una moderazione nelle misure di informazione e pubblicità per il trattamento con la tossina botulinica.
- L’Ordinanza sulle prestazioni sanitarie contiene una chiara regolamentazione sull’assunzione dei costi per determinati trattamenti dermatologici.
Fonti:
- Art. 49, paragrafo 1. 1 HMG; Art. 20 MepV; Scheda informativa dell’Istituto svizzero per gli agenti terapeutici, Dispositivi medici: Manutenzione, ritrattamento, modifica da parte di specialisti, giugno 2005, pag. 1.
- Cfr. l’intero foglio informativo dell’Istituto svizzero per gli agenti terapeutici, Dispositivi medici: Manutenzione, ritrattamento, modifica da parte di specialisti, giugno 2005, pag. 2 e segg.
- Cfr. l’art. 86, paragrafo 1, lettera a). 1 lit. f HMG.
- Linea guida EKAS n. 6508, Linea guida ASA del 14 dicembre 2006 (in vigore dal 1° gennaio 217), n. 2 in combinato disposto con l’Allegato 1. Appendice 1; SUVA, Attenzione, raggio laser!, pag. 12; cfr. anche la norma di sicurezza laser EN 60825-1.
- Cfr. SUVA, Attenzione, raggio laser!, pag. 12.
- Cfr. 101 II 84 f. E. 3; 107 II 175 E. a.
- Cfr. ad esempio la sentenza del Tribunale federale 4C.82/2004; la sentenza del Tribunale federale 4D_25/2010.
- Cfr. nel complesso gli articoli 197 e seguenti.
- Art. 40 lit. d MedBG.
- Art. 43, paragrafo 1, lettera a). 1 MedBG.
- Messaggio sulla Legge federale sulle professioni mediche universitarie (LAMed) del 3 dicembre 2004, pag. 228.
- Art. 43 StaO FMH.
- Art. 20, comma 1, lettera a). 1 StaO FMH.
- Art. 20, comma 1, lettera a). 2 StaO FMH.
- Art. 20, comma 1, lettera a). 3 StaO FMH.
- Cifra. 1.1. L’Appendice 2 del Codice di condotta professionale FMH (“StaO FMH”) contiene le linee guida “Informazioni e pubblicità”.
- Cifra. 2.3. Allegato 2 dello StaO FMH.
- Cifra. 3.2. Allegato 2 dello StaO FMH.
- Keller Claudia, Capitolo 4: Diritto della pubblicità, in: Social Media und Recht für Unternehmen, paragrafo. 4.26.
- Art. 32, paragrafo 1, lettera a). 2 litri. un HMG.
- Sentenza del Tribunale amministrativo federale C-546/2010; DTF 129 V 32.
- Sentenza BVerwG C-546/2010; sentenza BGer 2A.63/2006.
- Art. 87, paragrafo 1, lettera a). 1 lit. b HMG.
- Cfr. sentenza del BVerwG C-546/2010.
- Swissmedic, AW-Merkblatt, Tossina botulinica – Linee guida, Botox: informazione contro pubblicità, pag. 1.
- Cfr. Swissmedic, Scheda informativa AW, Tossina botulinica – Linee guida, Botox: informazione contro pubblicità, pag. 3.
- BGE 129 V 167, E. 3.2; BGE 125 V 28 E. 5b.
- Cfr. 5 Dermatologia, Allegato 1 del KLV.
PRATICA DERMATOLOGICA 2017; 27(3): 25-28