Il lavoro di squadra tra medico di famiglia, nefrologo, centro trapianti e paziente è essenziale. Il 50% dei pazienti trapiantati muore con un trapianto di rene funzionante. Nella fase iniziale dopo il trapianto, l’attenzione si concentra sulla regolazione dell’immunosoppressione e sulla registrazione del rigetto e delle infezioni in particolare. Il trattamento delle complicanze non immunologiche, soprattutto dei fattori di rischio cardiovascolare, è estremamente importante. È necessario effettuare controlli regolari dei tumori, soprattutto della pelle. Tenga sempre presente le interazioni farmacologiche, soprattutto con gli immunosoppressori.
Il trapianto di rene è la procedura di sostituzione renale preferita dalla maggior parte dei pazienti con insufficienza renale cronica ed è associato alla migliore qualità e aspettativa di vita per il paziente. La sopravvivenza a 5 anni del trapianto di rene è attualmente superiore al 70% per gli organi provenienti da donatori deceduti e addirittura superiore all’80% per le donazioni da vivente [1].
Oggi, circa il 50% dei riceventi di trapianto con innesti funzionanti muore a causa di complicazioni cardiovascolari, seguite da tumori e infezioni gravi. Pertanto, il monitoraggio regolare e il trattamento delle comorbidità giocano un ruolo fondamentale. L’esito a lungo termine di un trapianto dipende in gran parte dalla qualità e dalla regolarità dell’assistenza di follow-up. In questo caso, è fondamentale una buona collaborazione tra il medico di famiglia e il centro trapianti.
Fase iniziale dopo il trapianto
La fase iniziale del monitoraggio (primo anno post-operatorio) è prevalentemente effettuata direttamente nel centro trapianti, con intervalli di tempo per il controllo che si estendono fino a tre mesi dopo la fase iniziale. Dopo il primo anno, il nefrologo vicino al domicilio del paziente assume la parte principale dell’assistenza regolare in collaborazione con il medico di famiglia, integrata da controlli annuali presso il centro trapianti.
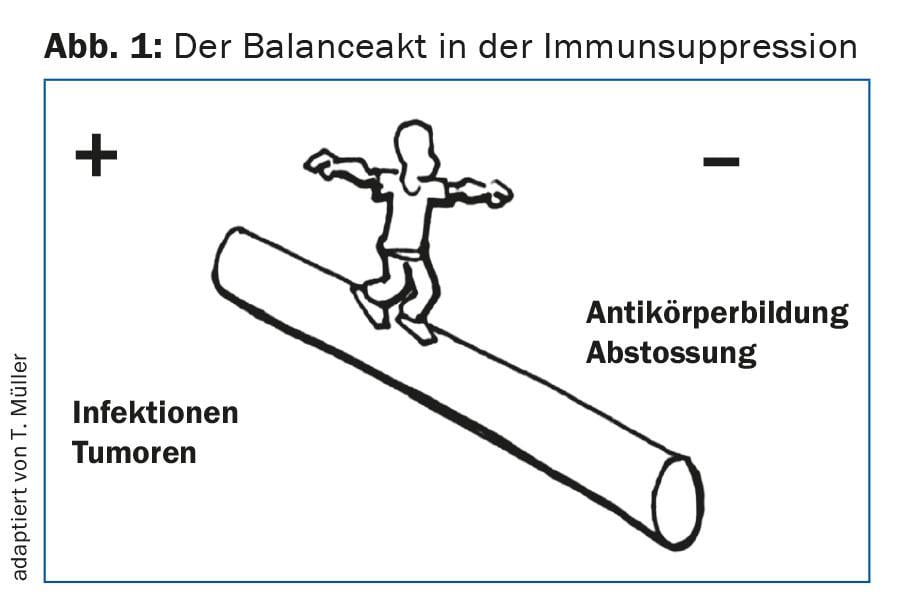
Il monitoraggio iniziale a distanza ravvicinata è necessario per individuare precocemente le complicanze immunologiche acute, come le reazioni di rigetto acuto. Per evitare questo, cioè per evitare la sotto- o la sovra-immunosoppressione, è necessaria un’impostazione molto individuale dell’immunosoppressione (Fig. 1) . Inoltre, è importante riconoscere le infezioni, soprattutto quelle virali, nella fase iniziale. Queste includono, in particolare, la riattivazione del CMV o le prime infezioni da CMV, che possono avere conseguenze gravi se non trattate [2]. Inoltre, è necessario un attento monitoraggio della possibile replicazione del BKV (polyomavirus), in quanto una viremia BKV significativa può portare alla nefropatia BK che, se non trattata, può portare a una rapida perdita della funzione del trapianto.
Controlli nel corso a lungo termine
Nel decorso a lungo termine, si attribuisce maggiore importanza alla registrazione delle complicanze non immunologiche, tra cui il controllo e la regolazione della pressione arteriosa, nonché i possibili disturbi lipometabolici e del metabolismo osseo.
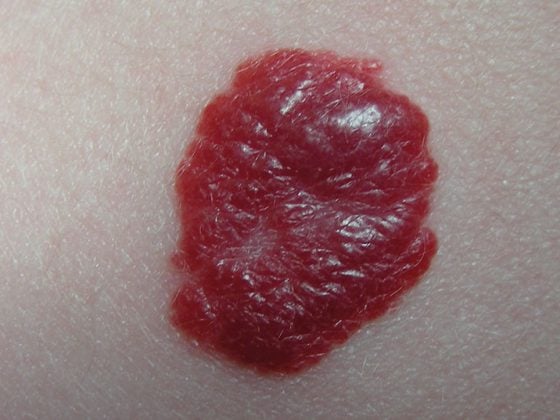
Grazie al miglioramento della sopravvivenza a lungo termine dei pazienti sottoposti a trapianto di rene, ora ci troviamo di fronte alle conseguenze della terapia immunosoppressiva a lungo termine. In questo caso, va menzionato soprattutto l’aumento del rischio di tumori cutanei maligni. Il tumore cutaneo non melanoma (NMSC) rappresenta la percentuale più alta di tutti i tumori maligni post-trapianto, pari al 40%. Nel caso di NMSC, il 90-95% sono carcinomi a cellule squamose e basali. Il rischio di un tale carcinoma è significativamente più alto nei pazienti immunosoppressi rispetto alla popolazione generale [3], e il rischio generale di tumore è circa. è aumentato da due a tre volte [4]. Per questo motivo, è fondamentale un attento monitoraggio della pelle e può essere necessaria una modifica della terapia immunosoppressiva se si verifica una NMSC.
Un fattore importante nella fase tardiva dell’assistenza è il problema delle alterazioni croniche dell’innesto, che quasi sempre si verificano per motivi ancora poco chiari e abbreviano la vita funzionale dell’innesto. L’andamento della creatinina e della proteinuria è fondamentale nella diagnostica funzionale. Un aumento della creatinina superiore al 15% richiede un chiarimento. Per l’escrezione di proteine, la determinazione del quoziente proteina-creatinina o albumina-creatinina nell’urina spontanea è di solito sufficiente. Anche in questo caso, l’andamento nel tempo e l’aumento dell’escrezione di proteine sono determinanti. I cambiamenti significativi devono essere discussi con il centro trapianti. Se necessario, si dovrà poi decidere se effettuare ulteriori esami, come lo screening degli anticorpi contro il trapianto o una biopsia renale.
Nella fase a lungo termine, è importante che in caso di malattia, deterioramento della funzione renale, febbre, dolore o intolleranza ai farmaci, si prenda contatto con il Centro trapianti più volte, anche al di fuori degli appuntamenti concordati, poiché in queste situazioni è spesso necessario un rapido chiarimento, nel contesto del quale potrebbe anche essere necessario un trattamento ospedaliero.
Anche le auto-misurazioni del paziente sono una parte molto importante del monitoraggio standard. Questo include la misurazione della pressione sanguigna, del polso, della temperatura e del peso corporeo, prima quotidianamente e poi a intermittenza. In particolare, un aumento della temperatura corporea (di solito un aumento di oltre 0,5°C rispetto all’intervallo di normalità individuale) e/o un aumento di peso significativo da un giorno all’altro, superiore a 1 kg, sono segnali di allarme che i pazienti devono segnalare.
Farmaci immunosoppressivi
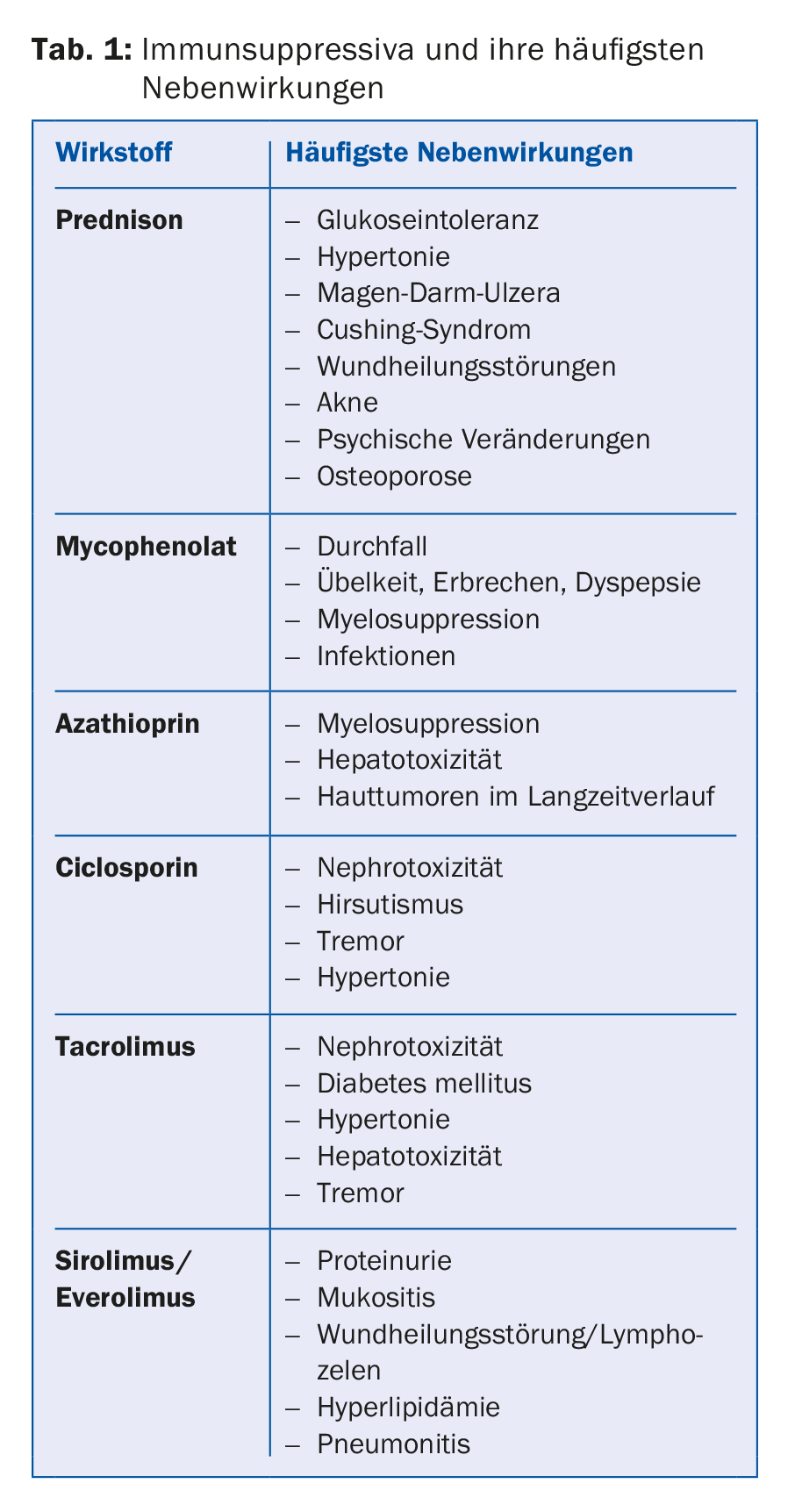
Con un trapianto, il paziente non è guarito, ma deve assumere regolarmente farmaci per tutta la vita. Le questioni relative agli effetti collaterali e alle interazioni devono quindi essere sempre discusse con il centro trapianti. Lo standard è la doppia terapia per i pazienti a basso rischio immunologico o la tripla terapia per i pazienti a rischio più elevato. Il trattamento immunosoppressivo consiste solitamente in un inibitore della calcineurina, di solito il tacrolimus (Prograf® o Advagraf®, quest’ultimo nella forma a rilascio prolungato del tacrolimus), in alcuni casi in alternativa alla ciclosporina (Sandimmun Neoral®). Inoltre, viene utilizzata una sostanza antiproliferativa, nella maggior parte dei casi il micofenolato (CellCept® o Myfortic®), più raramente l’azatioprina (Imurek®). Nella fase iniziale post-operatoria, di solito si aggiunge un glucocorticoide come terzo immunosoppressore, che viene eliminato gradualmente dopo circa sei mesi, a seconda del rischio immunologico e delle linee guida del centro (tab. 1).
L’aggiustamento della dose, soprattutto degli inibitori della calcineurina, avviene sulla base del cosiddetto livello di valle, la determinazione della concentrazione del principio attivo nel sangue dodici ore dopo l’assunzione dell’ultima dose. Si punta a livelli target individuali, adattati alla clinica (situazione immunologica, infezioni o complicazioni tumorali).
Per gli immunosoppressori, si devono utilizzare i preparati raccomandati dal centro trapianti. Le modifiche alla terapia, alla dose o il passaggio a farmaci generici devono essere effettuate solo in consultazione.
Gli inibitori della calcineurina, come molti altri farmaci, sono metabolizzati attraverso il CYP3A, quindi occorre prestare molta cautela nella prescrizione di nuovi farmaci a causa delle potenziali interazioni. In particolare, gli antibiotici macrolidi (soprattutto claritro ed eritromicina) possono causare una grave tossicità degli inibitori della calcineurina, inibendo il CYP3A. Ma i farmaci a base di erbe hanno anche un alto potenziale di interazione. Per esempio, una riduzione significativa dei livelli di inibitori della calcineurina può verificarsi con l’erba di San Giovanni e un forte aumento con il succo di pompelmo, con il rischio di rigetto consecutivo o di sovraimmunosoppressione.
Altri farmaci
Nelle procedure odontoiatriche e nelle endoscopie con o senza biopsie, la profilassi antibiotica non è obbligatoria solo perché il paziente necessita di immunosoppressione sistemica. La terapia antibiotica secondo il regime di profilassi dell’endocardite è solitamente indicata solo nei pazienti che riceverebbero la profilassi antibiotica anche senza immunosoppressione e/o se sono previsti interventi in un’area infetta. In caso di dubbio, la situazione individuale del paziente deve essere valutata con il centro trapianti in base allo stato immunitario.
Nella terapia analgesica, i FANS e gli inibitori della COX II devono essere assolutamente evitati a causa di vari possibili effetti collaterali renali (insufficienza renale acuta vasomotoria, nefrite tubulointerstiziale, ritenzione salina, ecc.
La funzione renale deve essere presa in considerazione al momento del dosaggio del farmaco. In un trapianto molto ben funzionante, il tasso di filtrazione glomerulare (GFR) è solitamente superiore a 60 ml/min e 1,73 m2 di superficie corporea. La dose deve essere regolata per i diversi intervalli di GFR, in base alle informazioni sul prodotto.
Infezioni del tratto urinario
Le infezioni più comuni dopo il trapianto di rene sono quelle del tratto urinario. In linea di principio, nel decorso a lungo termine si dovrebbero trattare solo le infezioni sintomatiche delle vie urinarie. Prima di iniziare la terapia empirica (di solito con ciprofloxacina o amoxicillina/acido clavulanico), è indispensabile eseguire un’urinocoltura per il successivo trattamento in base alla resistenza.
In caso di infezioni ricorrenti delle vie urinarie, la terapia empirica viene scelta in base alla precedente resistenza agli antibiotici. D’altra parte, è necessario prendere contatto con il centro trapianti per chiarire le possibili cause (ad esempio, il reflusso nell’età del trapianto, ecc.) Inoltre, il consumo di mirtilli rossi risp. Il succo di mirtillo rosso è consigliato come misura profilattica, in alcuni casi si può discutere anche l’uso della L-metionina per l’acidificazione urinaria.
Iperuricemia e gotta
A causa della riduzione della clearance renale dell’acido urico, l’iperuricemia è una complicanza frequentemente osservata della terapia con inibitori della calcineurina. Soprattutto con la ciclosporina, sono stati descritti attacchi di gotta nel 5-10% dei pazienti.
Per il trattamento di un attacco acuto di gotta, la somministrazione a breve termine di steroidi per tre-cinque giorni (circa). 20-50 mg/d) è consigliato. I FANS devono essere rigorosamente evitati. La profilassi con allopurinolo non deve essere somministrata ai pazienti in terapia continua con azatioprina, perché questa combinazione può portare a una grave neutropenia/agranulocitosi.
Diarrea e disturbi gastrointestinali
La diarrea e i disturbi gastrointestinali sono un problema comune nei pazienti immunocompromessi. Se un paziente lamenta una diarrea (>3 feci liquide/pure) che dura più di due giorni, occorre innanzitutto ricercare una causa infettiva (batteriologia generale delle feci, norovirus). In caso di persistenza e/o febbre concomitante, il paziente deve essere inviato al centro trapianti (chiarimento dell’infezione da CMV/colite da CMV, ecc.). Se si sospetta una diarrea indotta dal farmaco, che si osserva frequentemente con il micofenolato, soprattutto quando è scatenata da infezioni, si può modificare la dose degli immunosoppressori. In caso di diarrea, è sempre indicato anche un controllo precoce dei livelli di tacrolimus, in quanto può verificarsi un maggiore assorbimento di tacrolimus e quindi livelli elevati.
Fattori di rischio cardiovascolare
I fattori di rischio cardiovascolare devono essere trattati in modo coerente. L’ipertensione arteriosa è presente nel 60-80% dei pazienti con trapianto renale [6]. In linea di principio, possono essere utilizzate tutte le classi di sostanze antipertensive; inizialmente, di solito si utilizza soprattutto un calcio antagonista, con ACE inibitori o bloccanti ATII (blocco RAAS), se la funzione renale del trapianto è stabile. Se la proteinuria supera 1 g/24 h, una sostanza per il blocco del RAAS è la prima scelta. La pressione arteriosa target per la maggior parte dei pazienti trapiantati è 130/80 mmHg (nelle misurazioni domiciliari), in alcuni casi i valori target devono essere impostati individualmente.
La dislipidemia deve essere trattata in modo intensivo con misure di stile di vita, soprattutto con il controllo del peso. Spesso, però, è necessaria anche una terapia farmacologica con una statina. Il valore target delle LDL è <2,6 mmol/l. Anche le interazioni con gli immunosoppressori devono essere prese in considerazione.
I fumatori dovrebbero sempre essere motivati a smettere di usare la nicotina e dovrebbero ricevere programmi di cessazione del fumo. I pazienti obesi possono beneficiare di una consulenza nutrizionale. La profilassi con acido acetilsalicilico è raccomandata per la malattia cardiovascolare aterosclerotica.
Diabete mellito
Il diabete mellito spesso ricompare solo dopo il trapianto. In particolare, tacrolimus, sirolimus, la terapia steroidea e l’età avanzata sono fattori di rischio per la cosiddetta “Nuova insorgenza del diabete dopo il trapianto” (NODAT). Oltre alle consuete misure di stile di vita e ai farmaci antidiabetici orali, come gli inibitori della DPP4 (sitagliptin), l’insulina viene spesso presa in considerazione nelle fasi iniziali del trattamento della NODAT. Se l’immunosoppressione può essere ridotta nel corso del trattamento, il metabolismo del glucosio ritorna normale in alcuni pazienti. L’obiettivo terapeutico secondo le linee guida KDIGO è un’HbA1C <7-7,5%.
Desiderio di avere figli
Se desidera avere figli, è fondamentale contattare il centro trapianti per discutere apertamente dei rischi e dei pericoli. Anche un cambio di farmaci è solitamente obbligatorio prima di una possibile gravidanza. Una gravidanza in una donna dopo un trapianto di rene è fondamentalmente una gravidanza ad alto rischio e richiede un’assistenza interdisciplinare a stretto contatto con il centro trapianti.
Vaccinazioni e viaggi
Di norma, le vaccinazioni complete – secondo la Raccomandazione svizzera di vaccinazione per le persone prima e dopo il trapianto di organi solidi – dovrebbero essere già state effettuate prima del trapianto al momento dell’inserimento nella lista. Dopo il trapianto, i vaccini vivi come quelli contro la rosolia o il morbillo sono controindicati a causa dell’immunosoppressione. Tutte le vaccinazioni non viventi devono essere aggiornate regolarmente secondo le raccomandazioni di vaccinazione. Si raccomanda anche la vaccinazione antinfluenzale annuale. Tuttavia, bisogna tenere presente che la risposta alla vaccinazione è spesso un po’ attenuata in caso di terapia immunosoppressiva.
Quando viaggia in Paesi con un rischio maggiore di infezioni gastrointestinali, si raccomanda una consultazione preventiva, ad esempio presso un centro di medicina di viaggio. Le informazioni sulla situazione della resistenza in quel luogo possono essere ottenute qui. Su questa base, si determina la terapia empirica raccomandata da adottare in caso di emergenza.
Conclusione
In sintesi, il successo di un trapianto, soprattutto per quanto riguarda la sopravvivenza del trapianto e la qualità di vita del paziente, dipende in modo decisivo dalla stretta collaborazione tra medico di famiglia, nefrologo, centro trapianti e paziente.
Letteratura:
- Matas AJ, et al: Rapporto annuale sui dati OPTN/SRTR 2012: Rene.
- Kumar D, et al: The AST Handbook of Transplant Infections, Wiley-Blackwell, 2011.
- Zwald FO, et al: Il cancro della pelle nei riceventi di trapianti di organi solidi: progressi nella terapia e nella gestione Parte I: Epidemiologia del cancro della pelle nei riceventi di trapianti di organi solidi. J Am Acad Dermatol 2011; 65(2): 253-261.
- Engels E, et al: Spettro del rischio di cancro tra i riceventi di trapianto di organi solidi negli Stati Uniti. JAMA 2011; 306(17): 1891-1901.
- Kasiske B, et al: Linea guida di pratica clinica KDIGO per la cura dei riceventi di trapianto di rene: una sintesi. Kidney Int 2010; 77: 299-311.
- Danovitch G: Manuale del trapianto di rene, Wolters Kluver, 2010.
PRATICA GP 2015; 10(12): 20-24