Essendo la malattia polmonare cronica più comune nei neonati, la displasia broncopolmonare (BPD) è associata a conseguenze a lungo termine che si estendono all’età adulta. Nonostante i significativi miglioramenti nell’assistenza perinatale, l’incidenza di BPD tra i neonati più immaturi è rimasta invariata o addirittura aumentata. La diversa incidenza di BPD nei vari centri perinatali riflette sia le differenze nella popolazione di pazienti che nei metodi di trattamento.
Essendo la malattia polmonare cronica più comune nei neonati, la displasia broncopolmonare (BPD) è associata a conseguenze a lungo termine che si estendono all’età adulta [1,2]. Nonostante i significativi miglioramenti nell’assistenza perinatale, come il trattamento prenatale con steroidi per ottenere uno ‘sprint’ di maturazione dei polmoni, la terapia con surfattante e lo sviluppo di strategie di ventilazione adattate, l’incidenza di BPD nei neonati più immaturi è rimasta invariata o addirittura aumentata [3]. Questo è probabilmente dovuto a una riduzione significativa dei tassi di mortalità, insieme a un aumento del numero totale di neonati trattati nati significativamente prematuri. La diversa incidenza di BPD nei vari centri perinatali riflette sia le differenze nella popolazione di pazienti che nei metodi di trattamento [4–7]. Le pubblicazioni riportano un’incidenza di BPD fino al 68% nei neonati di peso molto basso (401-1500 g) con un’età gestazionale inferiore alle 29 settimane, o fino al 77% nei neonati nati a meno di 32 settimane di gestazione o con un peso alla nascita inferiore a 1 kg [5,8,9]. Queste cifre provengono principalmente dai Paesi con un prodotto interno lordo elevato. Con circa 15 milioni di bambini nati prematuri ogni anno in tutto il mondo, le cifre sopra riportate dimostrano l’importante sfida clinica e socio-economica [10].
La malattia polmonare cronica neonatale è classificata in tre livelli di gravità, come definito da Jobe e Bancalari: lieve (integrazione di ossigeno per almeno 28 giorni postnatali), moderata (integrazione di ossigeno <30% a 36 settimane di età postmestruale) e grave (integrazione di ossigeno al 30% e/o supporto ventilatorio a 36 settimane di età postmestruale) [1].
Ampi studi clinici hanno identificato numerosi fattori di rischio per lo sviluppo della BPD, tra cui le infezioni congenite e nosocomiali, la ventilazione meccanica e la tossicità dell’ossigeno [11–16]. L’impatto di queste sfide pre e postnatali è ulteriormente determinato dalla presenza di una carenza calorica o di vitamine e oligoelementi, nonché da una secrezione insufficiente di ormoni surrenali e tiroidei, che aumentano ulteriormente il rischio di sviluppare una morbilità polmonare [17–19]. La vulnerabilità del polmone in via di sviluppo allo sviluppo di danni cronici è anche aumentata da 3 a 4 volte dalla presenza di un ritardo di crescita intrauterino [20–24], per cui lo sviluppo alveolare e vascolare è decisamente compromesso dalla sottostante alterazione della trasduzione del segnale [25]. È stato dimostrato che l’esposizione al fumo di sigaretta prenatale – ampiamente sottovalutata a livello clinico a causa della mancanza di informazioni anamnestiche e di marcatori clinici – contribuisce in modo significativo allo sviluppo della malattia, probabilmente al di là di un impatto sulla crescita somatica [26,27].
Anche il ruolo delle terapie consolidate deve essere costantemente rivisto per quanto riguarda il possibile contributo allo sviluppo di complicanze croniche. Gli effetti del trattamento steroideo e dell’antibiotico materno sono discussi di seguito alla luce di ciò.
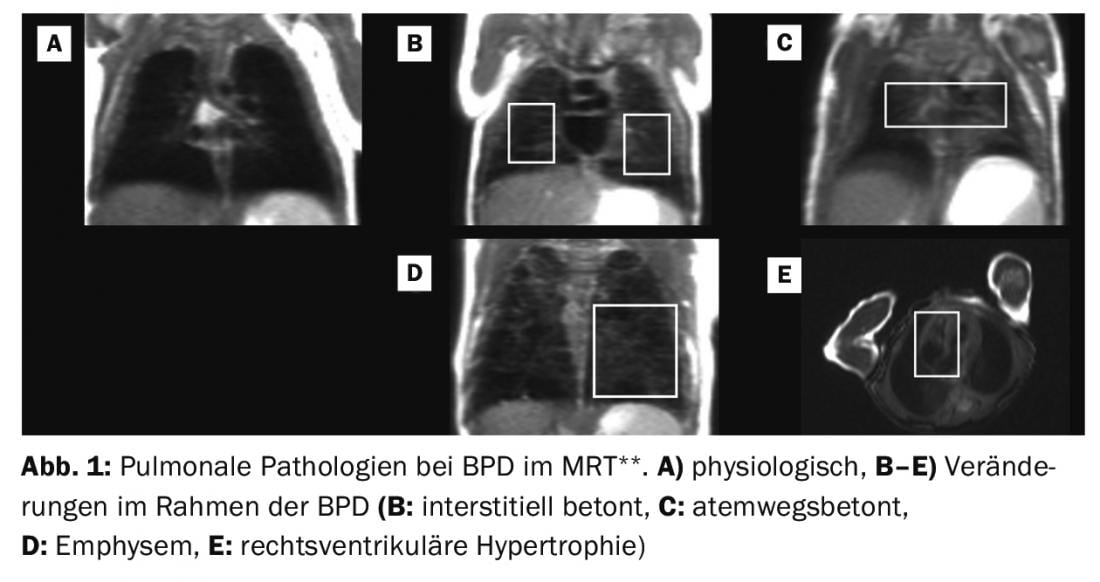
** Adattato da: Punteggio basato sulla risonanza magnetica del polmone malato nel neonato pretermine con BPD. Kai Förster, Hannah Busen, Sophia Stöcklein, Olaf Dietrich, Harald Ehrhardt, Mark O. Wielpütz, Andreas W. Flemmer, Benjamin Schubert, Marcus A. Mall, Birgit Ertl-Wagner, Anne Hilgendorff. Questo manoscritto è in fase di presentazione presso Torace.
La discussione sull’importanza dei vari fattori di rischio deve essere condotta, in ultima analisi, nel contesto delle nostre conoscenze attuali, in continua evoluzione, sull’importanza dei polimorfismi genetici, e gli studi riportano che fino al 53% della varianza nel BPD può essere dovuta a questo [28]. Le anomalie genetiche identificate includono mutazioni nei geni legati alla sintesi del surfattante, alla risposta immunitaria innata [29,30] e alla superossido dismutasi [31]. Il rischio più elevato di sviluppare BPD e ipertensione arteriosa polmonare (PAH) nei neonati pretermine maschi [32] è stato collegato a differenze nella regolazione ormonale [33]. Al contrario, più avanti, le donne con una storia di BPD sono più colpite a lungo termine [34].
Le difficoltà nell’identificare i fattori di rischio genetici clinicamente rilevanti sorgono sia nella differenziazione tra le variabili che influenzano il rischio di nascita pretermine di per sé [35] sia nel considerare le complicanze acute [36] e croniche in relazione tra loro. Il fatto che i grandi studi di associazione genetica [37] non siano ancora riusciti a dare seguito ai successi ottenuti in altre aree patologiche, come la fibrosi cistica [38] o la PAH [39,40] in termini di risultati di tendenza con rilevanza clinica, può tuttavia essere, oltre ai motivi citati, anche un’indicazione dell’eterogeneità della diagnosi di BPD. In futuro, l’identificazione delle (sotto)entità patologiche sottostanti potrebbe consentire un’assegnazione più chiara di alcuni fattori di rischio e polimorfismi genetici. Allo stesso modo, la conoscenza dei siti chiave nella trasduzione del segnale che controllano l’interazione di diverse popolazioni di cellule polmonari permetterà di classificare i geni candidati. Le sezioni seguenti affrontano vari aspetti di questo aspetto.
Dalla causa alla conseguenza: infiammazione e risposta allo stress ossidativo
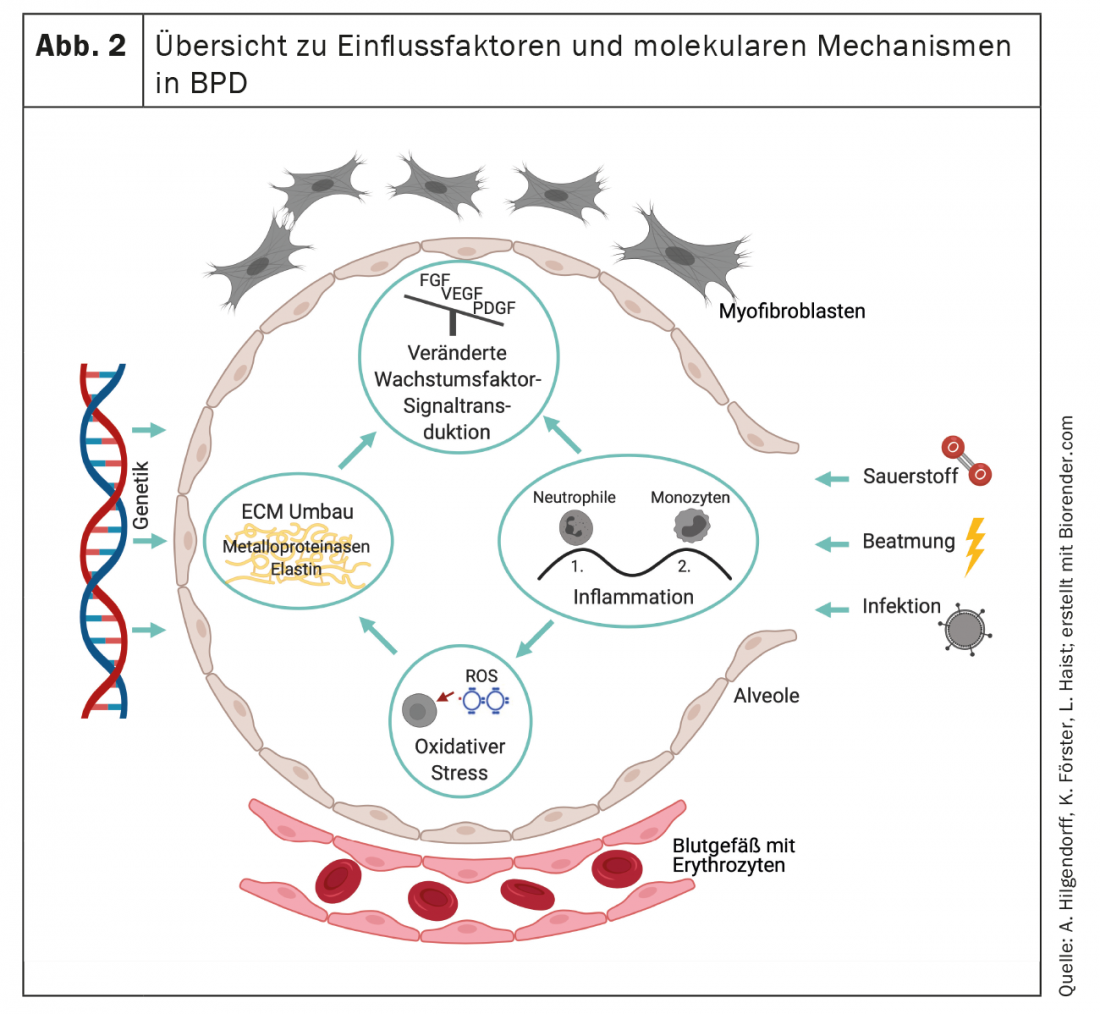
Le influenze esogene descritte che agiscono prima e dopo la nascita su un polmone strutturalmente e funzionalmente immaturo portano a una risposta infiammatoria persistente, al rimodellamento della matrice extracellulare (ECM) e a cambiamenti fibrotici diffusi, compresa l’ipertrofia della muscolatura liscia nelle piccole arterie polmonari e nelle vie aeree [41]. I caratteristici cambiamenti istopatologici con il quadro di alveolarizzazione e vasculogenesi disturbate [1] determinano un’ipoventilazione alveolare, che si esprime nel quadro clinico di ipercapnia e ipossiemia e nel mismatch ventilazione-perfusione [42].
I processi infiammatori acuti e cronici che caratterizzano la BPD sono causati da meccanismi sia pre che postnatali. Le infezioni e la corrispondente capacità di generare una risposta immunitaria competente giocano un ruolo importante nello sviluppo della BPD [13,43–45]. I processi infiammatori prenatali, riassunti ad esempio con il termine “sindrome di risposta infiammatoria fetale (FIRS)” o che si verificano nel contesto di eventi infettivi manifesti come la corioamnionite prenatale o postnatale nel contesto di infezioni congenite e nosocomiali, portano ad un afflusso di granulociti neutrofili nel polmone immaturo. Di conseguenza, vi è la presenza di un numero maggiore di monociti e macrofagi come parte della cosiddetta “seconda ondata” della risposta immunitaria [24,46,47]. Il ruolo dell’immunità innata è di particolare importanza in questo caso, poiché anche l’immunità adattativa può essere espressa in modo variabile a seconda dell’età gestazionale [48]. Gli studi sugli animali suggeriscono che il rimodellamento della matrice extracellulare e la disfunzione epiteliale alveolare precoce non sono solo una conseguenza della risposta infiammatoria, ma la promuovono ulteriormente [49,50] e quindi causano cambiamenti duraturi nella funzione immunitaria polmonare. A livello prenatale, l’uso diffuso di trattamenti antibiotici materni porta a un cambiamento duraturo della flora batterica del bambino [51] e della funzione immunitaria della prole nel modello murino [52].
Post-natale, l’induzione di lesioni da baro- e volutrauma durante la ventilazione meccanica e le conseguenze dell’iperossia moderata o grave sono importanti fattori di rischio per l’avvio e il mantenimento dei processi infiammatori sopra evidenziati a livello locale e persino sistemico [53–56]. Il rilascio di citochine come il fattore di crescita trasformante (TGF)-β, il fattore di necrosi tumorale (TNF)-alfa e le interleuchine, ad esempio IL-1beta, contribuisce in modo significativo allo squilibrio della trasduzione del segnale di vari (altri) fattori di crescita e porta all’attivazione di fattori di trascrizione che promuovono l’apoptosi in diverse cellule [57–59]. La discussione sul ruolo delle cellule infiammatorie reclutate e residenti [60–64] fornirà importanti approfondimenti sui rapporti meccanicistici e per l’identificazione di opzioni terapeutiche. In questo contesto, tuttavia, la sospetta influenza delle cellule infiammatorie sullo sviluppo polmonare genererà anche nuovi approcci di ricerca [65].
I processi infiammatori acuti e cronici devono essere considerati nel contesto della capacità cellulare di rispondere alle sfide postnatali persistenti o ricorrenti. Qui, la relativa mancanza di antiossidanti e di inibitori degli enzimi proteolitici rende il polmone immaturo particolarmente vulnerabile agli effetti dei metaboliti tossici dell’ossigeno e delle proteasi rilasciate dalla matrice extracellulare e dai granulociti neutrofili e dai macrofagi residenti o reclutati [66-69]. Diversi studi hanno dimostrato l’evidenza di un aumento dello stress ossidativo nel neonato pretermine. Pertanto, le concentrazioni urinarie di malondialdeide sono elevate nella prima settimana di vita a causa della perossidazione delle membrane lipidiche in seguito a un danno mediato dall’ossidazione ed è stato dimostrato che sono correlate al rischio di malattie da radicali dell’ossigeno, compresa la BPD [70]. Sono state misurate concentrazioni ridotte di antiossidanti polmonari nel lavaggio dei neonati pretermine [71], e altri studi indicano che i pazienti adolescenti con BPD sono caratterizzati da segni di maggiore stress ossidativo nelle vie aeree, segno di cambiamenti a lungo termine nel sistema respiratorio in seguito alla nascita pretermine [72]. Anche le terapie consolidate devono essere riviste criticamente per quanto riguarda il loro ruolo nello sviluppo polmonare alla luce delle nuove evidenze, come, ad esempio, la somministrazione prenatale di betametasone, nonostante il suo uso prenatale più diffuso per promuovere la maturazione polmonare e prevenire il distress respiratorio, riducendo i tassi di BPD. [73,74] hanno dimostrato di aumentare gli indicatori della perossidazione delle membrane lipidiche. [70].
Questi cambiamenti a lungo termine nella risposta allo stress ossidativo e in altri processi si riflettono in risposte alterate alle infezioni virali più avanti nella vita [75]. La risposta del polmone in via di sviluppo al danno precoce, anche per quanto riguarda le conseguenze a lungo termine, è specifica e diversa dalla risposta dell’organismo adulto. Mentre l’esposizione cronica all’ossigeno (60% per 14 giorni) nei polmoni di ratto neonatale aumenta la contrazione dei vasi polmonari e della muscolatura liscia delle vie aeree e riduce il rilassamento dell’ossido nitrico, il fenomeno opposto si verifica negli animali adulti [76]. Gli effetti a lungo termine dopo l’esposizione all’iperossia nella prima settimana di vita (100% per 4 giorni) comprendono principalmente le complicazioni cardiovascolari, in cui si è sviluppato uno sforzo del ventricolo destro nella PAH e un conseguente aumento della mortalità come conseguenza della malattia vascolare polmonare nei modelli animali [77]. L’alterata trasduzione del segnale da parte della proteina morfogenica ossea (BMP) offre una spiegazione pato-meccanicistica. Altri meccanismi che spiegano la maggiore suscettibilità ai danni acuti e a lungo termine nel polmone del neonato sono dimostrati da un altro studio sugli effetti indotti dall’iperossia. Nel topo neonatale – a differenza dell’animale adulto – le cellule progenitrici endoteliali di derivazione midollare, circolanti e polmonari sono significativamente ridotte qui [78], il che può portare ad un esaurimento precoce delle capacità di riparazione e rigenerazione. L’influenza su ulteriori processi centrali, come la regolazione del ciclo cellulare con un’innalzamento di P21 dopo l’iperossia e una riduzione dell’attività dell’istone deacetilasi [79] e gli effetti sulla metilazione del DNA [80] indicano anche lo sviluppo precoce di effetti accumulativi rilevanti a lungo termine nel contesto di meccanismi compensatori ridotti nel polmone immaturo.
Caratteristiche istopatologiche – Generatore di orologio e funzione di ‘memoria’
L’interazione del compartimento delle cellule epiteliali, mesenchimali ed endoteliali nella loro interazione per lo sviluppo dell’area di scambio gassoso è essenzialmente orchestrata dalla regolazione di vari fattori di crescita. Questi includono Notch e Wingless Int-1 (Wnt), fattore di crescita derivato dai fibroblasti e dalle piastrine (FGF e PDGF), BMP e fattore di crescita endoteliale vascolare (VEGF) [81–87]. L’interferenza precoce con questi fattori di trascrizione interrompe la normale morfogenesi polmonare [88] con conseguente mancanza di differenziazione delle strutture alveolari [89]. Allo stesso modo, la regolazione dei fattori di trascrizione centrali, come il fattore nucleare kappa B (NF-kB), svolge un ruolo e contribuisce al cattivo sviluppo della superficie di scambio dei gas [88,90,91]. L’associazione caratteristica di un’alveolarizzazione compromessa con la presenza di capillari dismorfici è guidata da un’espressione alterata dei fattori di crescita angiogenici, che includono una ridotta espressione polmonare del fattore di crescita endoteliale vascolare (VEGF) e dei recettori VEGF. [92–94] così come la riduzione dell’ossido nitrico sintasi endoteliale (eNOS) e della guanilato ciclasi solubile (sGC) nei vasi sanguigni polmonari e nelle vie aeree includono [95,96]. I cambiamenti sono simili a quelli dell’organismo che invecchia e contribuiscono – anche a causa della ridotta plasticità dei capillari e dei piccoli vasi – al rischio di IPA e allo sviluppo compromesso del sistema linfatico nei polmoni con il progredire della malattia [97–100].
La trasduzione del segnale disturbata, insieme agli effetti diretti, ad esempio, dello stimolo di stiramento dovuto alla ventilazione meccanica e alla tossicità dell’ossigeno, contribuiscono a gravi cambiamenti nell’impalcatura polmonare [101,102]. L’aumento del rimodellamento della matrice extracellulare è indicato, ad esempio, dall’aumento dell’escrezione urinaria di desmosina, preceduta da un aumento dell’attività dell’elastasi [103–105] ed è simile ai risultati nei pazienti con sindrome da distress respiratorio acuto (ARDS) [106]. Tuttavia, lo sviluppo polmonare fisiologico dipende anche dalla presenza di elastasi e metalloproteinasi polmonari, poiché la carenza completa di metalloproteinasi di matrice promuove il rimodellamento polmonare di tipo BPD [107].
Come risultato del rimodellamento, la BPD è caratterizzata da una disposizione patologica dell’elastina e da cambiamenti qualitativi e quantitativi del quadro collagene. [108–110] Caratterizza la funzione strutturante della matrice come impalcatura per la formazione di nuovi alveoli e capillari e definisce il destino delle cellule che popolano l’organo in via di sviluppo. [111,112] (Fig. 2). La riorganizzazione irreversibile della matrice extracellulare porterà quindi a cambiamenti a lungo termine che si manifesteranno a vari livelli.
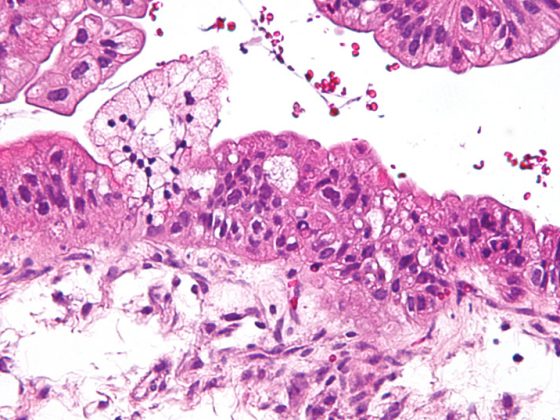
I cambiamenti istopatologici e lo sviluppo e l’aspetto clinicamente eterogeneo della BPD suggeriscono l’esistenza di (sotto)entità patologiche o almeno un’influenza individualmente diversa dei vari cambiamenti strutturali sull’aspetto clinico e sul decorso a lungo termine. In questo contesto, la presenza di processi primari di rimodellamento enfisematoso o interstiziale, di alterazioni vascolari e/o di patologie delle vie respiratorie sono presumibilmente “variabili” indicative della BPD, che negli studi iniziali possono anche essere rappresentate a livello di immagine-morfologia nei neonati prematuri mediante strategie di imaging clinicamente fattibili [113–117]. Replicando gli studi di successo di altre aree patologiche, l’uso di ulteriori strategie di imaging [118–121] potrebbe migliorare ulteriormente la stratificazione dei pazienti in futuro.
Funzione polmonare nella BPD – Cambiamenti precoci e conseguenze a lungo termine
Nonostante gli sforzi sostenuti nell’assistenza perinatale per evitare complicazioni a lungo termine [122,123], la manifestazione di sintomi respiratori in età adulta è comune e spesso viene interpretata erroneamente come asma o BPCO, soprattutto se non si conoscono o non si indagano gli eventi precoci della vita [124,125].
Clinicamente, la disfunzione polmonare è caratterizzata da una diminuzione della compliance polmonare, tachipnea e aumento della ventilazione al minuto, che si riflette in un aumento del lavoro respiratorio con e senza dipendenza dall’ossigeno. Questo quadro clinico può essere accompagnato da un aumento della pressione microvascolare nei polmoni, che contribuisce allo sviluppo dell’edema polmonare interstiziale. L’aumento della resistenza vascolare polmonare, tipicamente associata a una ridotta reattività all’ossido nitrico inalato e ad altri vasodilatatori, può progredire fino alla PAH reversibile o persistente e all’insufficienza cardiaca destra [99,100]. La conoscenza dei cambiamenti precoci della funzione polmonare è fondamentale, in quanto una malattia polmonare più grave dopo la nascita ha maggiori probabilità di svilupparsi in BPD moderata/severa alla data prevista per il parto [126] e la funzione polmonare è un buon predittore di morbilità e mortalità successive [127]. La BPD è caratterizzata nella funzione polmonare da un aumento della resistenza delle vie aeree e da un’iperreattività delle vie aeree. [128]che si manifesta clinicamente – in concomitanza o indipendentemente dalle infezioni polmonari – con broncocostrizione episodica e cianosi (Fig. 3). La percentuale di patologia vascolare mediata che gioca un ruolo in questo caso, oltre all’effetto Euler-Liljestrand, rimane spesso poco chiara perché mancano indicatori sensibili. I neonati affetti possono rimanere dipendenti dall’ossigeno per mesi o anni, e solo una minoranza dipende effettivamente dall’ossigeno oltre i due anni di età [129,130]. La dipendenza dall’ossigeno caratterizza la particolare gravità della malattia polmonare e questi neonati vengono riammessi in ospedale con una frequenza doppia rispetto ai neonati non dipendenti dall’ossigeno. Tuttavia, anche dopo la fine dell’ossigenoterapia, i pazienti con disturbi moderati o gravi fino al 70% richiedono ricoveri ripetuti, soprattutto nei primi due anni di vita [126,131,132]. Nel complesso, tuttavia, le infezioni del tratto respiratorio inferiore causate dal virus respiratorio sinciziale (RS) rimangono la principale causa di riammissione ospedaliera nei neonati pretermine, indipendentemente dallo stato di BPD [133].
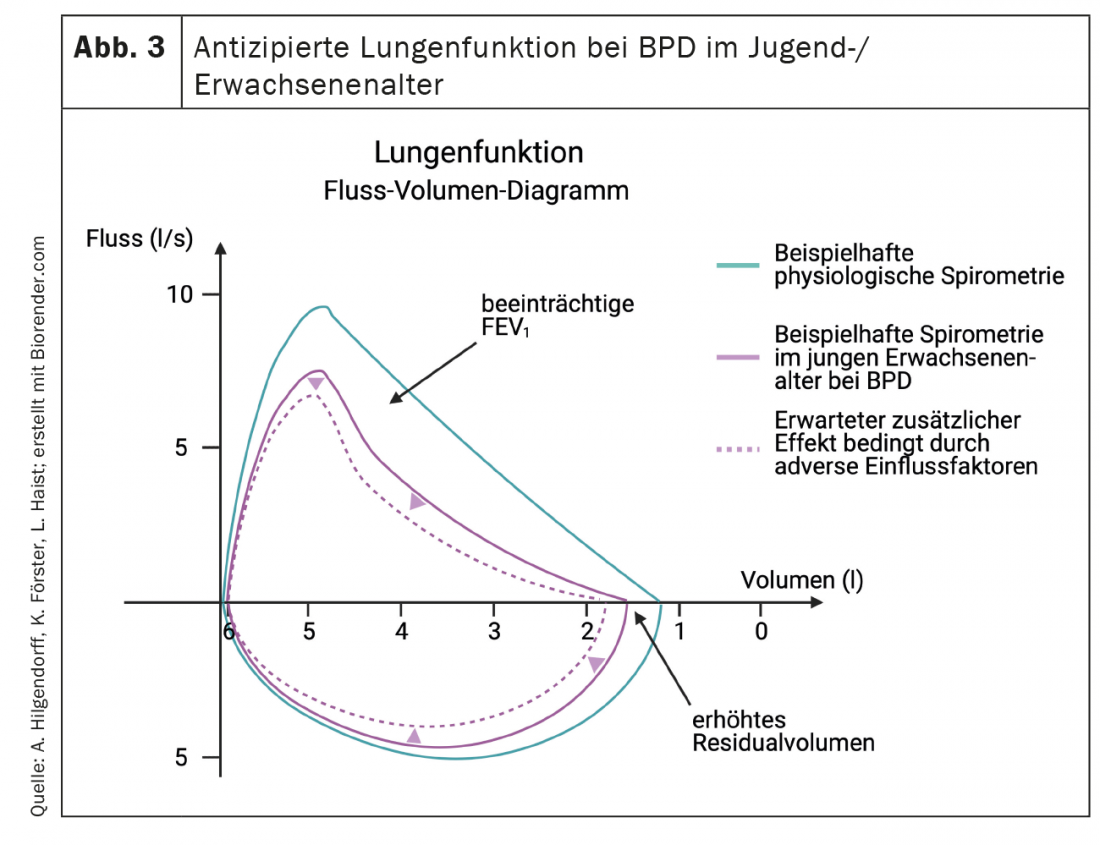
Più avanti nel decorso della malattia, la BPD è un fattore di rischio significativo per il respiro sibilante persistente e per la necessità di terapia inalatoria (odds ratio 2,7 e 2,4, rispettivamente), che colpisce circa il 20-30% dei neonati con BPD a sei e 12 mesi di età [134,135]. I sintomi respiratori, soprattutto nei bambini con una storia di respiro sibilante, spesso rimangono [129,136] in età prescolare e scolare, e fino all’80% dei neonati pretermine mostra una frequente ostruzione sintomatica delle vie aeree nella prima infanzia e nell’adolescenza [137–139]. Dati importanti sull’esito a lungo termine dopo la nascita pretermine sono stati ottenuti nello studio EPICure [140]. I neonati prematuri con estrema immaturità presentano un consumo di ossigeno di picco significativamente più basso in età scolare, come valutazione diretta della forma cardiorespiratoria, un volume espiratorio forzato inferiore a un secondo (FEV1) e un trasferimento di gas compromesso. In questo caso, i carichi di picco significativamente più bassi e le frequenze respiratorie più elevate, combinate con volumi tidalici più bassi durante il carico di picco e una maggiore capacità residua, possono riflettere l’effetto dell’iperinflazione sull’ostruzione delle vie aeree e/o i cambiamenti nella funzione dei chemorecettori polmonari e indicano la presenza di limitazioni persistenti nella funzione delle vie aeree e una riduzione della superficie alveolare. I cambiamenti non fisiologici basati sulla crescita polmonare con una riduzione del FEV1 e del FEV1/capacità vitale forzata nella BPD sono stati confermati da diversi studi su bambini e giovani adulti [141–144].
Il decorso della malattia in età adulta varia. In alcuni pazienti, in particolare quelli con BPD grave, i sintomi persistono fino all’età adulta [145]. Altri decorsi indicano un miglioramento temporaneo (soggettivo) con una successiva ricomparsa dei sintomi della malattia che sono il risultato di una (ulteriore) limitazione della funzione polmonare al di sotto di una soglia clinica (o individuale). Questa riduzione può verificarsi a causa dei processi di invecchiamento o di un emergente disallineamento del rapporto massa polmonare/corpo e/o del dispendio energetico. Mentre un gruppo ha riportato un andamento divergente della crescita polmonare durante l’adolescenza in base alle misurazioni spirometriche [141], lo studio EPICure non ha mostrato un recupero della crescita polmonare subottimale dagli 11 ai 19 anni negli adolescenti dopo una nascita estremamente pretermine, indipendentemente dallo stato di BPD, e ha persino dimostrato una significativa compromissione di tutti i parametri della funzione polmonare nei pazienti estremamente pretermine di 19 anni [144]. Nel frattempo, Vollsaeter e colleghi hanno riportato dei percorsi paralleli della funzione polmonare nella prima età adulta [146].
La migliore comprensione delle caratteristiche e degli effetti dell’invecchiamento polmonare precoce dopo la nascita pretermine [147,148] e per chiarire la caratterizzazione dell’impatto delle lesioni secondarie, ad esempio dovute al fumo, alle esacerbazioni nel contesto delle infezioni virali e alle influenze ambientali più ampie sul decorso della funzione polmonare. [149,150] sarà anche fondamentale per la consulenza precoce delle famiglie in merito al decorso a lungo termine e all’accordo sulle strategie di controllo.
Un altro campo è definito dalla presenza di comorbidità per le quali la BPD rappresenta un fattore di rischio a sé stante [151]. Questo riguarda le malattie neurologiche e cardiovascolari e include la considerazione delle complicanze associate alla terapia. Il trattamento con desametasone, in particolare, svolge un ruolo speciale in questo caso, con effetti negativi sulla funzione cardiaca, sull’aspettativa di vita e sullo sviluppo neurologico [152,153].
Sommario
La risposta del polmone immaturo ai meccanismi di danno pre e postnatale, manifestati da una risposta infiammatoria sostenuta, da una risposta allo stress ossidativo e da un’alterata segnalazione dei fattori di crescita, che porta a gravi alterazioni nello sviluppo alveolare e vascolare, compreso il rimodellamento della matrice extracellulare, è associata a conseguenze significative a lungo termine. Le anomalie della funzione polmonare (e dell’immunità) nell’infanzia e nella prima giovinezza predispongono alla riduzione della funzione polmonare nei sopravvissuti adulti alla nascita pretermine e all’alterazione del processo di invecchiamento fisiologico attraverso un “effetto memoria” polmonare in risposta alle lesioni precoci. È necessario uno scambio continuo di conoscenze tra pediatri, medici di base e pneumologi dell’adulto per generare una migliore comprensione di questi esiti a lungo termine, comprese le caratteristiche e gli effetti dell’invecchiamento precoce, e tradurli in strategie di trattamento adattate e raccomandazioni sullo stile di vita per questo gruppo di pazienti. L’interpretazione dei risultati della funzionalità polmonare deve anche prendere in considerazione la definizione originale di BPD e gli standard applicati di assistenza perinatale nel contesto dell’età in cui è stata diagnosticata la BPD.
Messaggi da portare a casa
- La BPD è una malattia respiratoria cronica dell’infanzia caratterizzata da rarefazione alveolare, affezione delle piccole vie aeree e alterazioni vascolari polmonari. Le osservazioni di follow-up della funzione polmonare possono includere una diminuzione della capacità di un secondo nei bambini e negli adulti con una storia di BPD.
- L’associazione caratteristica di un’alveolarizzazione compromessa con la presenza di capillari dismorfici è guidata dall’espressione alterata dei fattori di crescita angiogenici. Alcuni cambiamenti sono simili a quelli dell’organismo che invecchia e contribuiscono al rischio di PAH e allo sviluppo compromesso del sistema linfatico nei polmoni con il progredire dell’età.
- La BPD, come risultato del rimodellamento, è caratterizzata da una disposizione patologica dell’elastina e da cambiamenti qualitativi e quantitativi dell’impalcatura di collagene, che influiscono sulla funzione strutturante della matrice come impalcatura per la formazione di nuovi alveoli e capillari e definiscono il destino delle cellule che popolano l’organo in via di sviluppo.
- Il danno precoce al polmone porta a una risposta infiammatoria persistente, a una risposta di stress ossidativo e a un’alterata trasduzione del segnale di importanti fattori di crescita.
- Lo scambio continuo di conoscenze tra pediatri, medici di base e pneumologi dell’adulto è necessario per ottenere una migliore comprensione degli esiti a lungo termine, comprese le caratteristiche e gli effetti dell’invecchiamento precoce.
- L’impatto della malattia polmonare cronica precoce sullo sviluppo di comorbilità deve essere considerato quando si progettano strategie di monitoraggio e trattamento e si formulano raccomandazioni sullo stile di vita per questo gruppo di pazienti.
Letteratura:
- Jobe AH, Bancalari E: Displasia broncopolmonare. Am J Respir Crit Care Med 2001; 163(7): 1723-1729.
- Duijts L, van Meel ER, Moschino L, et al: Linea guida della European Respiratory Society sulla gestione a lungo termine dei bambini con displasia broncopolmonare. Eur Respir J 2020; 55(1).
- Doyle LW: Valutazione della terapia intensiva neonatale per i neonati di peso estremamente basso alla nascita. Semin Fetal Neonatal Med 2006; 11(2): 139-145.
- Gortner L, Misselwitz B, Milligan D, membri dell’MRG, et al: Tassi di displasia broncopolmonare nei neonati molto pretermine in Europa: risultati della coorte MOSAIC. Neonatologia 2011; 99(2): 112-117.
- Stoll BJ, Hansen NI, Bell EF, Eunice Kennedy Shriver National Institute of Child H, Human Development Neonatal Research N, et al: Esiti neonatali dei neonati estremamente pretermine del NICHD Neonatal Research Network. Pediatria 2010; 126(3): 443-456.
- Vachon E, Bourbonnais Y, Bingle CD, et al.: Effetto antinfiammatorio della pre-elafina nell’infiammazione polmonare acuta indotta dal lipopolisaccaride. Biol Chem 2002; 383(7-8): 1249-1256.
- Van Marter LJ, Pagano M, Allred EN, et al: Tasso di displasia broncopolmonare in funzione delle pratiche di terapia intensiva neonatale. J Pediatr 1992; 120(6): 938-946.
- Ehrenkranz RA, Walsh MC, Vohr BR, National Institutes of Child H, Human Development Neonatal Research N, et al: Validazione della definizione di consenso del National Institutes of Health di displasia broncopolmonare. Pediatria 2005; 116(6): 1353-1360.
- Johnson AH, Peacock JL, Greenough A, United Kingdom Oscillation Study G, et al: Ventilazione oscillatoria ad alta frequenza per la prevenzione della malattia polmonare cronica della prematurità. N Engl J Med 2002; 347(9): 633-642.
- Chawanpaiboon S, Vogel JP, Moller AB, et al: Stime globali, regionali e nazionali dei livelli di nascite pretermine nel 2014; una revisione sistematica e un’analisi di modellizzazione. Lancet Glob Health 2019; 7(1): e37-e46.
- Clyman R, Cassady G, Kirklin JK, et al: Il ruolo della legatura del dotto arterioso pervio nella displasia broncopolmonare: riesame di uno studio controllato randomizzato. J Pediatr 2009; 154(6): 873-876.
- Korhonen P, Tammela O, Koivisto AM, et al: Frequenza e fattori di rischio nella displasia broncopolmonare in una coorte di neonati con peso alla nascita molto basso. Early Hum Dev 1999; 54(3): 245-258.
- Kramer BW: Infiammazione prenatale e lesioni polmonari: origine prenatale della malattia neonatale. J Perinatol 2008; 28 Suppl 1: S21-27.
- Mittendorf R, Covert R, Montag AG, et al.: Relazioni speciali tra la sindrome di risposta infiammatoria fetale e la displasia broncopolmonare nei neonati. J Perinat Med 2005; 33(5): 428-434.
- Oh W, Poindexter BB, Perritt R, Neonatal Research N, et al: Associazione tra assunzione di liquidi e perdita di peso nei primi dieci giorni di vita e rischio di displasia broncopolmonare nei neonati di peso estremamente basso alla nascita. J Pediatr 2005; 147(6): 786-790.
- Stevens TP, Harrington EW, Blennow M, Soll RF: Somministrazione precoce di surfattante con ventilazione breve vs. surfattante selettivo e ventilazione meccanica continua per i neonati pretermine con o a rischio di sindrome da distress respiratorio. Cochrane Database Syst Rev 2007(4); CD003063.
- Biniwale MA, Ehrenkranz RA: Il ruolo della nutrizione nella prevenzione e nella gestione della displasia broncopolmonare. Semin Perinatol 2006; 30(4): 200-208.
- Shenai JP, Chytil F, Stahlman MT: Stato della vitamina A nei neonati con displasia broncopolmonare. Pediatr Res 1985; 19(2): 185-188.
- Watterberg KL, Scott SM: Evidenza di un’insufficienza surrenale precoce nei neonati che sviluppano displasia broncopolmonare. Pediatria 1995; 95(1): 120-125.
- Bose C, Van Marter LJ, Laughon M, Extremely Low Gestational Age Newborn Study I, et al: Restrizione della crescita fetale e malattia polmonare cronica tra i neonati nati prima della 28esima settimana di gestazione. Pediatria 2009; 124(3): e450-458.
- Regev RH, Lusky A, Dolfin T, Israel Neonatal N, et al: Eccesso di mortalità e morbilità tra i neonati prematuri piccoli per l’età gestazionale: uno studio basato sulla popolazione. J Pediatr 2003; 143(2): 186-191.
- Reiss I, Landmann E, Heckmann M, et al.: Aumento del rischio di displasia broncopolmonare e aumento della mortalità nei neonati molto pretermine che sono piccoli per l’età gestazionale. Arch Gynecol Obstet 2003; 269(1): 40-44.
- Rieger-Fackeldey E, Schulze A, Pohlandt F, et al: Esito a breve termine nei neonati con peso alla nascita inferiore a 501 grammi. Acta Paediatr 2005; 94(2): 211-216.
- Walsh MC, Yao Q, Horbar JD, et al: Cambiamenti nell’uso di steroidi postnatali per la displasia broncopolmonare in 3 grandi reti neonatali. Pediatria 2006; 118(5): e1328-1335.
- Rozance PJ, Seedorf GJ, Brown A, et al.: La restrizione della crescita intrauterina diminuisce la crescita degli alveoli e dei vasi polmonari e causa la disfunzione delle cellule endoteliali dell’arteria polmonare in vitro nelle pecore fetali. Am J Physiol Lung Cell Mol Physiol 2011; 301(6): L860-871.
- Gilliland FD, Berhane K, McConnell R, et al: Fumo materno durante la gravidanza, esposizione al fumo ambientale e funzione polmonare infantile. Thorax 2000; 55(4): 271-276.
- Vogt Isaksen C: Fumo materno, restrizione della crescita intrauterina e apoptosi placentare. Pediatr Dev Pathol 2004; 7(5): 433-442.
- Bhandari V, Bizzarro MJ, Shetty A, Neonatal Genetics Study G, et al: Suscettibilità familiare e genetica alle principali morbilità neonatali nei gemelli pretermine. Pediatria 2006; 117(6): 1901-1906.
- Hallman M, Haataja R: Influenze genetiche e malattie polmonari neonatali. Semin Neonatol 2003; 8(1): 19-27.
- Hilgendorff A, Heidinger K, Pfeiffer A, et al.: Associazione tra polimorfismi nel gene della lectina legante il mannosio e morbilità polmonare nei neonati pretermine. Genes Immun 2007; 8(8): 671-677.
- Poggi C, Giusti B, Vestri A, et al: Polimorfismi genetici degli enzimi antiossidanti nei neonati pretermine. J Matern Fetal Neonatal Med 2012; 25 Suppl 4: 131-134.
- Binet ME, Bujold E, Lefebvre F, Canadian Neonatal N, et al: Ruolo del sesso nella morbilità e mortalità dei neonati estremamente prematuri. Am J Perinatol 2012; 29(3): 159-166.
- Trotter A, Maier L, Kron M, Pohlandt F: Effetto della sostituzione di estradiolo e progesterone sulla displasia broncopolmonare nei neonati estremamente prematuri. Arch Dis Child Fetal Neonatal Ed 2007; 92(2): F94-98.
- Vrijlandt EJ, Gerritsen J, Boezen HM, Duiverman EJ, Dutch P-CSG: Differenze di genere nei sintomi respiratori in adulti di 19 anni nati pretermine. Respir Res 2005; 6: 117.
- Wadon M, Modi N, Wong HS, et al: Recenti progressi nella genetica della nascita pretermine. Ann Hum Genet 2020; 84(3): 205-213.
- Fraser J, Walls M, McGuire W: Complicazioni respiratorie della nascita pretermine. BMJ 2004; 329(7472): 962-965.
- Wang H, St Julien KR, Stevenson DK, et al: Uno studio di associazione genome-wide (GWAS) per la displasia broncopolmonare. Pediatria 2013; 132(2): 290-297.
- Lommatzsch ST, Aris R: Genetica della fibrosi cistica. Semin Respir Crit Care Med 2009; 30(5): 531-538.
- Sztrymf B, Coulet F, Girerd B, et al: Esiti clinici dell’ipertensione arteriosa polmonare nei portatori della mutazione BMPR2. Am J Respir Crit Care Med 2008; 177(12): 1377-1383.
- Austin ED, Loyd JE: La genetica dell’ipertensione arteriosa polmonare. Circ Res 2014; 115(1): 189-202.
- Husain AN, Siddiqui NH, Stocker JT: Patologia dell’arresto dello sviluppo acinare nella displasia broncopolmonare post-surfattante. Hum Pathol 1998; 29(7): 710-717.
- Lopez E, Mathlouthi J, Lescure S, et al: La capnografia nei neonati pretermine a respirazione spontanea con displasia broncopolmonare. Pediatr Pulmonol 2011; 46(9): 896-902.
- Stoll BJ, Gordon T, Korones SB, et al: Sepsi precoce nei neonati di peso molto basso alla nascita: un rapporto del National Institute of Child Health and Human Development Neonatal Research Network. J Pediatr 1996; 129(1): 72-80.
- Watterberg KL, Demers LM, Scott SM, Murphy S: Corioamnionite e infiammazione polmonare precoce nei neonati in cui si sviluppa la displasia broncopolmonare. Pediatria 1996; 97(2): 210-215.
- Yoon BH, Romero R, Jun JK, et al: Citochine del liquido amniotico (interleuchina-6, fattore di necrosi tumorale-alfa, interleuchina-1 beta e interleuchina-8) e rischio di sviluppo di displasia broncopolmonare. Am J Obstet Gynecol 1997; 177(4): 825-830.
- Speer CP: Infiammazione e displasia broncopolmonare: una storia continua. Semin Fetal Neonatal Med 2006; 11(5): 354-362.
- Todd DA, Earl M, Lloyd J, Greenberg M, John E: Cambiamenti citologici negli aspirati endotracheali associati alla malattia polmonare cronica. Early Hum Dev 1998; 51(1): 13-22.
- Ibrahim J, Garantziotis S, Savani R: Aggiornamenti sulla Malattia Polmonare Cronica Neonatale 2020, Capitolo 9 – La superstrada dell’infiammazione: pedaggi, segnali e percorsi verso la displasia broncopolmonare. 131-150.
- Atochina-Vasserman EN, Bates SR, Zhang P, et al: La disfunzione epiteliale alveolare precoce promuove l’infiammazione polmonare in un modello murino della sindrome di Hermansky-Pudlak. Am J Respir Crit Care Med 2011; 184(4): 449-458.
- Hilgendorff A, Parai K, Ertsey R, et al.: L’inibizione dell’attività dell’elastasi polmonare consente la crescita polmonare nei topi neonati ventilati meccanicamente. Am J Respir Crit Care Med 2011; 184(5): 537-546.
- Stoll BJ, Hansen N, Fanaroff AA, et al: Cambiamenti nei patogeni che causano la sepsi precoce nei neonati di peso molto basso alla nascita. N Engl J Med 2002; 347(4): 240-247.
- Olszak T, An D, Zeissig S, et al.: L’esposizione microbica durante la prima infanzia ha effetti persistenti sulla funzione delle cellule T natural killer. Science 2012; 336(6080): 489-493.
- Bose CL, Laughon MM, Allred EN, Investigatori ES, et al: Infiammazione sistemica associata alla ventilazione meccanica nei neonati estremamente pretermine. Citochina 2013; 61(1): 315-322.
- Jobe AH, Kallapur SG: Conseguenze a lungo termine dell’ossigenoterapia nel periodo neonatale. Semin Fetal Neonatal Med 2010; 15(4): 230-235.
- Kroon AA, Wang J, Huang Z, et al.: Risposta infiammatoria all’ossigeno e all’endotossina nei polmoni di ratto neonato ventilati con un basso volume tidalico. Pediatr Res 2010; 68(1): 63-69.
- Polglase GR, Hillman NH, Ball MK, et al: Infiammazione polmonare e sistemica negli agnelli pretermine sottoposti a pressione positiva continua delle vie aeree o a ventilazione convenzionale. Pediatr Res 2009; 65(1): 67-71.
- Kunzmann S, Speer CP, Jobe AH, Kramer BW: L’infiammazione prenatale induce il TGF-beta1 ma sopprime il CTGF nei polmoni pretermine. Am J Physiol Lung Cell Mol Physiol 2007; 292(1): L223-231.
- Kazzi SN, Kim UO, Quasney MW, Buhimschi I: Polimorfismo del fattore di necrosi tumorale-alfa e rischio e gravità della displasia broncopolmonare tra i neonati di peso molto basso alla nascita. Pediatria 2004; 114(2): e243-248.
- Nold MF, Mangan NE, Rudloff I, et al.: L’antagonista del recettore dell’interleuchina-1 previene la displasia broncopolmonare murina indotta dall’infiammazione perinatale e dall’iperossia. Proc Natl Acad Sci U S A 2013; 110(35): 14384-14389.
- Ibrahim JG, Stavros; Savani, Rashmin: La superstrada dell’infiammazione: segnali, pedaggi e percorsi della displasia broncopolmonare. In: Kallapur SP, Gloria, ed. Aggiornamenti sulla malattia polmonare cronica neonatale. Elsevier 2020; 131-150.
- Lechner AJ, Driver IH, Lee J, et al: I monociti reclutati e l’immunità di tipo 2 promuovono la rigenerazione polmonare dopo la pneumonectomia. Cell Stem Cell 2017; 21(1): 120-134 e127.
- McQuattie-Pimentel AC, Budinger GRS, Ballinger MN: Macrofagi alveolari derivati da monociti: il lato oscuro della riparazione polmonare? Am J Respir Cell Mol Biol 2018; 58(1): 5-6.
- Olin A, Henckel E, Chen Y, et al: Sviluppo stereotipato del sistema immunitario nei bambini appena nati. Cell 2018; 174(5): 1277-1292 e1214.
- Zaslona Z, Przybranowski S, Wilke C, et al: I macrofagi alveolari residenti sopprimono, mentre i monociti reclutati promuovono, l’infiammazione polmonare allergica nei modelli murini di asma. J Immunol 2014; 193(8): 4245-4253.
- Yamada M, Fujino N, Ichinose M: Risposte infiammatorie nell’avvio della riparazione e della rigenerazione polmonare: il loro ruolo nella stimolazione delle cellule staminali residenti nel polmone. Inflamm Regen 2016; 36: 15.
- Bose CL, Dammann CE, Laughon MM: Displasia broncopolmonare e biomarcatori infiammatori nel neonato prematuro. Arch Dis Child Fetal Neonatal Ed 2008; 93(6): F455-461.
- Rose MJ, Stenger MR, Joshi MS, et al.: L’ossido nitrico inalato diminuisce il traffico di leucociti nel polmone del topo neonatale durante l’esposizione a >95% di ossigeno. Pediatr Res 2010; 67(3): 244-249.
- Vento G, Tirone C, Lulli P, et al: La peptidomica del liquido di lavaggio broncoalveolare suggerisce un possibile ruolo della metalloproteinasi-3 di matrice nella displasia broncopolmonare. Intensive Care Med 2009; 35(12): 2115-2124.
- Watterberg KL, Carmichael DF, Gerdes JS, et al: Inibitore secretorio della proteasi leucocitaria e infiammazione polmonare nello sviluppo della displasia broncopolmonare. J Pediatr 1994; 125(2): 264-269.
- Weinberger B, Anwar M, Henien S, et al: Associazione della perossidazione lipidica con betametasone prenatale e disturbi radiali dell’ossigeno nei neonati pretermine. Biol Neonate 2004; 85(2): 121-127.
- Collard KJ, Godeck S, Holley JE, Quinn MW: Concentrazioni di antiossidanti polmonari e danno ossidativo nei neonati prematuri ventilati. Arch Dis Child Fetal Neonatal Ed 2004; 89(5): F412-416.
- Filippone M, Bonetto G, Corradi M, et al: Prove di stress ossidativo inatteso nelle vie aeree di adolescenti nati molto pretermine. Eur Respir J 2012; 40(5): 1253-1259.
- Hennessy EM, Bracewell MA, Wood N, Group EPS, et al: Salute respiratoria nei bambini in età prescolare e scolare dopo una nascita estremamente pretermine. Arch Dis Child 2008; 93(12): 1037-1043.
- Merritt TA, Deming DD, Boynton BR: La ‘nuova’ displasia broncopolmonare: sfide e commenti. Semin Fetal Neonatal Med 2009; 14(6): 345-357.
- Buczynski BW, Yee M, Paige Lawrence B, O’Reilly MA: Lo sviluppo polmonare e la risposta dell’ospite al virus dell’influenza A sono alterati da diverse dosi di ossigeno neonatale nei topi. Am J Physiol Lung Cell Mol Physiol 2012; 302(10): L1078-1087.
- Belik J, Jankov RP, Pan J, Tanswell AK: L’esposizione cronica all’O2 aumenta la contrazione della muscolatura liscia vascolare e delle vie aeree nel ratto neonato ma non in quello adulto. J Appl Physiol (1985) 2003; 94(6): 2303-2312.
- Yee M, White RJ, Awad HA, Bates WA, et al: L’iperossia neonatale causa una malattia vascolare polmonare e accorcia la durata della vita nei topi anziani. Am J Pathol 2011; 178(6): 2601-2610.
- Balasubramaniam V, Mervis CF, Maxey AM, et al: L’iperossia riduce le cellule progenitrici endoteliali midollari, circolanti e polmonari nel polmone in via di sviluppo: implicazioni per la patogenesi della displasia broncopolmonare. Am J Physiol Lung Cell Mol Physiol 2007; 292(5): L1073-1084.
- Londhe VA, Sundar IK, Lopez B, et al: L’iperossia compromette la formazione alveolare e induce la senescenza attraverso la diminuzione dell’attività dell’istone deacetilasi e l’up-regulation di p21 nel polmone di topo neonatale. Pediatr Res 2011; 69(5 Pt 1): 371-377.
- Nanduri J, Makarenko V, Reddy VD, et al: La regolazione epigenetica del rilevamento dell’ipossia disturba l’omeostasi cardiorespiratoria. Proc Natl Acad Sci U S A 2012; 109(7): 2515-2520.
- Jankov RP, Keith Tanswell A: Fattori di crescita, crescita polmonare postnatale e displasia broncopolmonare. Paediatr Respir Rev 2004; 5 Suppl A: S265-275.
- Alejandre-Alcazar MA, Kwapiszewska G, Reiss I, et al: L’iperossia modula la segnalazione TGF-beta/BMP in un modello murino di displasia broncopolmonare. Am J Physiol Lung Cell Mol Physiol 2007; 292(2): L537-549.
- Chao CM, Moiseenko A, Kosanovic D, et al: Impatto della carenza di Fgf10 sulla formazione dei vasi polmonari in un modello murino di displasia broncopolmonare. Hum Mol Genet 2019; 28(9): 1429-1444.
- Li C, Smith SM, Peinado N, et al: La segnalazione WNT5a-ROR è essenziale per l’alveologenesi. Cellule 2020; 9(2).
- Oak P, Hilgendorff A: Il trio BPD? Interazione della segnalazione disregolata di PDGF, VEGF e TGF nella malattia polmonare cronica neonatale. Mol Cell Pediatr 2017; 4(1): 11.
- Sucre JM, Wilkinson D, Vijayaraj P, et al: Un modello umano tridimensionale dell’attivazione dei fibroblasti che accompagna la displasia broncopolmonare identifica la fisiopatologia mediata da Notch. Am J Physiol Lung Cell Mol Physiol 2016; 310(10): L889-898.
- Sucre JMS, Deutsch GH, Jetter CS, et al: Un modello condiviso di attivazione della beta-catenina nella displasia broncopolmonare e nella fibrosi polmonare idiopatica. Am J Pathol 2018; 188(4): 853-862.
- Iosef C, Alastalo TP, Hou Y, et al.: L’inibizione di NF-kappaB nel polmone in via di sviluppo interrompe l’angiogenesi e l’alveolarizzazione. Am J Physiol Lung Cell Mol Physiol 2012; 302(10): L1023-1036.
- Didon L, Roos AB, Elmberger GP, et al: L’inattivazione polmonare specifica della proteina CCAAT/enhancer binding protein alpha causa un modello patologico caratteristico della BPCO. Eur Respir J 2010; 35(1): 186-197.
- Alvira CM, Abate A, Yang G, et al.: L’attivazione del fattore nucleare-kappaB nel polmone di topo neonatale protegge dall’infiammazione indotta dal lipopolisaccaride. Am J Respir Crit Care Med 2007; 175(8): 805-815.
- Yang G, Abate A, George AG, et al: Differenze maturative nell’attivazione dell’NF-kappaB polmonare e il loro ruolo nella tolleranza all’iperossia. J Clin Invest 2004; 114(5): 669-678.
- De Paepe ME, Greco D, Mao Q: Profilazione dell’espressione genica legata all’angiogenesi nei polmoni umani pretermine ventilati. Exp Lung Res 2010; 36(7): 399-410.
- De Paepe ME, Mao Q, Powell J, et al: Crescita della microvasculatura polmonare nei neonati pretermine ventilati. Am J Respir Crit Care Med 2006; 173(2): 204-211.
- Thebaud B: Angiogenesi nello sviluppo, nella lesione e nella riparazione del polmone: implicazioni per la malattia polmonare cronica della prematurità. Neonatologia 2007; 91(4): 291-297.
- Ito Y, Betsuyaku T, Nagai K, et al.: L’espressione della famiglia VEGF polmonare diminuisce con l’età e viene ulteriormente ridotta nelle lesioni polmonari indotte dal lipopolisaccaride (LPS). Exp Gerontol 2005; 40(4): 315-323.
- Vyas-Read S, Shaul PW, Yuhanna IS, Willis BC: L’ossido nitrico attenua la transizione epitelio-mesenchimale nelle cellule epiteliali alveolari. Am J Physiol Lung Cell Mol Physiol 2007; 293(1): L212-221.
- Bland RD, Ling CY, Albertine KH, et al: Disfunzione vascolare polmonare negli agnelli pretermine con malattia polmonare cronica. Am J Physiol Lung Cell Mol Physiol 2003; 285(1): L76-85.
- Kamba T, Tam BY, Hashizume H, Haskell A, et al: Plasticità VEGF-dipendente dei capillari fenestrati nella microvasculatura adulta normale. Am J Physiol Heart Circ Physiol 2006; 290(2): H560-576.
- Kinsella JP, Greenough A, Abman SH: Displasia broncopolmonare. Lancet 2006; 367(9520): 1421-1431.
- Steinhorn RH: Ipertensione polmonare neonatale. Pediatr Crit Care Med 2010; 11(2 Suppl): S79-84.
- Torday JS, Rehan VK: La meccanotrasduzione determina la struttura e la funzione del polmone e dell’osso: un modello teorico per la fisiopatologia delle malattie croniche. Cell Biochem Biophys 2003; 37(3): 235-246.
- Mizikova I, Morty RE: La matrice extracellulare nella displasia broncopolmonare: bersaglio e fonte. Front Med (Losanna) 2015; 2: 91.
- Bruce MC, Schuyler M, Martin RJ, et al: Fattori di rischio per la degradazione delle fibre elastiche polmonari nel neonato ventilato. Implicazioni per l’alterazione dello sviluppo polmonare nella displasia broncopolmonare. Am Rev Respir Dis 1992; 146(1): 204-212.
- Bruce MC, Wedig KE, Jentoft N, et al.: Alterata escrezione urinaria di legami incrociati di elastina nei neonati prematuri che sviluppano displasia broncopolmonare. Am Rev Respir Dis 1985; 131(4): 568-572.
- Merritt TA, Cochrane CG, Holcomb K, et al.: Attività dell’elastasi e dell’inibitore dell’alfa 1-proteinasi negli aspirati tracheali durante la sindrome da distress respiratorio. Ruolo dell’infiammazione nella patogenesi della displasia broncopolmonare. J Clin Invest 1983; 72(2): 656-666.
- Tenholder MF, Rajagopal KR, Phillips YY, et al: L’escrezione urinaria di desmosina come marcatore del danno polmonare nella sindrome da distress respiratorio dell’adulto. Chest 1991; 100(5): 1385-1390.
- Lukkarinen H, Hogmalm A, Lappalainen U, Bry K: La carenza di metalloproteinasi-9 di matrice peggiora il danno polmonare in un modello di displasia broncopolmonare. Am J Respir Cell Mol Biol 2009; 41(1): 59-68.
- Pierce RA, Albertine KH, Starcher BC, et al.: Lesione polmonare cronica negli agnelli pretermine: deposizione disordinata di elastina polmonare. Am J Physiol 1997; 272(3 Pt 1): L452-460.
- Thibeault DW, Mabry SM, Ekekezie, II, Truog WE: Maturazione e perturbazioni del tessuto elastico polmonare durante l’evoluzione della malattia polmonare cronica. Pediatria 2000; 106(6): 1452-1459.
- Thibeault DW, Mabry SM, et al: L’impalcatura di collagene durante lo sviluppo e la sua deformazione con la malattia polmonare cronica. Pediatria 2003; 111(4 Pt 1): 766-776.
- Bonvillain RW, Danchuk S, Sullivan DE, et al.: Un modello di primate non umano di rigenerazione polmonare: decellularizzazione mediata da detergenti e ricellularizzazione iniziale in vitro con cellule staminali mesenchimali. Tissue Eng Part A 2012; 18(23-24): 2437-2452.
- Jensen T, Roszell B, Zang F, et al.: Un protocollo di de-cellularizzazione polmonare rapido supporta la differenziazione delle cellule staminali embrionali in vitro e dopo l’impianto. Tissue Eng Part C Methods 2012; 18(8): 632-646.
- Förster K, Ertl-Wagner B, Ehrhardt H, et al.: Tempi di rilassamento alterati nella risonanza magnetica indicano una displasia broncopolmonare. Thorax 2019; thoraxjnl-2018-212384.
- Oda K, Ishimoto H, Yatera K, et al: La scala di classificazione basata sul sistema di punteggio della TAC ad alta risoluzione predice gli esiti clinici nei pazienti con fibrosi polmonare idiopatica. Respir Res 2014; 15: 10.
- Walkup LL, Tkach JA, Higano NS, et al: Risonanza magnetica quantitativa della displasia broncopolmonare nell’ambiente dell’unità di terapia intensiva neonatale. Am J Respir Crit Care Med 2015; 192(10): 1215-1222.
- Washko GR: Diagnostica per immagini nella BPCO. Semin Respir Crit Care Med 2010; 31(3): 276-285.
- Weatherley ND, Eaden JA, Stewart NJ, et al: Tecniche di imaging sperimentale e quantitativo nella malattia polmonare interstiziale. Thorax 2019; 74(6): 611-619.
- Capaldi DP, Zha N, Guo F, et al: Biomarcatori di imaging polmonare dell’intrappolamento di gas e dell’enfisema nella BPCO: (3)He MR Imaging e mappe di risposta parametrica TC. Radiologia 2016; 279(2): 597-608.
- De Boeck K, Derichs N, Fajac I, Gruppo EDNW, EuroCare CFWPGoCFd, et al: Nuove procedure diagnostiche cliniche per la fibrosi cistica in Europa. J Cyst Fibros 2011; 10 Suppl 2: S53-66.
- Sileo C, Corvol H, Boelle PY, et al: HRCT e RM del polmone nei bambini con fibrosi cistica: confronto tra diversi sistemi di punteggio. J Cyst Fibros 2014; 13(2): 198-204.
- Tulek B, Kivrak AS, Ozbek S, et al: Fenotipizzazione della broncopneumopatia cronica ostruttiva utilizzando il sistema di punteggio Bhalla modificato per la tomografia computerizzata ad alta risoluzione. Can Respir J 2013; 20(2): 91-96.
- Jobe AH, Ikegami M: Prevenzione della displasia broncopolmonare. Curr Opin Pediatr 2001; 13(2): 124-129.
- Newman JB, DeBastos AG, Batton D, Raz S: Disfunzione respiratoria neonatale e prestazioni neuropsicologiche in età prescolare: uno studio su neonati molto prematuri con displasia broncopolmonare. Neuropsicologia 2011; 25(5): 666-678.
- Bolton CE, Bush A: In arrivo in una clinica toracica vicino a lei. Thorax 2013; 68(8): 707-708.
- Bolton CE, Bush A, Hurst JR, et al: Conseguenze polmonari negli adulti nati prematuramente. Thorax 2015; 70(6): 574-580.
- May C, Kennedy C, Milner AD, et al: Anomalie della funzione polmonare nei neonati che sviluppano displasia broncopolmonare. Arch Dis Child 2011; 96(11): 1014-1019.
- Miller MR, Pedersen OF, Lange P, Vestbo J: Miglioramento della previsione di sopravvivenza dai dati di funzionalità polmonare in un ampio campione di popolazione. Respir Med 2009; 103(3): 442-448.
- Hilgendorff A, Reiss I, Gortner L, et al: Impatto dell’ostruzione delle vie aeree sulla funzione polmonare nei neonati molto pretermine a termine. Pediatr Crit Care Med 2008; 9(6): 629-635.
- Greenough A, Alexander J, Burgess S, et al: Utilizzo dell’assistenza sanitaria in età prescolare in relazione allo stato dell’ossigeno a casa. Arch Dis Child Fetal Neonatal Ed 2006; 91(5): F337-341.
- Greenough A, Alexander J, Burgess S, et al: Stato dell’ossigeno a domicilio e requisiti di riospedalizzazione e assistenza primaria dei neonati con malattia polmonare cronica. Arch Dis Child 2002; 86(1): 40-43.
- Doyle LW, Cheung MM, Ford GW, et al: Peso alla nascita <1501 g e salute respiratoria a 14 anni. Arch Dis Child 2001; 84(1): 40-44.
- Greenough A, Cox S, Alexander J, et al: Utilizzo dell’assistenza sanitaria dei neonati con malattia polmonare cronica, in relazione all’ospedalizzazione per infezione da RSV. Arch Dis Child 2001; 85(6): 463-468.
- Broughton S, Roberts A, Fox G, et al: Studio prospettico sull’utilizzo dell’assistenza sanitaria e sulla morbilità respiratoria dovuta all’infezione da RSV nei neonati nati prematuri. Thorax 2005; 60(12): 1039-1044.
- Baraldi E, Carraro S, Filippone M: Displasia broncopolmonare: definizioni ed esito respiratorio a lungo termine. Early Hum Dev 2009; 85(10 Suppl): 1-3.
- Greenough A, Limb E, Marston L, et al: Fattori di rischio per la morbilità respiratoria nella prima infanzia dopo una nascita molto prematura. Arch Dis Child Fetal Neonatal Ed 2005; 90(4): F320-323.
- Gross SJ, Iannuzzi DM, Kveselis DA, Anbar RD: Effetto della nascita pretermine sulla funzione polmonare in età scolare: uno studio prospettico controllato. J Pediatr 1998; 133(2): 188-192.
- Broughton S, Thomas MR, Marston L, et al: Neonati nati molto prematuri che soffrono di wheezing al follow-up: funzione polmonare e fattori di rischio. Arch Dis Child 2007; 92(9): 776-780.
- Pelkonen AS, Hakulinen AL, Turpeinen M: Labilità e reattività bronchiale nei bambini nati molto pretermine. Am J Respir Crit Care Med 1997; 156(4 Pt 1): 1178-1184.
- Yuksel B, Greenough A: Relazione tra i sintomi e le anomalie della funzione polmonare nei neonati pretermine al follow-up. Pediatr Pulmonol 1991; 11(3): 202-206.
- Welsh L, Kirkby J, Lum S, Odendaal D, Group EPS, et al: Lo studio EPICure: esercizio massimo e attività fisica nei bambini nati estremamente pretermine. Thorax 2010; 65(2): 165-172.
- Doyle LW, Faber B, Callanan C, et al: Displasia broncopolmonare in soggetti di peso molto basso alla nascita e funzione polmonare nella tarda adolescenza. Pediatria 2006; 118(1): 108-113.
- Greenough A, Dimitriou G, Bhat RY, et al: Volumi polmonari nei neonati con displasia broncopolmonare da lieve a moderata. Eur J Pediatr 2005; 164(9): 583-586.
- Hjalmarson O, Sandberg KL: La funzione polmonare a termine riflette la gravità della displasia broncopolmonare. J Pediatr 2005; 146(1): 86-90.
- Hurst JR, Beckmann J, Ni Y, et al: Esiti respiratori e cardiovascolari nei sopravvissuti a una nascita estremamente pretermine a 19 anni. Am J Respir Crit Care Med 2020; 202(3): 422-432.
- Northway WH, Jr, Moss RB, Carlisle KB, et al: Sequele polmonari tardive della displasia broncopolmonare. N Engl J Med 1990; 323(26): 1793-1799.
- Vollsaeter M, Roksund OD, Eide GE, et al: Funzione polmonare dopo la nascita pretermine: sviluppo dalla metà dell’infanzia all’età adulta. Thorax 2013; 68(8): 767-776.
- Bolton CE, Bush A, Hurst JR, et al: I fattori della vita precoce sono considerati nella gestione delle malattie respiratorie? Un sondaggio della British Thoracic Society sulla pratica attuale. Thorax 2012; 67(12): 1110.
- Crump C: L’anamnesi medica negli adulti dovrebbe includere domande sulla nascita pretermine. BMJ 2014; 349: g4860.
- Baraldi E, Filippone M: Malattia polmonare cronica dopo una nascita prematura. N Engl J Med 2007; 357(19): 1946-1955.
- Filippone M, Carraro S, Baraldi E: Dalla BPD alla BPCO? L’ipotesi è intrigante, ma mancano dati di patologia polmonare negli esseri umani. Eur Respir J 2010; 35(6): 1419-1420; risposta dell’autore 1420.
- Anderson PJ, Doyle LW: Esito neurosviluppo della displasia broncopolmonare. Semin Perinatol 2006; 30(4): 227-232.
- Bal MP, de Vries WB, van Oosterhout MF, et al.: Effetti cardiovascolari a lungo termine del trattamento neonatale con desametasone: follow-up emodinamico mediante loop pressione-volume del ventricolo sinistro nei ratti. J Appl Physiol (1985) 2008; 104(2): 446-450.
- Kamphuis PJ, de Vries WB, Bakker JM, et al: Ridotta aspettativa di vita nei ratti dopo il trattamento neonatale con desametasone. Pediatr Res 2007; 61(1): 72-76.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2021; 3(2): 10-15