L’1% di tutte le donne è colpito da insufficienza ovarica prematura. La causa esatta è spesso sconosciuta.
Il termine insufficienza ovarica prematura (POI) si riferisce alla perdita prematura della funzione ovarica prima dei 40 anni, con la consecutiva comparsa combinata di ipogonadismo ipergonadotropo e amenorrea primaria/secondaria.
Si presume che la prevalenza della POI sia dell’1% della popolazione femminile prima dei 40 anni e dello 0,1% prima dei 30 anni. La menopausa tra i 40 e i 44 anni è chiamata “menopausa precoce” e ha una prevalenza del 5%. La menopausa a partire dai 45 anni è considerata regolare [1].
Diagnosi
La POI è presente quando sono presenti i seguenti criteri diagnostici:
- Amenorrea primaria o secondaria ≥4 mesi
- Età <40 anni di vita
- FSH ≥25 U/l, due misurazioni a un intervallo di >4 settimane.
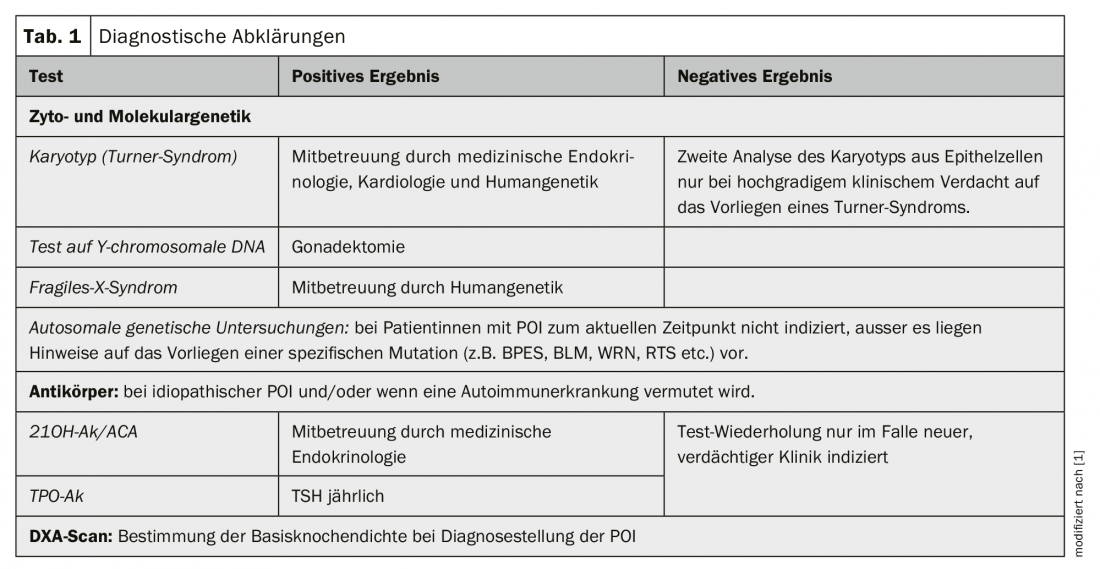
La Tabella 1 offre una panoramica dei chiarimenti diagnostici.
Eziologia
POI idiopatica: nella grande maggioranza di tutte le POI (85-90%), non è possibile identificare una causa precisa. Si tratta della cosiddetta POI idiopatica [1].
POI causata geneticamente: le anomalie cromosomiche sono rilevabili nel 10-13% di tutti i pazienti con POI. La maggior parte (94%) sono aberrazioni numeriche e/o strutturali del cromosoma X (ad esempio, la sindrome di Turner) [1]. Nei casi di disgenesia gonadica con DNA cromosomico Y rilevabile, si raccomanda la gonadectomia profilattica a causa del rischio significativamente aumentato (45%) di sviluppare una neoplasia gonadica durante il decorso della malattia [2]. La cariotipia deve essere eseguita in tutte le donne con POI non iatrogena [1].
La sindrome X fragile (sindrome di Martin Bell) è la causa più comune di ritardo mentale ereditario. Questo disturbo dominante legato all’X, con penetranza ridotta nel sesso femminile, è causato da una mutazione nel gene FMR1 (“fragile-X-ritardo mentale 1”) sul braccio lungo del cromosoma X. In presenza di una premutazione, c’è un rischio del 13-26% di sviluppare la POI nelle femmine, ma non così in presenza di una mutazione completa. Nei pazienti con POI sporadica, ci si aspetta una prevalenza di una pre-mutazione FraX dello 0,8-7,5%, nei pazienti con un’anamnesi familiare positiva per POI addirittura fino al 13% [3]. L’esclusione genetica di una pre-mutazione FraX è indicata in tutti i pazienti con POI [1].
POI causata da autoimmunologia: in circa il 5% di tutte le madrine con POI, il quadro clinico è causato da un danno autoimmunologico all’ovaio. Nella maggior parte delle PDI autoimmuni, oltre all’ovaio sono coinvolti nel processo autoimmune anche altri organi, come parte di una sindrome autoimmune poligandolare di tipo 1/2. L’autoimmunità diretta contro la corteccia surrenale si riscontra nel 60-80% e contro la ghiandola tiroidea nel 14-27%. La biopsia ovarica per la diagnosi di POI autoimmunologica è considerata obsoleta. Il rilevamento sierologico dei cosiddetti SCA (anticorpi delle cellule steroidee), come ad es. Il 21OH-Ak (21-idrossilasi-Ak) o in alternativa ACA/NNR-Ak (adrenocortical Ak/adrenal cortical Ak), che sono tutti diretti contro gli enzimi coinvolti nella sintesi degli ormoni steroidei e quindi potenzialmente contro la corteccia surrenale, l’ovaio, i testicoli e la placenta, è il marcatore con la più alta sensibilità diagnostica per una PDI di origine autoimmunologica. Di conseguenza, lo screening per 21OH-Ak o in alternativa ACA/NNR-Ak deve essere offerto a tutti i pazienti con POI idiopatica. Inoltre, lo screening della tiroide A (TPO A) è indicato in tutti i pazienti con POI idiopatica [1].
POI come conseguenza di interventi iatrogeni (chemioterapia, radioterapia, chirurgia): Le chemioterapie citotossiche hanno un grado variabile di effetto gonadotossico a seconda del principio attivo utilizzato, della dose cumulativa e dell’età del paziente, che a sua volta è associato a un aumento del rischio di sviluppare POI.
Allo stesso modo, a seconda della dose di radiazioni, del campo di irradiazione e dell’età della paziente, la radioterapia compromette la funzione ovarica fino alla POI.
Gli interventi chirurgici nell’area delle ovaie, come l’asportazione di endometriomi nell’endometriosi, comportano anche un’età menopausale significativamente più bassa, nonché un aumento del rischio di POI [4,5] a causa della perdita associata di tessuto ovarico sano con una conseguente riduzione della riserva ovarica.
Conseguenze a breve termine del POI
Come per la menopausa normale, l’intensità dei sintomi legati alla carenza di estrogeni varia con la POI. La gamma si estende da pazienti completamente asintomatiche che si presentano solo per chiarire l’amenorrea a pazienti che soffrono notevolmente. I sintomi tipici della menopausa includono disturbi vasomotori nel senso di vampate di calore e di sudorazione, disturbi del sonno, stanchezza fisica e mentale, atrofia urogenitale con disturbi nel senso di vescica iperattiva, incontinenza da sforzo, secchezza vaginale con dispareunia consecutiva, infezioni ricorrenti del tratto urinario, problemi sessuali con mancanza di libido e cambiamenti nella soddisfazione sessuale, disturbi articolari e muscolari diffusi e umore depresso. A seconda dei sintomi, si ricorre alla sostituzione sistemica e, se necessario, locale additiva degli estrogeni. Tuttavia, anche le pazienti POI asintomatiche necessitano di una TOS sistemica costante per prevenire le conseguenze negative a lungo termine della carenza prematura di estrogeni sulla salute cardiovascolare, sul metabolismo osseo e sulla funzione cognitiva [6].
Effetti a lungo termine del POI
Salute cardiovascolare: a causa della perdita prematura dell’effetto estrogenico cardioprotettivo, le pazienti con POI hanno un rischio significativamente aumentato di malattie cardiovascolari e di mortalità cardiovascolare [7]. Si raccomanda di iniziare la sostituzione con steroidi sessuali il più presto possibile e di continuarla fino all’età media della menopausa regolare di 52 anni, per contrastare al meglio l’aumento del rischio cardiovascolare [1].
Salute delle ossa: è nota l’influenza benefica degli estrogeni sulla regolazione del metabolismo osseo e sul mantenimento della struttura ossea, così come le conseguenze negative della menopausa naturale sulla densità ossea e sul rischio di fratture. È stato dimostrato che la POI è associata a una riduzione della densità ossea dovuta alla carenza di estrogeni. Questo ci permette di concludere che la POI è consecutivamente associata a un aumento del rischio di frattura, anche se questa ipotesi non può ancora essere sufficientemente comprovata da studi al momento attuale [8]. Quando si diagnostica la POI, si raccomanda di eseguire una scansione DXA per determinare la densità ossea di base. Nel caso di una densità ossea normale in base all’età e dell’inizio di una TOS sufficientemente dosata, non è necessaria una ripetizione della scansione DXA [1].
La terapia estrogenica sostitutiva è il trattamento di scelta sia per la prevenzione che per il trattamento dell’osteoporosi nelle pazienti con POI. Di conseguenza, si raccomanda l’inizio più precoce possibile della TOS e la sua continuazione fino all’età fisiologica media della menopausa [6].
Fertilità, gravidanza e rischi ostetrici: la TOS non è contraccettiva e pertanto può/deve essere raccomandata a tutte le pazienti che desiderano avere figli. Un regime sequenziale è da preferire in caso di parto positivo. Al contrario, le pazienti per le quali la gravidanza non è un’opzione richiedono un anticoncezionale sicuro [1].
A causa della riacutizzazione intermittente dell’attività ovarica, soprattutto all’inizio, la possibilità di una gravidanza spontanea nella POI non può essere completamente esclusa, anche se è molto ridotta. La possibilità di concepimento spontaneo diminuisce naturalmente con la durata dell’amenorrea. Una revisione sistematica sulla fertilità e sugli esiti della gravidanza nella POI ha rilevato una probabilità di concepimento spontaneo del 5-10%. L’80% di queste gravidanze è sfociato in un parto vivo, mentre nel 20% c’è stato un aborto – cifre che non sono diverse da quelle delle donne normalmente fertili [9].
Al momento non sono noti interventi riproduttivi che migliorino in modo affidabile l’attività ovarica e di conseguenza il tasso di concepimento spontaneo nella POI. Non è prevedibile una risposta ovarica alla stimolazione con gonadodropine e/o all’induzione dell’ovulazione, a causa della riserva ovocitaria esaurita con gonadotropine consecutive già elevate a livello endogeno. Una volta fatta la diagnosi di PDI, di conseguenza è venuta meno anche l’opzione di protezione della fertilità. La donazione di ovociti è un’opzione realistica e consolidata per le pazienti con POI per ottenere comunque una gravidanza [1].
Salute neurologica: diversi studi osservazionali di grandi dimensioni hanno rilevato un aumento del rischio di declino della funzione cognitiva o di sviluppo di demenza nei pazienti con POI. Il rischio di deterioramento cognitivo aumentava quanto più giovane era il paziente al momento della diagnosi. Nei pazienti che hanno ricevuto la terapia estrogenica sostitutiva fino all’età di 50 anni, non è stato riscontrato né un deterioramento mentale né un aumento del rischio di demenza [10, 11]. Di conseguenza, per ridurre il rischio di un potenziale deterioramento cognitivo legato alla carenza ormonale nei pazienti con POI, la TOS dovrebbe essere somministrata almeno fino all’età media della menopausa normale [1].
Funzione sessuale e urogenitale: un’adeguata terapia estrogenica sostitutiva sistemica fornisce la base per una normale funzione sessuale e urogenitale. Se questo non è sufficiente, si possono utilizzare estrogeni locali come additivo. Mancano dati sull’efficacia e sulla sicurezza a lungo termine per quanto riguarda l’integrazione aggiuntiva opzionale di androgeni [1].
Qualità di vita: la diagnosi di POI ha un impatto negativo significativo sul benessere psicologico e sulla qualità di vita della persona colpita. Questo aspetto deve essere affrontato nei colloqui e deve essere offerto un supporto psicologico.
Terapia ormonale sostitutiva
La TOS per la POI non è indicata solo per alleviare i sintomi legati alla carenza di estrogeni, come i disturbi vasomotori, ma anche per motivi profilattici. Almeno la TOS a dosaggio standard dovrebbe essere raccomandata alle pazienti con POI per la prevenzione primaria della malattia cardiovascolare e per la protezione ossea e neurologica, fino al raggiungimento dell’età fisiologica media della menopausa [1].
Principio attivo: da un lato, vengono utilizzate le classiche TOS (estrogeni: estradiolo) e dall’altro i contraccettivi orali combinati (estrogeni: etinilestradiolo). Sia i progestinici sintetici che il progesterone micronizzato “bioidentico”, ciascuno in dosi di trasformazione, possono essere utilizzati per la protezione dell’endometrio.
Regime: per evitare il più possibile i sintomi da carenza di estrogeni, si raccomanda una terapia estrogenica sostitutiva continua. La stragrande maggioranza dei preparati HRT approvati soddisfano questo requisito, ma non la maggior parte degli anticoncezionali ormonali approvati. Non è raro che le donne con POI che assumono anticoncezionali orali combinati nel regime 21/7 siano sintomatiche nell’intervallo senza pillola. Di conseguenza, se c’è la necessità di un’azione anticoncezionale, è consigliabile prescrivere le pillole nel regime 24/4 o 26/2 o nel ciclo lungo.
Si pone ora la questione se la somministrazione additiva di progestinici sia migliore in modo continuo o ciclico. In linea di principio, si possono utilizzare entrambi i regimi di TOS, a seconda delle preferenze della paziente. Come conseguenza dell’attività ovarica, che spesso si manifesta in modo intermittente, soprattutto all’inizio, possono verificarsi sanguinamenti vaginali imprevedibili e ripetuti con un regime combinato continuo. A causa del sanguinamento da sospensione ormonale regolato quando si utilizza un regime sequenziale, tale regime è spesso preferito dalle pazienti, almeno inizialmente. Allo stesso modo, nelle donne con un desiderio positivo di avere figli, poiché un regime sequenziale imita al meglio il ciclo endometriale regolare, con un’alternanza ciclica di fasi di proliferazione e secrezione. Il desiderio di amenorrea viene soddisfatto con il regime combinato continuo, che è superiore al regime sequenziale in termini di sicurezza endometriale [1].
Forma di dosaggio: I dati sulla TOS nelle donne in menopausa tempestiva mostrano che gli estrogeni orali aumentano significativamente il rischio di TEV. Questo è il vantaggio della terapia estrogenica transdermica, che non influisce su questo rischio [17]. A differenza della forma di somministrazione orale, l’applicazione transdermica dell’estradiolo può aggirare l’effetto di primo passaggio nel fegato e, di conseguenza, prevenire lo spostamento dell’equilibrio emostasiologico verso la procoagulazione. Sebbene manchino dati sulla POI, la somministrazione transdermica di estrogeni è preferibile nei pazienti a maggior rischio di TEV [1].
Cancro al seno – il rischio più temuto: secondo i dati attuali, le pazienti con POI hanno addirittura un rischio significativamente inferiore di cancro al seno rispetto al gruppo di controllo. Questo è molto probabilmente dovuto alla carenza prematura di steroidi sessuali che accompagna inevitabilmente la POI. Le donne con POI devono essere rassicurate sul fatto che, secondo i dati attuali, la TOS prima dell’età normale/fisiologica della menopausa non aumenta il rischio di cancro al seno rispetto alla popolazione normale. Il fatto che la TOS applicata alle pazienti dopo i 50 anni aumenti significativamente il rischio di cancro al seno, a seconda della durata della terapia, non deve essere estrapolato alle pazienti con POI [1,6].
Messaggi da portare a casa
- L’insufficienza ovarica prematura richiede una diagnosi completa: anamnesi (chemioterapia, radioterapia, operazioni), chiarimento delle cause genetiche, esclusione di una sindrome autoimmune poligandolare.
- Quando viene fatta una diagnosi, si raccomanda di eseguire una scansione DXA per determinare la densità ossea basale.
- Mancano approcci terapeutici causali.
- La terapia ormonale sostitutiva (TOS) è indicata fino al raggiungimento dell’età media della menopausa regolare, per contrastare le conseguenze negative a lungo termine della carenza di estrogeni sulla salute delle ossa, sul sistema cardiovascolare e sulla funzione cognitiva.
Letteratura:
- European Society for Human Reproduction and Embyology (ESHRE) Guideline Group on POI, et al: Linea guida ESHRE: gestione delle donne con insufficienza ovarica prematura. Hum Reprod 2016; 31(5): 926-937.
- Michala L, et al: Sindrome di Swyer: presentazione ed esiti. BJOG 2008; 115(6): 737-741.
- Wittenberger MD, et al: La premutazione FMR1 e la riproduzione. Fertil Steril 2007; 87(3): 456-465.
- Raffi F, Metwally M, Amer S: L’impatto dell’escissione dell’endometrioma ovarico sulla riserva ovarica: una revisione sistematica e una meta-analisi. J Clin Endocrinol Metab 2012; 97(9): 3146-3154.
- Coccia ME, et al: La chirurgia ovarica per gli endometriomi bilaterali influenza l’età della menopausa. Hum Reprod 2011; 26(11): 3000-3007.
- Hamoda H: British Menopause Society e Women’s Health Concern: Le raccomandazioni della British Menopause Society e della Women’s Health Concern sulla gestione delle donne con insufficienza ovarica prematura. Post Reprod Health 2017; 23(1): 22-35.
- Roeters van Lennep JE, et al: Rischio di malattie cardiovascolari nelle donne con insufficienza ovarica prematura: revisione sistematica e meta-analisi. Eur J Prev Cardiol 2016; 23(2): 178-186.
- Kanis JA, et al: Una revisione sistematica delle soglie di intervento basate su FRAX: un rapporto preparato per il National Osteoporosis Guideline Group e la International Osteoporosis Foundation. Arch Osteoporos 2016; 11(1): 25.
- van Kasteren YM, Schoemaker J: Insufficienza ovarica prematura: una revisione sistematica sugli interventi terapeutici per ripristinare la funzione ovarica e ottenere una gravidanza. Hum Reprod Update 1999; 5(5): 483-492.
- Rocca WA, et al.: Aumento del rischio di deterioramento cognitivo o demenza nelle donne che hanno subito l’ooforectomia prima della menopausa. Neurologia 2007; 69(11): 1074-1083.
- Phung TK, et al: Isterectomia, ooforectomia e rischio di demenza: uno studio di coorte storico a livello nazionale. Dement Geriatr Cogn Disord 2010; 30(1): 43-50.
- Langrish JP, et al: Effetti cardiovascolari dei regimi di sostituzione degli steroidi sessuali fisiologici e standard nell’insufficienza ovarica prematura. Ipertensione 2009; 53(5): 805-811.
- Crofton PM, et al: Sostituzione fisiologica rispetto alla sostituzione standard di steroidi sessuali in giovani donne con insufficienza ovarica prematura: effetti sull’acquisizione di massa ossea e sul turnover. Clin Endocrinol (Oxf) 2010; 73(6): 707-714.
- Cartwright B, et al: Terapia ormonale sostitutiva rispetto alla pillola contraccettiva orale combinata nell’insufficienza ovarica prematura: uno studio controllato randomizzato sugli effetti della densità minerale ossea. J Clin Endocrinol Metab 2016; 101(9): 3497-3505.
- Mueck AO: Terapia ormonale sostitutiva in postmenopausa e malattie cardiovascolari: il valore dell’estradiolo transdermico e del progesterone micronizzato. Climacteric 2012; 15(Suppl 1): 11-17.
- Davey DA: TOS: alcune questioni cliniche irrisolte nel cancro al seno, nel cancro endometriale e nell’insufficienza ovarica prematura. Womens Health (Lond) 2013; 9(1): 59-67.
- Canonico M, et al: Terapia ormonale sostitutiva e rischio di tromboembolismo venoso nelle donne in postmenopausa: revisione sistematica e meta-analisi. BMJ 2008; 336(7655): 1227-1231.
PRATICA GP 2019; 14(5): 9-12