L’epatite autoimmune (AIH) è una malattia epatica cronica e progressiva, caratterizzata dal quadro istologico dell’epatite di interfaccia, dall’ipergammaglobulinemia e dagli autoanticorpi circolanti. L’AIH si verifica in tutti i gruppi di età e colpisce più spesso le donne che gli uomini (rapporto 3:1). Lo spettro dell’AIH va dalla malattia asintomatica all’epatite acuta o addirittura fulminante, fino all’insufficienza epatica. I corticosteroidi vengono utilizzati per indurre la remissione. Nella terapia di mantenimento, è preferibile l’azatioprina per ridurre il rischio di recidiva per almeno due, preferibilmente quattro anni.
L’epatite autoimmune (AIH) rappresenta l’11-23% di tutte le epatopatie croniche. L’incidenza può essere sottostimata perché l’epatite virale è comune e quando è presente un’epatite virale cronica, qualsiasi epatite autoimmune concomitante può passare inosservata. L’incidenza annuale nei caucasici è di 0,1-1,9/100.000 e la prevalenza è di 16,9/100.000 [1]. L’AIH è responsabile del 2,6% dei trapianti di fegato in Europa [2] e del 4-6% dei trapianti di fegato negli Stati Uniti [3]. Le donne sono colpite circa tre volte più spesso. Fondamentalmente, la malattia si manifesta in tutte le fasce d’età, ma nel 50% dei casi inizia prima dei 30 anni.
Patogenesi
L’esatta patogenesi dell’AIH rimane poco chiara. Il quadro clinico riflette una complessa interazione tra predisposizione genetica, fattori scatenanti, autoantigeni e meccanismi immunoregolatori, che alla fine porta a un processo immunologico (cellulo-mediato, anticorpo-mediato o in combinazione) contro gli epatociti con lo sviluppo di un’infiammazione cronica che porta alla cirrosi. I fattori scatenanti esatti sono sconosciuti; sono possibili agenti infettivi, medicinali e tossici. Il mimetismo molecolare di antigeni estranei e self è la spiegazione più comune della perdita di auto-tolleranza [4].
Clinica
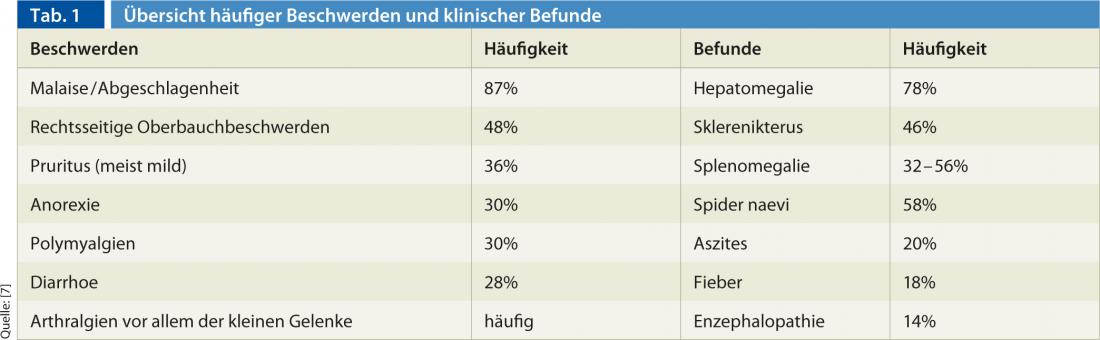
L’AIH ha un aspetto molto eterogeneo e fluttuante. La diagnosi è spesso ritardata perché spesso sono presenti solo sintomi lievi e non specifici di un’epatite acuta e autolimitante. La Tabella 1 offre una panoramica dei disturbi e dei risultati clinici tipici [5].
Esistono diverse forme di manifestazione, che vengono brevemente illustrate di seguito:
- Asintomatico: la diagnosi viene fatta sulla base di un riscontro incidentale di enzimi epatici elevati in pazienti asintomatici.
- Epatite acuta: esordio acuto in circa il 40% dei casi. Un’anamnesi dettagliata spesso rivela sintomi aspecifici precedenti, come episodi di malessere, nausea e artralgia.
- Insufficienza epatica acuta: in casi rari, presentazione iniziale come epatite fulminante (5%) o scompenso epatico (“malattia bruciata”) con ascite (20%), encefalopatia epatica (14%) e varici esofagee sanguinanti (8%).
- Cirrosi epatica: fino al 30% delle diagnosi iniziali come cirrosi epatica o con le relative complicazioni.Una caratteristica tipica dell’AIH è la sua associazione con sindromi immuno-mediate extraepatiche, come tiroidite autoimmune, vitiligine, alopecia, colite ulcerosa, artrite reumatoide, diabete mellito e glomerulonefrite.
Divisione
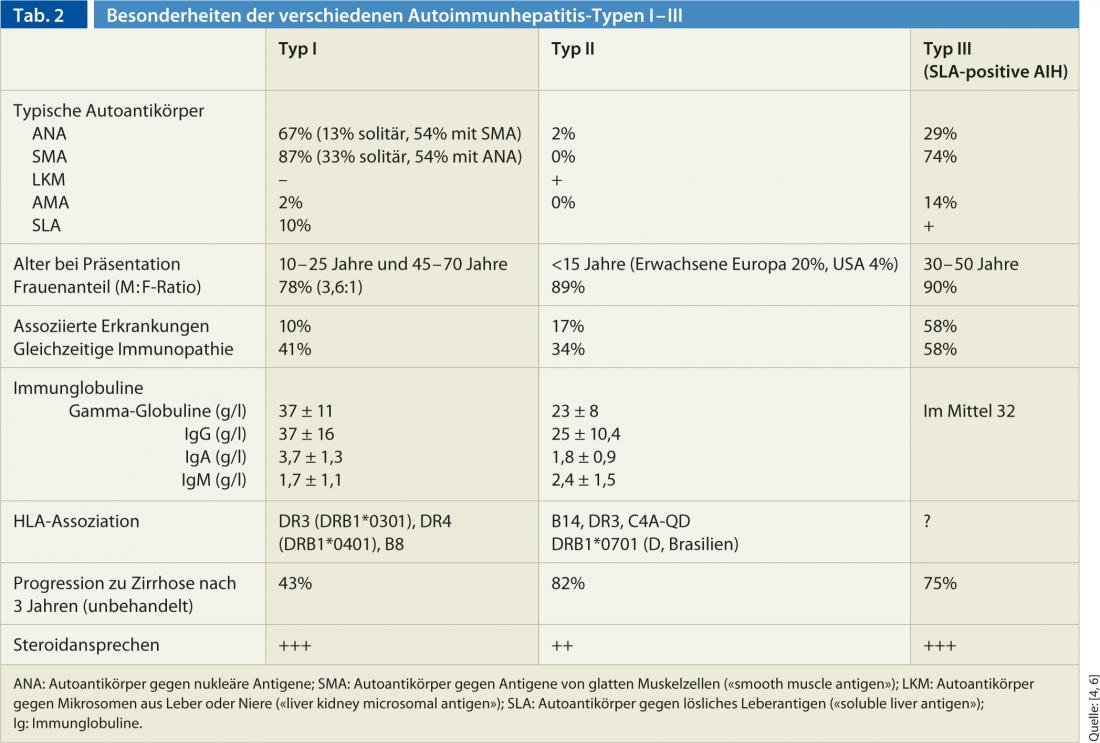
In base alla costellazione di anticorpi, l’AIH è classificata in tre tipi diversi (tipo I-III) (Tabella 2). L’AIH di tipo I è l’AIH “classica” e la forma più comune a livello mondiale. In confronto, l’AIH di tipo II è rara e colpisce soprattutto i pazienti pediatrici (ragazze/giovani donne). L’AIH può manifestarsi in combinazione con altre malattie autoimmuni del fegato (le cosiddette “sindromi di sovrapposizione”). L’AIH si sovrappone più comunemente alla cirrosi biliare primaria AMA-positiva (circa l’88%), ma possono essere presenti contemporaneamente anche la colangite sclerosante primaria e l’epatite virale.
Diagnostica
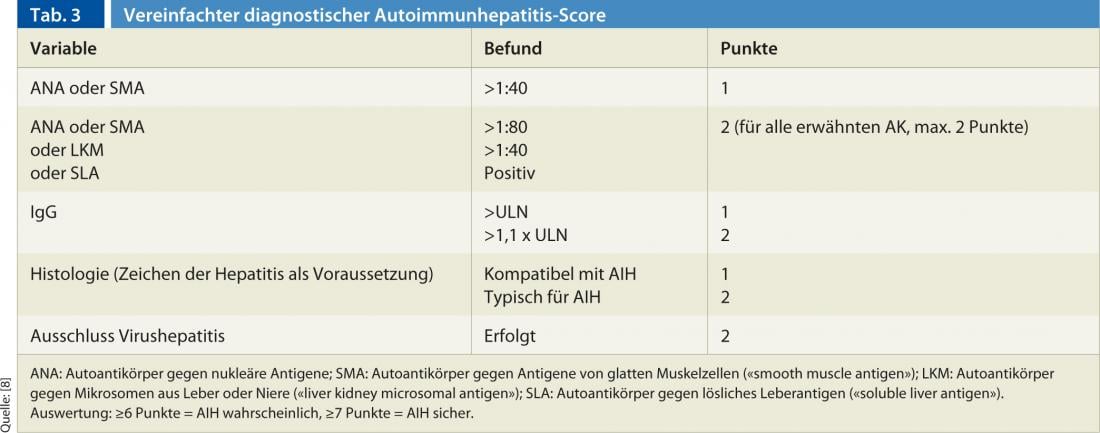
La diagnosi si basa su una combinazione di risultati clinici, istologici e sierologici, nonché sull’esclusione di altre epatopatie croniche (principalmente epatite virale, epatite indotta da farmaci, epatopatie ereditarie e metaboliche) [7]. Nessun singolo reperto è patognomonico per l’AIH. Per questo motivo, in passato sono stati stabiliti diversi punteggi, con il punteggio recentemente pubblicato e semplificato da Hennes et al. è facile da gestire nella pratica clinica quotidiana [8]. Il punteggio distingue tra una diagnosi certa (min. 7 punti) e una probabile (min. 6 punti) di AIH e si basa sui seguenti quattro criteri (Tabella 3):
- Presenza di autoanticorpi
- Immunoglobulina G (IgG) elevata
- Istologia del fegato
- Esclusione dell’epatite virale
La sensibilità e la specificità di questo punteggio sono elevate: per una diagnosi certa, i valori sono rispettivamente 81% e 99%; per una diagnosi probabile, 88% e 97% [8].
Laboratorio: Gli esami chimici di laboratorio di solito mostrano il quadro tipico del danno epatico epatocellulare: le transaminasi sono chiaramente superiori ai parametri della colestasi (rapporto AST: ALP >3). Un quadro colestatico con iperbilirubinemia diretta predominante ed elevazione dell’ALP è più raro. Inoltre, se si sospetta l’AIH, si devono determinare le gammaglobuline e gli autoanticorpi contro gli antigeni nucleari (ANA), contro gli antigeni delle cellule muscolari lisce (“antigene muscolare liscio” [SMA]) e contro i microsomi del fegato o del rene (“antigene microsomiale epatico renale” [LKM]).
Altri autoanticorpi più recenti includono gli anticorpi contro il citosol 1 del fegato (LC-1), i cui titoli sono correlati all’attività infiammatoria dell’AIH, o gli anticorpi del recettore dell’asialoglicoproteina (ASGPR). Questi possono essere rilevati fino al 90% dell’AIH di tipo I e hanno un significato prognostico.
Istologia: l’istologia è essenziale per fare una diagnosi certa, anche se i reperti istologici non sono specifici per l’AIH [5]. Anche se la presentazione clinica è acuta, istologicamente di solito ci sono già segni di epatopatia cronica. L’espressione istologica non è correlata al grado di elevazione dei valori epatici o delle IgG. L’istologia è quindi un parametro più affidabile dei risultati di laboratorio per stimare la gravità della malattia [9].
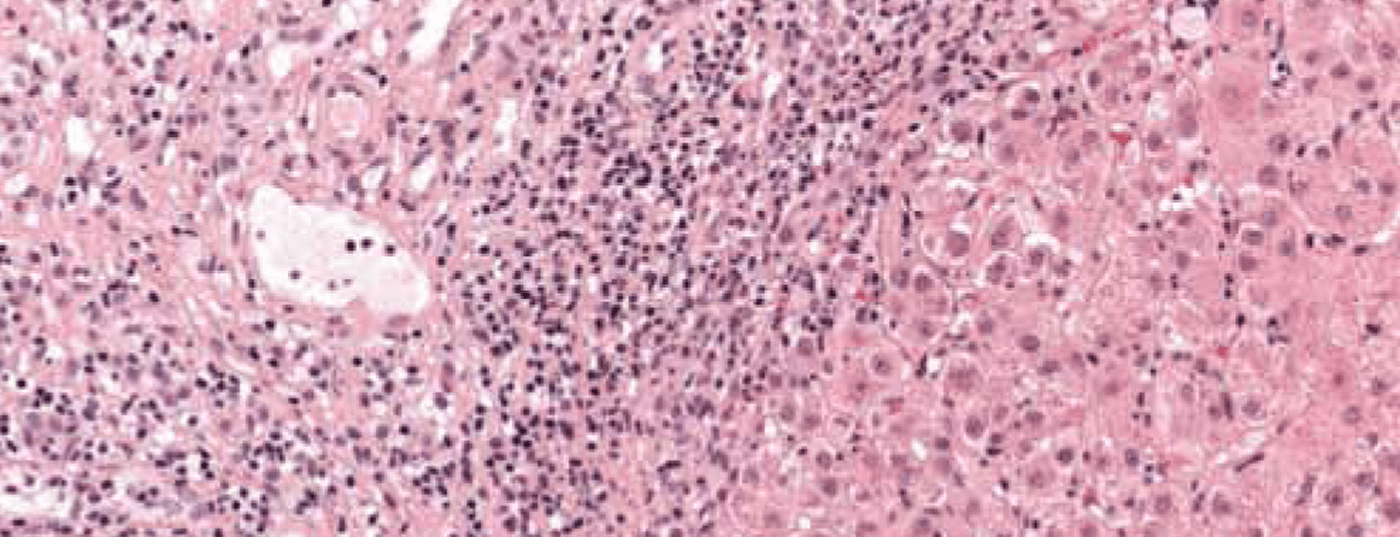
Il quadro di una malattia necroinfiammatoria cronica è caratteristico: infiltrati portali e periportali (“necrosi frammentaria”, “epatite di interfaccia”) e monocitici (linfoplasmocitici) (Fig. 1). Nella malattia grave e avanzata, c’è un’estesa necrosi e fibrosi a ponte. L’interfaccia epatite” non indica necessariamente un decorso progressivo della malattia, mentre la “necrosi a ponte” aumenta la probabilità di progressione verso la cirrosi. La specificità del reperto istologico complessivo è dell’81%, il valore predittivo positivo del 68%. La differenziazione dell’epatite virale o indotta da farmaci dall’AIH può quindi essere talvolta difficile.
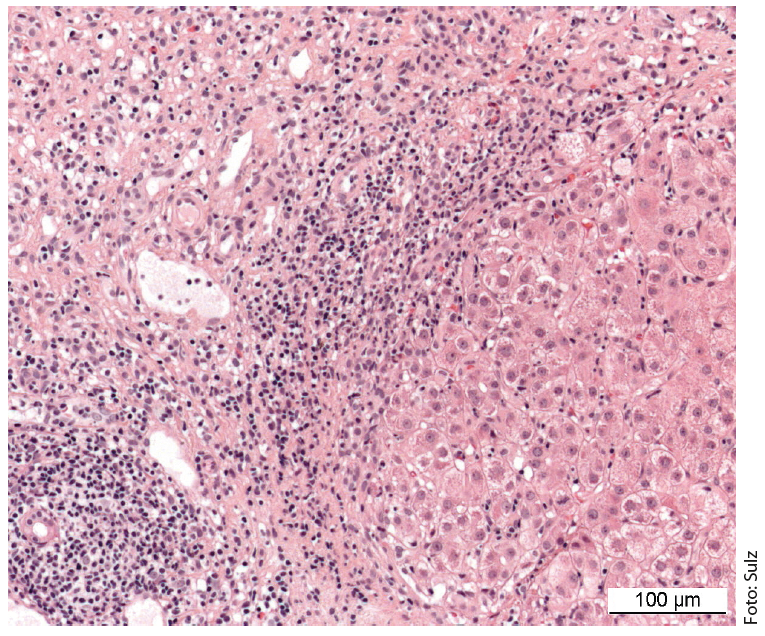
Fig. 1: L’istologia del fegato di una ragazza di 12 anni mostra sezioni del campo portale parzialmente fibrose con densi infiltrati infiammatori linfoplasmatici e un’epatite di interfaccia attiva. Colorazione: ematossilina-eosina.
Terapia
Indicazioni: Secondo l’Associazione americana per lo studio delle malattie del fegato (AASLD), esistono indicazioni assolute e relative per il trattamento dell’AIH (Tabella 4) [3].

Classificazione della terapia: la terapia può essere suddivisa in diverse fasi:
- Induzione della remissione
- Mantenimento della remissione
- Rallentamento o interruzione
- Terapia di una ricaduta
Obiettivo della terapia: l’obiettivo della terapia è la remissione permanente. Classicamente, la remissione è definita come una diminuzione dell’AST <2 volte la norma superiore e la normalizzazione delle gammaglobuline [8]. Tuttavia, studi recenti indicano che la normalizzazione completa degli enzimi epatici, dell’istologia e delle gammaglobuline dovrebbe essere l’obiettivo della terapia, in quanto ha migliorato la prognosi dei pazienti trattati [10, 11].
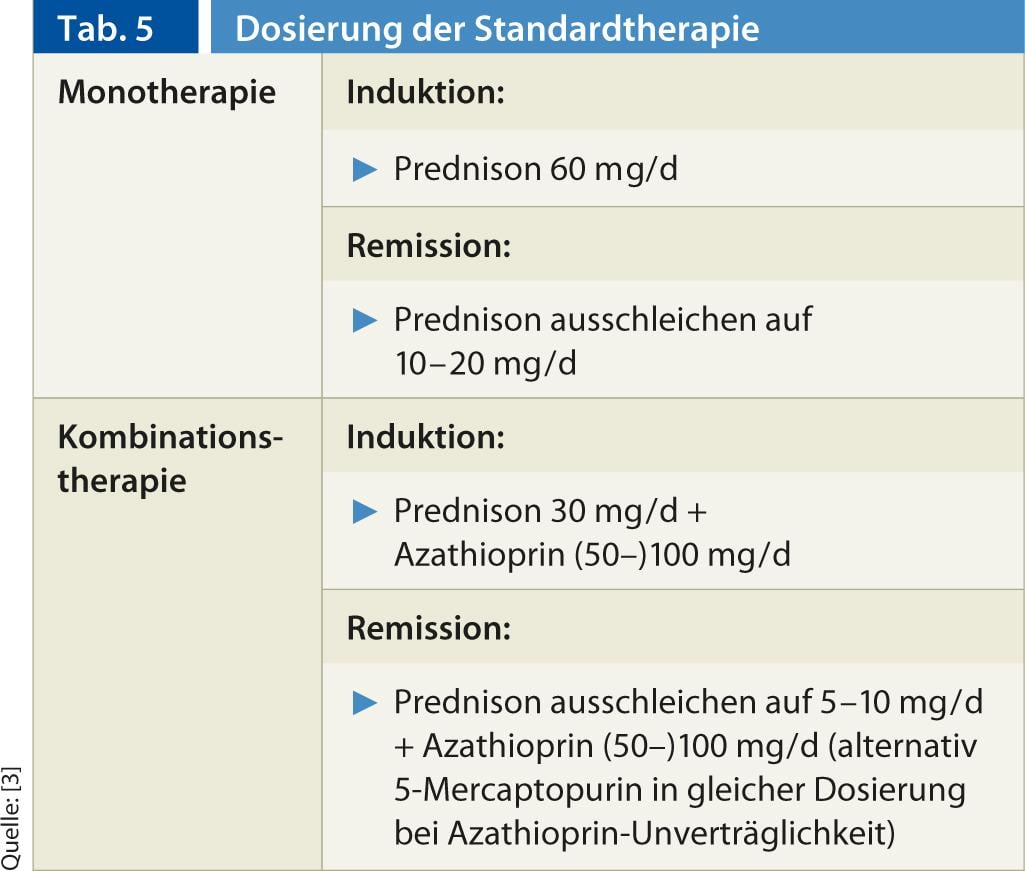
Terapia standard: per la terapia immunosoppressiva dell’AIH, la collaborazione tra il medico di base e uno specialista si è dimostrata efficace. Attualmente, la terapia standard consiste nella monoterapia o nella terapia combinata con prednis(ol)-one con/senza azatioprina, che si basa su studi prospettici, non randomizzati, condotti tra gli anni ’60 e i primi anni ’80. I regimi di dosaggio sono indicati nella tabella 5. È importante che la dose di steroidi non venga ridotta troppo rapidamente. Si deve attendere la normalizzazione delle transaminasi. Nel caso della terapia combinata steroidi/tiopurina, l’azatioprina viene aggiunta rapidamente allo steroide. In caso di intolleranza all’azatioprina, è possibile passare alla 5-mercaptopurina (Puri-Nethol) nello stesso dosaggio. L’efficacia della terapia combinata e della monoterapia è paragonabile, ma la terapia combinata è steroid-sparing, associata a effetti collaterali steroidei meno gravi (dal 66% a <20% durante 18 mesi di terapia) [12].
Terapia alternativa con budesonide: nel più grande studio terapeutico controllato finora condotto sull’AIH, il valore della budesonide (3 × 3 mg) è stato confrontato con il prednis(ol)-one in ogni caso in combinazione con l’azatioprina [13]. Entrambi i bracci di studio hanno mostrato un tasso relativamente basso di remissioni complete, ma un numero significativamente inferiore di effetti collaterali da steroidi nel gruppo budesonide (28% contro 53%). Anche la budesonide (2 × 3 mg) sembra essere adatta al mantenimento della remissione.
Tuttavia, l’ipertensione portale o la cirrosi rappresentano una controindicazione relativa alla budesonide, a causa del metabolismo ridotto [14].
Importanza della remissione e della ricaduta per una durata sufficiente della terapia: la remissione si ottiene nel 65-75% dei casi dopo 24 mesi di terapia. Circa il 20% non raggiunge la remissione completa. La recidiva (aumento delle transaminasi e/o dei sintomi durante la terapia, durante il tapering o dopo l’interruzione della terapia) si verifica in circa il 50% dei casi entro sei mesi e nell’80% dopo tre anni dall’interruzione della terapia, associata alla progressione a cirrosi epatica in quasi il 40% e allo sviluppo di insufficienza epatica nel 14%.
La durata della terapia prima dell’interruzione dell’immunosoppressione sembra essere il fattore principale per distinguere i pazienti in remissione sostenuta da quelli con recidiva. Rispetto alla remissione sostenuta del 67% con una terapia >di 4 anni, questo tasso è solo del 10% con una terapia di 1-2 anni [15]. Si raccomanda pertanto di interrompere la terapia solo sulla base di una remissione clinica, istologica e biochimica completa dopo due, preferibilmente quattro anni. La remissione istologica può essere ritardata fino a otto mesi rispetto alla remissione clinica e biochimica.
Opzioni terapeutiche più recenti (“seconda linea”): Le opzioni terapeutiche alternative devono essere discusse nei seguenti casi:
- Fallimento del trattamento con la terapia standard
- Intolleranza alla terapia standard
- Evitare gli effetti collaterali degli steroidi nei pazienti ad alto rischio
- Studi sperimentali
Tra gli altri, vengono utilizzati il micofenolato, il mofetil (MMF), il tacrolimus o la ciclosporina A.
Trapianto di fegato: se la terapia fallisce, si deve prendere in considerazione il trapianto di fegato in una fase iniziale. Dopo un trapianto riuscito, la sopravvivenza è buona (sopravvivenza a 5 anni 91% [16]; sopravvivenza a 10 anni 75% [cirrosi: 62%]). Il rischio di recidiva nel trapianto è del 20-36% [16] ed è ancora più frequente nei bambini.
Monitoraggio della terapia e follow-up: le transaminasi e il livello di IgG indicano il successo della terapia e devono essere determinati regolarmente (da tre a sei mesi). La determinazione degli autoanticorpi classici durante il decorso non è utile, poiché il livello del titolo non è correlato al grado di attività. Si raccomanda una biopsia epatica prima di interrompere la terapia, poiché una reazione infiammatoria residua nel fegato può già indicare un aumento del rischio di recidiva.
In presenza di cirrosi, si raccomanda lo screening per il carcinoma epatocellulare. Inoltre, i pazienti con AIH dovrebbero ricevere la vaccinazione contro l’epatite A/B, oltre alle consuete vaccinazioni standard [17].
Situazioni terapeutiche speciali
Pazienti a rischio: I rischi di effetti collaterali della terapia sono: metabolismo diabetico, osteoporosi, ipertensione arteriosa mal controllata, labilità emotiva o anamnesi positiva per psicosi. Queste situazioni di rischio non rappresentano una controindicazione assoluta, ma i pazienti devono essere monitorati attentamente e le sostanze che risparmiano gli steroidi, come l’azatioprina, devono essere utilizzate prima.
Epatite fulminante: mentre un piccolo studio non è riuscito a dimostrare un beneficio rilevante degli steroidi nell’AIH fulminante, la risposta agli steroidi nella presentazione grave è stata del 36-100% in altri studi. In generale, si raccomanda il rinvio immediato a un centro trapianti in caso di presentazione fulminante [18, 19].
Cirrosi: i pazienti con e senza cirrosi mostrano un esito comparabilmente buono (morte e trapianto di fegato come endpoint) dopo dieci anni (sopravvivenza a 10 anni >90%), dopodiché la curva di sopravvivenza dei pazienti con cirrosi (sopravvivenza a 20 anni <40%) si riduce significativamente rispetto a quelli senza cirrosi (sopravvivenza a 20 anni <80%).
Cirrosi scompensata: mentre il beneficio del trattamento non è chiaro nella cirrosi istologicamente inattiva, la risposta al trattamento nella cirrosi scompensata con epatite attiva può essere molto buona. In alcuni casi, è possibile anche la regressione della fibrosi [20].
Previsioni
I pazienti con AIH sottoposti a un trattamento adeguato hanno un’aspettativa di vita complessivamente normale con una qualità di vita ben mantenuta. Tuttavia, circa ¹⁄3 dei pazienti con AIH presentano già una cirrosi epatica completa alla prima diagnosi, con una prognosi di conseguenza più sfavorevole. Ad eccezione dei decorsi fulminanti, il trapianto di fegato può essere evitato in quasi tutti i pazienti non cirrotici e nella maggior parte dei pazienti con cirrosi precoce.
Michael Christian Sulz, MD
PD Dr. med. Tilman J. Gerlach
CONCLUSIONE PER LA PRATICA
- (AIH) rappresenta l’11-23% di tutte le epatopatie croniche, anche se l’incidenza può essere sottostimata.
- L’esatta patogenesi dell’AIH rimane poco chiara. Il quadro clinico riflette una complessa interazione tra la predisposizione genetica, i fattori scatenanti, gli autoantigeni e i meccanismi immunoregolatori, che alla fine si traduce in un processo immunologico contro gli epatociti.
- L’AIH ha una presentazione molto eterogenea e fluttuante, con manifestazioni diverse che vanno dall’asintomatico all’epatite acuta, fino all’insufficienza epatica acuta e alla cirrosi epatica.
- La diagnosi si basa su una combinazione di risultati clinici, istologici e sierologici, nonché sull’esclusione di altre epatopatie croniche. Il punteggio semplificato di Hennes et al. è facile da gestire nella pratica clinica quotidiana.
- La terapia può essere suddivisa in diverse fasi, come l’induzione, il mantenimento della remissione, il tapering o l’interruzione e la terapia di una ricaduta.
- L’obiettivo della terapia è la remissione permanente; la terapia standard è la monoterapia o la terapia combinata con prednis(ol)on con/senza azatioprina.
Letteratura:
- Boberg KM, et al: Scand J Gastroenterol 1998; 33: 99-103.
- Milkiewicz P, et al: Transplantation 1999; 68: 253-256.
- Manns MP, et al: Hepatology 2010; 51: 2193-2213.
- Yeoman AD, et al: Hepatology 2009; 50: 538-545.
- Czaja AJ, Freese DK: Epatologia 2002; 36: 479-497.
- Sleisinger, Fordtran’s.: Malattie gastrointestinali e del fegato. 8ª ed. Vol.2. Saunders, 2006.
- Krawitt EL.: N Engl J Med 2006; 354: 54-66.
- Hennes EM, et al: Gruppo Internazionale Epatite Autoimmune. Epatologia 2008; 48: 169-176.
- Czaja AJ, Wolf AM, Baggenstoss AH: Gastroenterologia 1981; 80: 687-692.
- Miyake Y, et al: J Hepatol 2005; 43: 951-957.
- Montano-Loza AJ, Carpenter HA, Czaja AJ.: Am J Gastroenterol 2007; 102: 1005-1012.
- Summerskill WH, et al: Gut 1975; 16: 876-883.
- Manns MP, et al: Gastroenterologia. 2010; 139: 1198-1206.
- Geier A, et al: World J Gastroenterol 2003; 9: 2681-2685.
- Kanzler S, et al: J Hepatol 2001; 34: 354-355.
- Campsen J, et al: Liver Transpl 2008; 14: 1281-1286.
- Gleeson D, Heneghan MA.: Gut 2011; 60: 1611-1629.
- Kessler WR, et al: Clin Gastroenterol Hepatol 2004; 2: 625-631.
- Czaja AJ: Liver Transpl 2007; 13: 953-955.
- Dufour JF, DeLellis R, Kaplan MM: Ann Intern Med 1997; 127: 981-985.
PRATICA GP 2013; 5: 10-14