L’intestino umano ospita un intero ecosistema di batteri, funghi, virus e altri microrganismi. Con un peso fino a due chilogrammi, questa biocenosi è praticamente un organo nell’organo – e come tale è in grado di influenzare la salute del ‘suo’ essere umano. Una nuova ricerca assegna anche un ruolo al microbioma nello sviluppo delle malattie reumatiche infiammatorie, secondo la Società tedesca di reumatologia (DGRh).
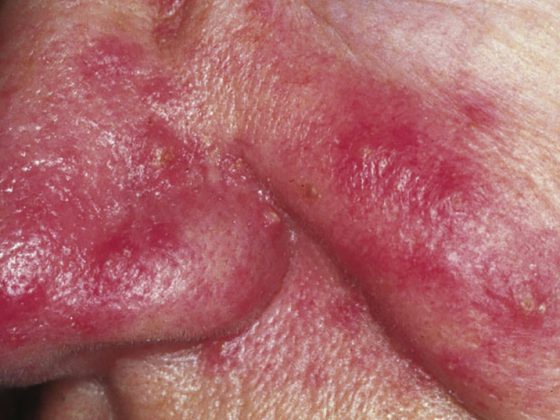
Una delle malattie per le quali il ruolo del microbioma è stato studiato in modo più approfondito è il Lupus Eritematoso Sistemico (LES). “Si tratta di una malattia reumatica infiammatoria autoimmune in cui il sistema immunitario dell’organismo si rivolge in particolare contro i componenti del nucleo cellulare”, spiega il Professor Andreas Krause, MD, Presidente della DGRh e Primario dell’Immanuel Hospital di Berlino. Poiché questi componenti fondamentali si trovano ovunque nel corpo, l’infiammazione tipica del LES può manifestarsi in tutti gli organi. La pelle, le articolazioni e i reni sono particolarmente colpiti. Tuttavia, i sintomi e i modelli di infestazione variano da paziente a paziente e possono anche cambiare nel corso della malattia cronica.
Il microbioma come fattore scatenante del LES?
Sebbene esistano fattori genetici che aumentano la suscettibilità al LES, questi non sono sufficienti a spiegare la malattia. “Non tutte le persone con la corrispondente predisposizione genetica sviluppano anche il LES”, afferma Krause. In questo caso, la composizione individuale del microbioma potrebbe entrare in gioco come fattore che aiuta a decidere l’insorgenza e il decorso della malattia. Negli ultimi anni, sono stati identificati alcuni possibili patobionti – batteri nocivi che potrebbero essere responsabili dell’influenza negativa del microbioma sullo sviluppo e sulla progressione della malattia. Questi includono alcuni enterococchi e lattobacilli che possono attraversare la parete intestinale nei pazienti con una barriera mucosa danneggiata, migrare verso altri organi e causare infiammazioni. Le cosiddette clostridiales apparentemente contrastano questo fenomeno. Questi batteri del colon sembrano essere indispensabili per un buon funzionamento della barriera mucosa. Producono importanti acidi grassi a catena corta che aiutano le cellule mucose dell’intestino a produrre muco, rafforzano la barriera intestinale e contribuiscono a creare un ambiente acido favorevole. “In un sottogruppo di pazienti affetti da LES, è già stato dimostrato che i clostridiales vengono persi mentre i lattobacilli proliferano”, afferma il Professor Martin A. Kriegel del Dipartimento di Reumatologia Traslazionale e Immunologia dell’Istituto di Medicina Muscoloscheletrica (IMM) dell’Ospedale Universitario di Münster, che conduce ricerche in questo campo.
Un altro meccanismo che potrebbe innescare i processi autoimmuni tipici delle malattie reumatiche infiammatorie è la cosiddetta reattività crociata: gli anticorpi che si sono formati originariamente contro i batteri riconoscono anche gli antigeni che si trovano nei tessuti dell’organismo. Questo diventa quindi anche il bersaglio della difesa immunitaria. Tale reattività incrociata è stata dimostrata per l’autoantigene Ro60, ad esempio, contro il quale sono diretti gli attacchi autoimmuni in molti pazienti con LES. Questo perché il Ro60 è prodotto anche da un’intera gamma di batteri presenti nell’intestino, sulla pelle e nella bocca.
Approcci terapeutici dalla ricerca sul microbioma
“Questi meccanismi sono ora ben supportati dai risultati della ricerca”, dice Kriegel. Gli studi futuri dovranno chiarire se le nuove scoperte possono essere utilizzate anche a livello terapeutico. I possibili punti di partenza sono, da un lato, le vaccinazioni o i farmaci contro i patogeni dannosi, ma dall’altro anche un’influenza mirata sul microbioma attraverso l’alimentazione. “Nello specifico del lupus, una dieta ad alto contenuto di fibre sembra proteggere la barriera intestinale, impedendo ai batteri nocivi di diffondersi ad altri organi”, afferma Krause. Questi effetti, che finora sono stati osservati solo nei topi, fanno sperare che i processi autoimmuni possano essere influenzati favorevolmente anche negli esseri umani attraverso un’alimentazione adeguata.
Pubblicazione originale:
Redanz, S., Kriegel, M.A. Il ruolo del microbioma nel lupus e nella sindrome antifosfolipidica. Z Rheumatol (2022). https://doi.org/10.1007/s00393-022-01184-7