Lo spettro di agenti sistemici approvati per il trattamento della dermatite atopica da moderata a grave si è ampliato nel recente passato, tanto che oggi è possibile scegliere tra diversi biologici e inibitori della Janus chinasi. L’alleviamento del prurito è un obiettivo terapeutico fondamentale per chi ne è affetto – cosa si sa dell’effetto antipruriginoso dei nuovi farmaci sistemici? Questa domanda è discussa in una mini-review pubblicata di recente sul Journal of the Dermatological Society.
Il primo autore della pubblicazione è Hanna Bonnekoh, MD, della Clinica di Dermatologia, Venereologia e Allergologia, Charité Universitätsmedizin Berlin [1]. L’importanza della conoscenza degli effetti dei nuovi farmaci sul miglioramento del prurito è dimostrata, tra l’altro, da un sondaggio pubblicato di recente su 1104 pazienti con dermatite atopica: il prurito è stato considerato molto importante per valutare l’efficacia di un trattamento dal 95,4% dei pazienti [2]. Negli studi clinici sulla dermatite atopica, i parametri del prurito sono di solito riportati utilizzando endpoint standardizzati, il che rende possibile confrontare le sostanze attive in termini di effetti sul prurito.
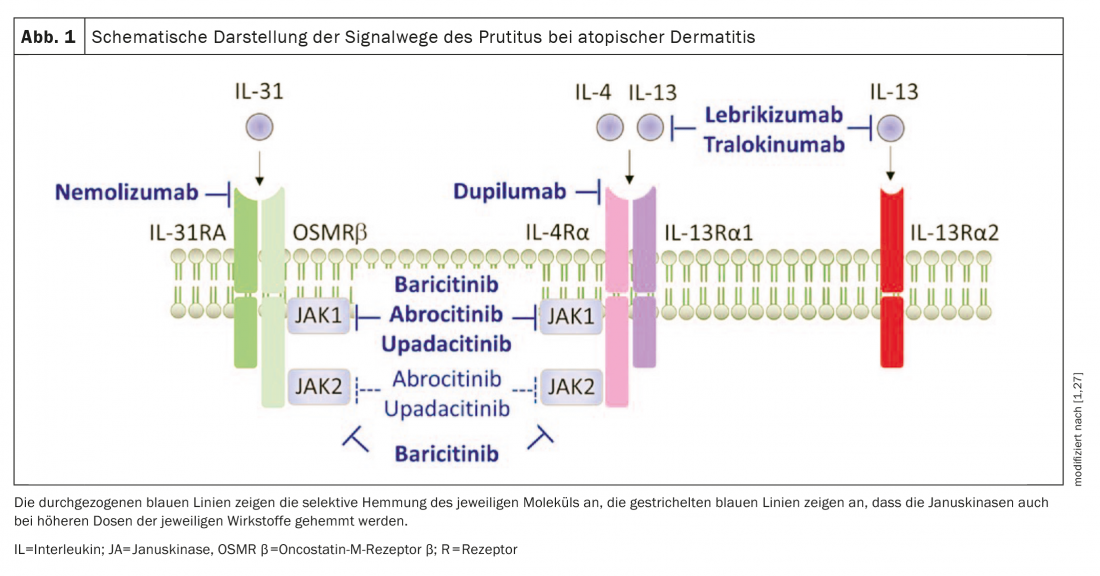
Nel complesso, tutti gli studi inclusi nella revisione di Bonnekoh et al. 2022 nuovi farmaci per la dermatite atopica (Fig. 1) hanno mostrato dati promettenti nel migliorare il prurito.
Qual è lo stato attuale delle conoscenze?
La sofferenza delle persone colpite è elevata; tra l’altro, molti lamentano disturbi del sonno legati al prurito [11–13]. Oltre alla rapida insorgenza dell’azione, anche la riduzione complessiva del prurito durante l’intero periodo di trattamento è di grande importanza per i pazienti affetti da neurodermite, come dimostrato da Bonnekoh et al. enfatizzare [1]. Di seguito è riportata una sintesi delle moderne terapie sistemiche attualmente approvate dall’EMA e da Swissmedic per il trattamento della dermatite atopica da moderata a grave.

Dupilumab: l’anticorpo monoclonale Dupilumab (Dupixent®), un’immunoglobulina (Ig)-G4κ completamente umana, inibisce la segnalazione di IL-4 e IL-13 attraverso l’inibizione di IL-4Rα. Una recente analisi di quattro studi clinici randomizzati di fase III ha analizzato gli effetti di dupilumab sul prurito nei pazienti con dermatite atopica da moderata a grave. Questo ha dimostrato che il trattamento con dupilumab ha portato a un miglioramento rapido e statisticamente significativo del prurito giornaliero più grave (variazione percentuale della scala di valutazione numerica, NRS) rispetto al placebo, già al giorno 2 negli adulti e al giorno 5 nei pazienti adolescenti. Inoltre, è stato osservato un rapido miglioramento (definito come la percentuale di pazienti con un miglioramento di almeno 3 punti rispetto al basale) del prurito dal giorno 4 negli adulti e dal giorno 13 negli adolescenti. Inoltre, nel corso dei rispettivi studi, l’intensità del prurito è stata significativamente ridotta in tutti gli studi rispetto al placebo e ha mostrato una diminuzione progressiva nel tempo [3].
Tralokinumab: l’anticorpo monoclonale anti-IL-13 ricombinante umano IgG4λ tralokinumab (Adtralza®) impedisce all’IL-13 di legarsi a IL-13Rα1 e IL-13Rα2 ed è stato recentemente approvato in Svizzera per gli adulti con dermatite atopica da moderata a grave [34]. I risultati degli studi di fase III su tralokinumab come monoterapia (ECZETRA1 e 2) e in combinazione con il trattamento corticosteroideo topico (ECZETRA 3) nei pazienti con dermatite atopica da moderata a grave sono stati molto convincenti. Alla settimana 16, una percentuale maggiore di pazienti trattati con tralokinumab ha ottenuto una riduzione del prurito peggiore giornaliero medio settimanale (NRS ≥4) rispetto al basale nel confronto con il placebo. Inoltre, il trattamento con tralokinumab ha mostrato maggiori cambiamenti rispetto al basale nel peggior prurito giornaliero NRS rispetto al gruppo placebo, con una differenza significativa dalla settimana di trattamento 1 [4,5].
Baricitinib: l’inibitore orale della JAK baricitinib (Olumiant®) ha una specificità altrettanto elevata per JAK-1 e -2 e una specificità inferiore per Tyk-2 [21,34]. In combinazione con i prodotti topici
corticosteroidi (TCS), una riduzione significativa del prurito (NRS medio rispetto al basale) è stata ottenuta già il giorno 2 con il trattamento quotidiano con 2 mg o 4 mg di baricitinib. Alla settimana 16, una percentuale significativamente più alta di pazienti nel braccio di trattamento (44% nel gruppo 4 mg, 38% nel gruppo 2 mg) ha mostrato un miglioramento clinicamente significativo del prurito (definito come cambiamento rispetto al basale NRS ≥4) rispetto al gruppo placebo (20%) [6,7].
Upadacitinib: Upadacitinib (Rinvoq®), un altro farmaco a piccola molecola, è un inibitore orale di JAK-1 [8,9,34]. La monoterapia con 15 mg o 30 mg (1×/d ciascuno) ha determinato un miglioramento significativo del prurito alla settimana 16 rispetto al placebo, nonché una riduzione significativa del prurito rispetto al basale (NRS ≥4) [10]. Upadacitinib è stato convincente anche in combinazione con la TCS in uno studio di fase III.
|
La patogenesi del prurito rimane un mistero Ad oggi, l’esatto meccanismo alla base del prurito nella dermatite atopica (AD) non è stato completamente chiarito. Recenti evidenze suggeriscono che i pruritogeni indipendenti dall’istamina sono coinvolti nello sviluppo del prurito cronico [28,29]. Oltre all’interleuchina-31 – una citochina prodotta prevalentemente dalle cellule Th2 che provoca il prurito attraverso un complesso recettore espresso sulle fibre C – l’IL-13 e l’IL-4 sono citochine Th2-specifiche che si pensa siano coinvolte nella patogenesi dell’AD e nella sintomatologia del prurito. Altri pruritogeni associati al prurito nell’AD includono l’istamina, la triptasi, l’IL-33 e la linfopoietina stromale timica (TSLP) – ma la loro rilevanza clinica nell’innescare il prurito nell’AD è ancora poco chiara [30]. |
Sono in cantiere altri principi attivi
Bonnekoh et al. 2022 si occupano anche di agenti sistemici che erano ancora in fase di sviluppo al momento della loro revisione. Oltre all’inibitore JAK abrocitinib, ora approvato, gli anticorpi monoclonali lebrikizumab e nemolizumab sono descritti in termini di effetti sulle caratteristiche del prurito [1,34]. Gli autori sottolineano che la loro revisione non discute i nuovi approcci terapeutici topici, come l’inibitore della tirosin-chinasi 2 (TYK2) brepocitinib o l’agente modulatore dei recettori degli idrocarburi arilici tapinarof [25,26].
Non è ancora l’ultima parola in fatto di saggezza
Il circuito prurito-graffio è la fine di una cascata di interazioni complesse tra fattori ambientali e di esposizione [14,32,33], il microbioma cutaneo [15–19], la barriera epidermica [20,21] e le risposte immunitarie e infiammatorie [31]. Questi processi si sviluppano su un particolare background genetico e, ancora poco studiato, epigenetico [22]. Non è ancora stato chiarito se siano direttamente i fattori associati all’infiammazione a contribuire al pato-meccanismo e alla gravità del prurito o se siano coinvolti altri fattori. Sebbene sia stato osservato che il prurito nella dermatite atopica moderata e grave sia strettamente associato alla gravità della dermatite atopica, molti pazienti affetti da dermatite atopica riferiscono un prurito che non è limitato alla pelle lesionata e alcuni pazienti con dermatite atopica lieve soffrono di prurito grave [11,23,24].
Letteratura:
- Bonnekoh H, Butze M, Metz M: JDDG 2022; 20(2): 150-156.
- Kobyletzki LB, et al: Acta Derm Venereol 2017; 97(1): 86-90
- Silverberg JI, et al: J Am Acad Dermatol 2020; 82(6): 1328-1336.
- Wollenberg A, et al: Br J Dermatol 2021; 184(3): 437-449.
- Silverberg JI, et al: Br J Dermatol 2021; 184(3): 450-463.
- Simpson EL, et al: Br J Dermatol 2020; 183(2): 242-255.
- Reich K, et al: JAMA Dermatol 2020; 156(12): 1333-1343.
- Guttman-Yassky E, et al: Lancet 2021; 397(10290): 2151-2168.
- Reich K, et al: Lancet 2021; 397(10290): 2169-2181.
- Bieber T: Nature Reviews Drug Discovery 2022; 21(1): 21-40.
- Huet F, et al: Acta Derm Venereol 2019; 99(3): 279-283.
- Kage P, Simon JC, Treudler R: J Dtsch Dermatol Ges 2020; 18(2): 93-102.
- Stand S: N Engl J Med 2021; 384(12): 1136-1143.
- Mack MR, Kim BS:Trends Immunol 2018; 39: 980-991.
- Byrd AL, Belkaid Y, Segre JA: Nature Reviews Drug Discovery 2018; 16: 143-155.
- Meisel JS, et al: Microbioma 2018; 6: 20.
- Kong HH, et al: Genome Res 2012; 22: 850-859.
- Shi B, et al: J. Allergy Clin Immuno 2016; 138: 1233-1236.
- Williams MR, et al: Sci. Transl Med 2019;11:eaat8329.
- Kim BE, Leung DY: Allergy Asthma Immunol Res 2012; 4: 12-16.
- Rerknimitr P, et al: Infiammazione e Rigenerazione 2017; 37: 14.
- Marenholz I, et al: Nature Communications 2015; 6: 8804.
- Hawro T, et al: J Am Acad Dermatol 2021; 84(3): 691-700.
- Chovatiya R, et al: Ann Allergy Asthma Immunol 2021; 127(1): 83-90e2.
- Jo CE, Gooderham M, Beecker J: Int J Dermatol 2022; 61(2): 139-147.
- Paller AS, et al: J Am Acad Dermatol 2021; 84(3): 632-638.
- Med ChemExpress, www.medchemexpress.com/lab-consumables-gift.html (ultimo accesso 27.05.2022)
- Dillon SR, et al: Nature Immunology 2004; 5(7): 752-760.
- Zheng T, et al: J Invest Dermatol 2009; 129(3): 742-751
- Langan SM, Irvine AD, Weidinger S: Lancet 2020; 396(10247): 345-360.
- Weidinger S, et al: Dermatite atopica. Nature Reviews Disease Primers 2018; 4: 1.
- Gilles S, et al: Dermatologia sperimentale 2018; 27: 1193-1200.
- Stefanovic N, Flohr C, Irvine AD: Allergy 2020; 75: 63-74.
- Informazioni sui farmaci, www.swissmedicinfo.ch, (ultimo accesso 12.06.2022)
PRATICA DERMATOLOGICA 2022; 32(3): 22-23