Il tipo e la durata della terapia antitrombotica combinata variano. I fattori decisivi sono il contesto clinico (CHD stabile vs. ACS), la necessità di un’ulteriore anticoagulazione (ad esempio, fibrillazione atriale) e il rischio di sanguinamento specifico del paziente. La prevenzione secondaria è parte integrante della gestione dopo la rivascolarizzazione.
L’autunno 2017 segna il 40° anniversario dell’intervento coronarico percutaneo (PCI), eseguito per la prima volta con successo nel 1977 da Andreas Grüntzig presso l’Ospedale Universitario di Zurigo [1]. Da allora, il metodo è migliorato continuamente, soprattutto grazie all’uso e all’ulteriore sviluppo degli stent coronarici, con una graduale diminuzione dei rischi periprocedurali [2]. Oltre alla guarigione ottimale nel segmento coronarico trattato con il catetere (evitando la trombosi dello stent [ST] e la restenosi istantanea [ISR]), un’adeguata prevenzione secondaria e l’eventuale trattamento farmacologico dei sintomi pectanginosi residui sono determinanti per il decorso a lungo termine [3].
Superiorità dei moderni stent a rilascio di farmaco (DES)
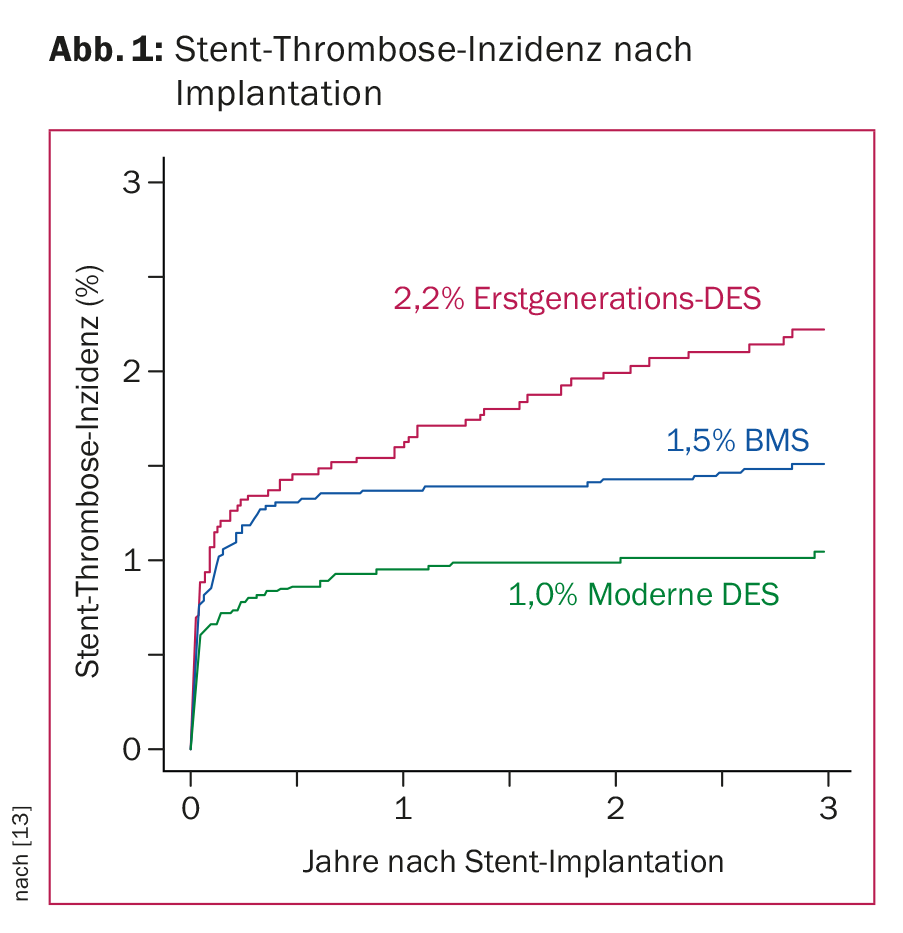
Gli eccellenti risultati raggiunti dall’attuale tecnologia degli stent si basano sui progressi della farmacoterapia e dell’innovazione dei dispositivi, combinati con una tecnica di impianto ottimale [4]. La prevenzione di ISR e ST è essenziale. Recenti studi di registro e comparativi sui moderni DES in popolazioni di pazienti rappresentative mostrano la loro superiorità rispetto agli stent di metallo nudo (BMS), con un tasso medio di ST inferiore all’1% nel primo anno dopo l’impianto dello stent e dello 0,2-0,4% annuo in seguito. (Fig. 1). Con i moderni DES, l’ISR clinicamente manifesta si verifica in meno del 5% dei casi. A causa della situazione ottimale dei dati dei moderni DES, gli stent non rivestiti (BMS) vengono impiantati in Svizzera solo in rari casi. I nuovi sviluppi, come l’uso di palloncini rivestiti di farmaci o i cosiddetti scaffold assorbibili (cioè le impalcature di stent che si dissolvono nel tempo) sono promettenti, ma per il momento restano riservati a gruppi di pazienti specifici, visti i dati ancora limitati disponibili.
Terapia antitrombotica
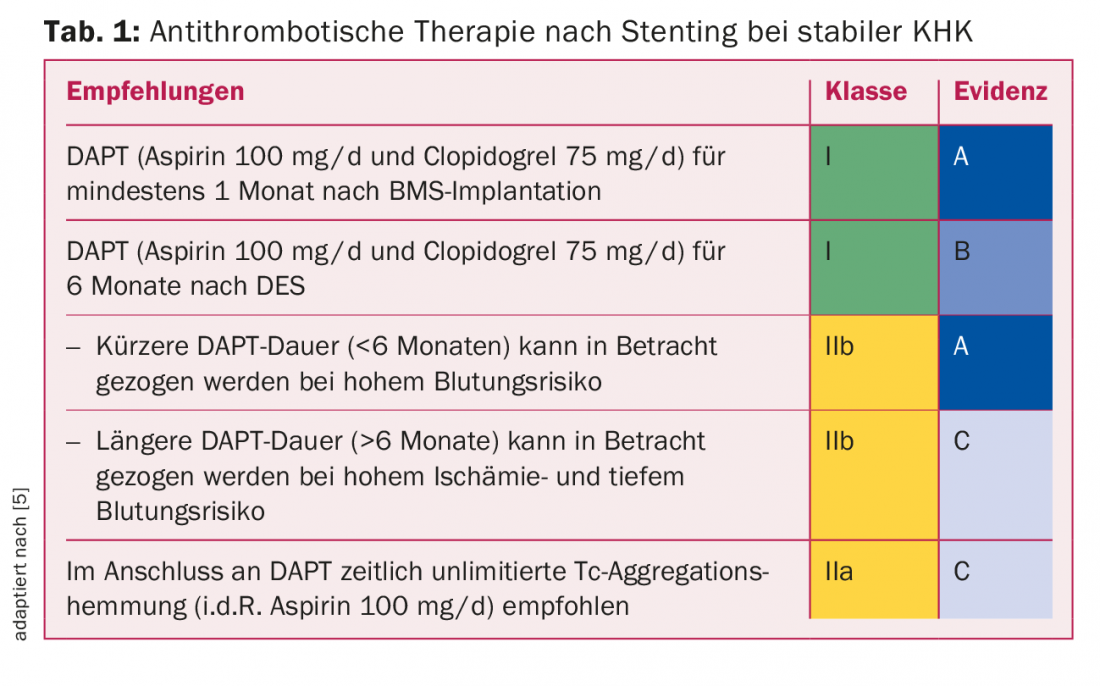
La scelta o la combinazione della terapia antitrombotica dipende principalmente dal contesto clinico (coronaropatia stabile (CAD), infarto miocardico non-ST-elevation (NSTEMI) o infarto miocardico ST-elevation (STEMI)). In definitiva, l’obiettivo è trovare una combinazione con il minor rischio possibile di ischemia ed emorragia. L’indicazione per la gastroprotezione durante la terapia antitrombotica combinata è generosa (età pari o superiore a 65 anni, storia di precedenti emorragie gastrointestinali, combinazione con steroidi). Quando si usa il clopidogrel, l’omeprazolo deve essere evitato a causa del potenziale di interazione.
Inibizione dell’aggregazione piastrinica nella CHD stabile: per la PCI con impianto di stent nella CHD stabile, esistono dati principalmente con la combinazione di aspirina e clopidogrel. La tabella 1 mostra le attuali linee guida valide in Svizzera, basate sulle linee guida europee [5]. A causa dell’insorgenza relativamente frequente di ST molto tardivi, fino a pochi anni fa si raccomandava una durata della doppia terapia antipiastrinica (DAPT) di dodici mesi per i DES di prima generazione. Tuttavia, l’endotelizzazione vascolare nei moderni DES è già completa alcuni mesi dopo l’impianto dello stent, motivo per cui sei mesi di DAPT sono di solito assolutamente sufficienti. Qualsiasi modifica a questa durata della DAPT è determinata dal cardiologo interventista al momento dell’impianto dello stent: un’estensione a dodici mesi per le lesioni complesse, una riduzione a uno-sei mesi per il rischio di sanguinamento molto elevato.
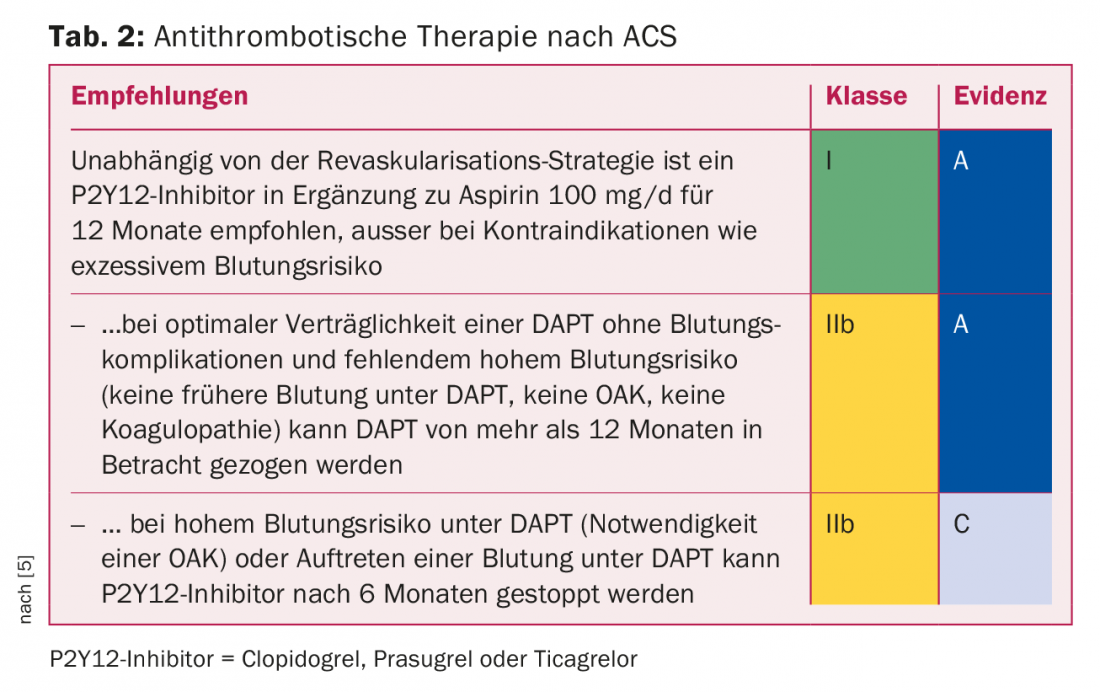
Inibizione dell’aggregazione piastrinica dopo una sindrome coronarica acuta (ACS): Il rischio di ischemia rimane elevato per diversi anni. (Tab.2). Gli ampi studi comparativi tra prasugrel e clopidogrel [6], da un lato, e tra ticagrelor e clopidogrel [7], dall’altro, condotti su pazienti affetti da ACS nei primi dodici mesi dopo l’ACS, hanno dimostrato una riduzione significativa dell’infarto miocardico e della morte cardiovascolare con prasugrel e ticagrelor rispetto a clopidogrel. A causa della mancanza di studi comparativi diretti tra ticagrelor e prasugrel, non è possibile fare una dichiarazione chiara sulla diversa efficacia delle due sostanze. Lo studio PLATO, condotto come “studio allcomers” con ticagrelor, consente il trasferimento a tutti i collettivi di pazienti con ACS; lo studio TRITON, condotto con prasugrel, è uno studio PCI puro e quindi non consente il trasferimento a un collettivo di pazienti con ACS trattati in modo conservativo. Considerando le controindicazioni (emorragia acuta, emorragia intracranica st. n., insufficienza epatica da moderata a grave) e gli effetti collaterali (dispnea), il ticagrelor si propone come farmaco di prima scelta per tutti i pazienti con ACS.
Un’altra domanda è: “ACS: DAPT per più di dodici mesi?”. Il rischio cardiovascolare rimane superiore alla media negli anni successivi all’ACS, principalmente a causa di una progressione generale dell’ateromatosi coronarica con rotture della placca o stenosi rilevanti emergenti in altri punti del sistema coronarico [8].
Circa la metà di tutti gli eventi di recidiva cardiovascolare si verifica a causa di una nuova lesione. Non del tutto inaspettatamente, lo studio PEGASUS, condotto con ticagrelor (2× 60 mg vs. 2× 90 mg vs. placebo), ha mostrato una riduzione significativa degli eventi cardiovascolari (riduzione del rischio assoluto di quasi il 2%, numero necessario per il trattamento 70) con ticagrelor – al prezzo di un maggior numero di emorragie non fatali, soprattutto gastrointestinali.
Cosa pensare dei nuovi punteggi per la stratificazione del rischio di emorragia (www.precisedapt.com)? I punteggi clinici basati su internet o su app, facili da usare, permettono di identificare i pazienti ad alto rischio con una corrispondente riduzione della durata della DAPT in caso di alto rischio di sanguinamento e con una durata della DAPT normale (o più lunga) in caso di rischio di sanguinamento “non alto” a livello individuale, utilizzando l’anamnesi e i parametri clinici [9]. Tuttavia, la convalida per l’uso clinico quotidiano è ancora in sospeso.
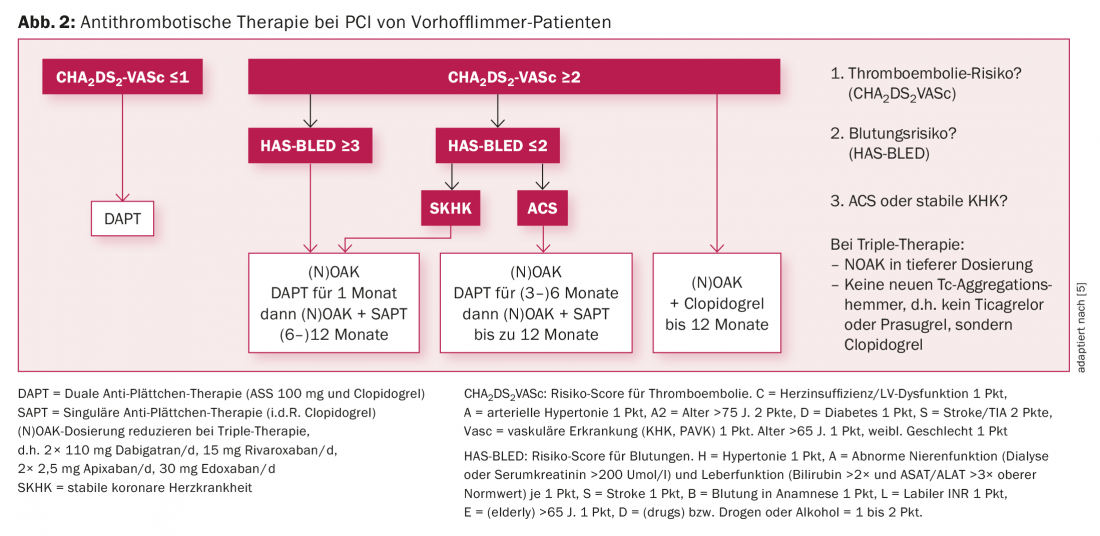
Fibrillazione atriale e PCI (Fig. 2): La fibrillazione atriale è una comorbidità comune nei pazienti con CHD, soprattutto negli anziani [10]. Di conseguenza, si pone la questione di combinare l’aggregazione piastrinica e l’anticoagulazione plasmatica durante e soprattutto dopo la PCI. I vantaggi dei NOAK con minori emorragie (soprattutto intracraniche) rispetto ai VKA dimostrati nei grandi studi sulla fibrillazione atriale possono essere trasferiti al collettivo di pazienti con CHD e fibrillazione atriale sulla base di sottoanalisi. Tuttavia, anche in questo caso c’è un equilibrio tra la prevenzione di ST/ictus da un lato e l’emorragia dall’altro. Con le linee guida stabilite da diversi anni, è importante determinare il tipo e la durata della terapia combinata in base al rischio di emorragia e di tromboembolismo stimato con i punteggi, nonché in base alla situazione individuale della CHD, coinvolgendo nella decisione i team di trattamento di follow-up.
Il recente studio Pioneer ACS ha confermato che la terapia duale con rivaroxaban 15 mg e clopidogrel 75 mg o la combinazione con rivaroxaban a dosi molto basse (2× 2,5 mg/d più aspirina 100 mg/d più clopidogrel 75 mg/d) rispetto alla triplice terapia convenzionale è associata a un minor rischio di sanguinamento con un tasso probabilmente invariato di trombosi dello stent e ictus [11].
In sintesi, nella popolazione con fibrillazione atriale sottoposta a PCI, la terapia antitrombotica deve essere individualizzata in base al rischio individuale di emorragia e trombosi dello stent. Non è consentita la combinazione di ticagrelor o prasugrel con (N)OAK. Se è necessaria una triplice terapia, si deve usare clopidogrel invece di ticagrelor o prasugrel.
Terapia antiischemica
In caso di rivascolarizzazione incompleta o di recidiva di angina pectoris, la terapia farmacologica anti-ischemica deve essere continuata o ristabilita. I principi della terapia personalizzata in linea di principio e la questione della (nuova) valutazione invasiva si basano da un lato sull’efficacia della misura nel ridurre i sintomi e dall’altro sul potenziale beneficio prognostico [12]. I farmaci antianginosi che non migliorano la prognosi, come i nitrati, devono sempre essere sospesi quando il paziente è libero da sintomi.
Prevenzione secondaria
Importanza della riabilitazione: una prevenzione secondaria ottimale è di importanza centrale per un successo sostenibile della PCI. Come è noto, la PCI iniziale risolve solo il problema meccanico acuto, non cura la malattia (CHD). Di conseguenza, il controllo dei fattori di rischio cardiovascolare è importante per il successo del trattamento. I valori target per la pressione arteriosa, la dislipidemia e il glucosio nel sangue sono riportati nella tabella 3. Dopo un intervento con catetere, è possibile impostare nuovamente il percorso per un cambiamento sostenibile dello stile di vita.
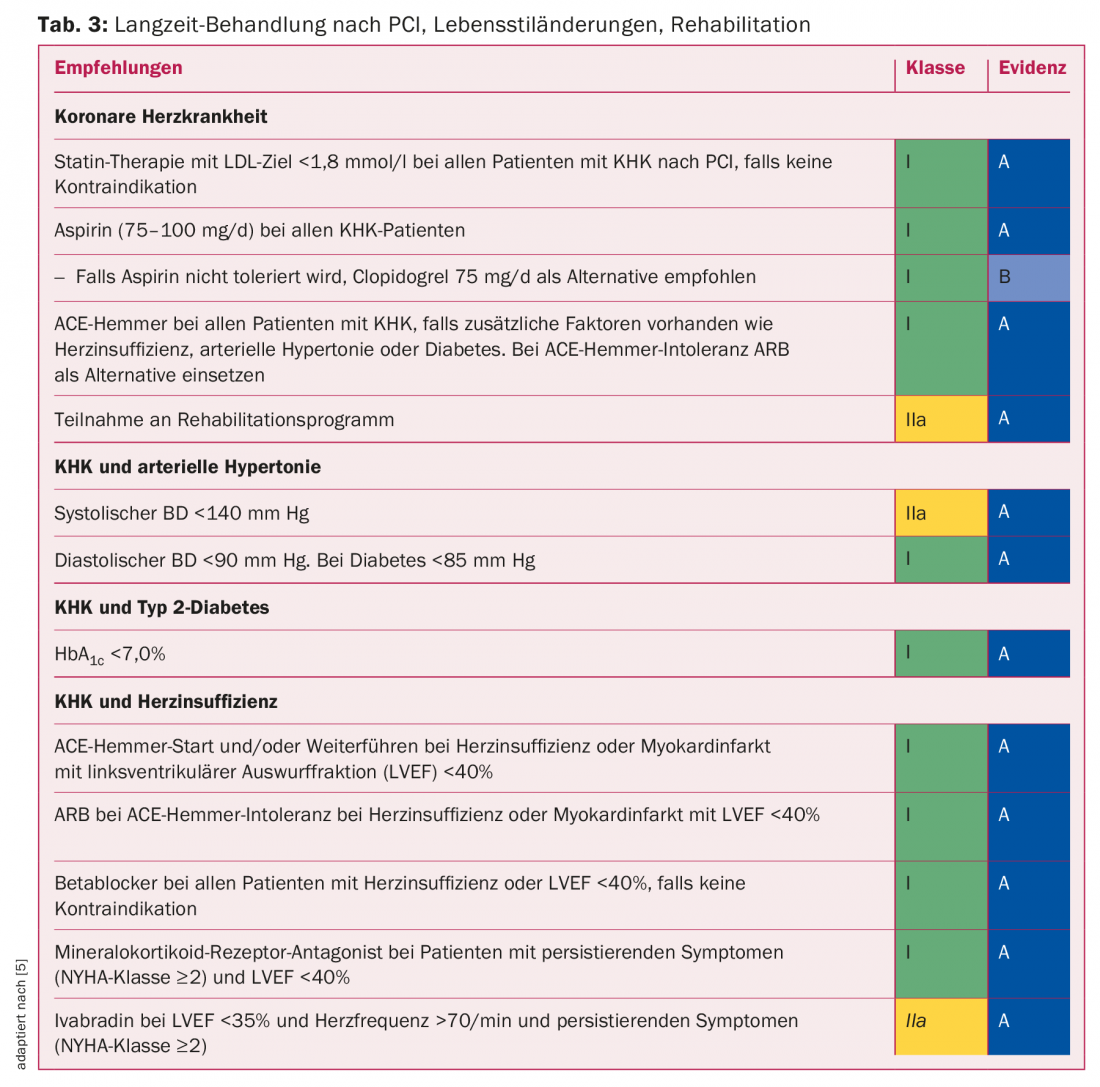
I cambiamenti dello stile di vita, come smettere di fumare, fare più attività fisica, controllare il peso, nutrirsi, gestire lo stress e altri, sono ancora più difficili da attuare rispetto alle misure farmacologiche. La riabilitazione ambulatoriale o ospedaliera, subito dopo l’intervento di rivascolarizzazione, fornisce istruzioni e supporto per l’implementazione di cambiamenti nello stile di vita e la reintegrazione del paziente nel suo ambiente precedente. Secondo una recente meta-analisi, la riabilitazione porta a circa il 20% in meno di ricoveri cardiovascolari futuri. Anche la mortalità cardiovascolare può essere influenzata favorevolmente, ossia ridotta di circa un quarto [13]. La riabilitazione cardiaca è economicamente vantaggiosa ed è una delle prestazioni obbligatorie dell’assicurazione sanitaria obbligatoria.
Seguito consigliato
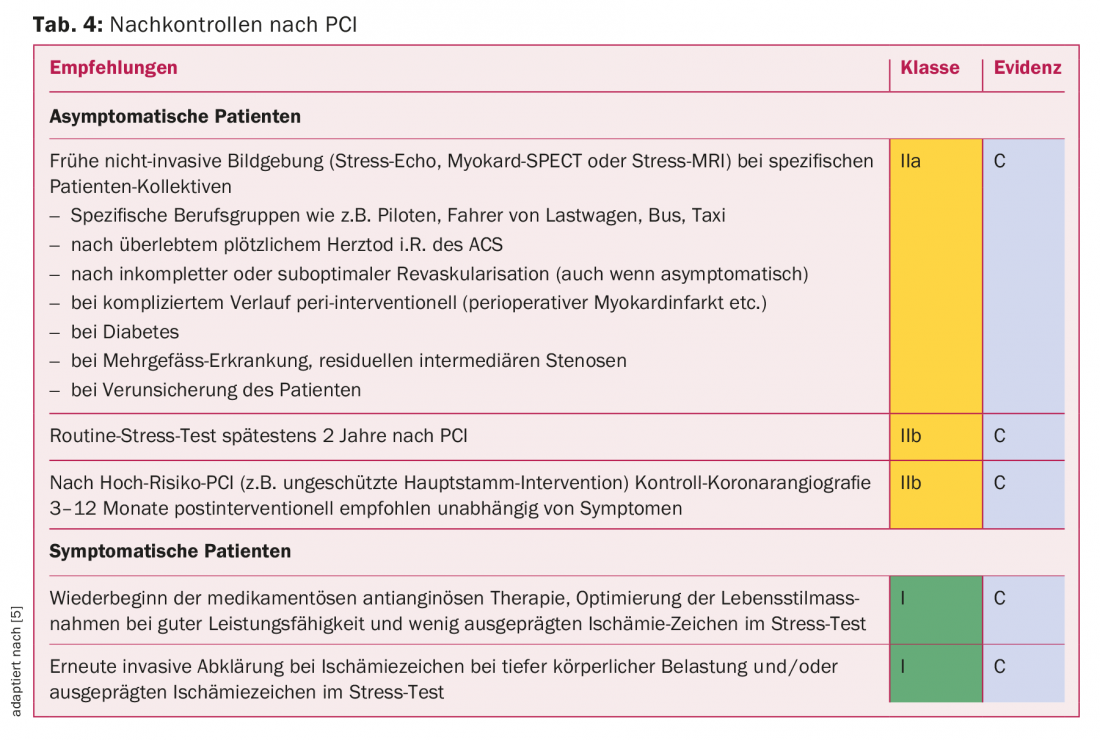
Esistono raccomandazioni relative al follow-up, ma non sono molto basate sull’evidenza a causa della mancanza di studi più ampi. Grazie al miglioramento delle prestazioni dei moderni DES, l’ISR è oggi relativamente rara (<5% dei casi) e la riischemia è per lo più un segno di progressione della CHD. Il focus del follow-up non è solo sulla recidiva dell’ischemia coronarica, ma anche sull’ottimizzazione individuale del profilo di rischio cardiovascolare e sull’adeguamento della terapia antitrombotica. Gli aspetti aggiuntivi più importanti sono riassunti nella tabella 4.
Messaggi da portare a casa
- Con i moderni stent a rilascio di farmaco, il tasso medio di trombosi dello stent previsto è ora inferiore all’1% e il tasso di restenosi dello stent è inferiore al 5%.
- Il tipo e la durata della terapia antitrombotica combinata variano relativamente e dipendono principalmente dal contesto clinico (CHD stabile vs. ACS), dalla necessità di un’ulteriore anticoagulazione (ad esempio, fibrillazione atriale) e dal rischio di sanguinamento specifico del paziente.
- Prevenzione secondaria sostenuta con l’inclusione di una patologia cardiaca.
- La riabilitazione è parte integrante della gestione dopo la rivascolarizzazione, migliorando la prognosi a lungo termine e riducendo la ricorrenza dei sintomi ischemici.
- Secondo l’opinione degli esperti, il monitoraggio medico continuo dei pazienti con CHD dopo la PCI è importante per supportare l’attuazione di una prevenzione secondaria ottimale e il rilevamento precoce di una restenosi istintiva rilevante o della progressione della CHD.
Letteratura:
- Gruentzig A: Dilatazione transluminale della stenosi coronarica. Lancet 1978; 1(8058): 263.
- Stefanini GG, Holmes DR Jr: Stent coronarici a rilascio di farmaco. N Engl J Med 2013; 368(3): 254-265.
- Piepoli MF, et al: Linee guida europee 2016 sulla prevenzione delle malattie cardiovascolari nella pratica clinica. Eur Heart J 2016; 37: 2315-2381.
- Byrne RA, Johner, Kastrati A: Trombosi dello stent e restenosi: cosa abbiamo imparato e dove stiamo andando? La Conferenza Andreas Gruentzig ESC 2014. Eur Heart J 2015; 36: 2608-2620.
- Autori/Membri della task force: Linee guida ESC/EACTS 2014 sulla rivascolarizzazione miocardica. La Task Force sulla rivascolarizzazione miocardica della Società Europea di Cardiologia (ESC) e dell’Associazione Europea di Chirurgia Cardio-Toracica (EACTS). Eur Heart J 2014; 35: 2541-2619.
- Wiviott SD, et al: Triton-TIMI 38 Investigators: Prasugrel rispetto a clopidogrel nei pazienti con sindromi coronariche acute. New Engl J Med 2007; 357: 2001-2015.
- Wallentin L, et al.: Investigatori PLATO. Ticagrelor rispetto a clopidogrel nei pazienti con sindromi coronariche acute. N Engl J Med 2009; 361: 1045-1057.
- Bhatt DL, et al: Investigatori del Registro REACH. Determinanti comparativi dei tassi di eventi cardiovascolari a 4 anni in pazienti ambulatoriali stabili a rischio o con aterotrombosi. JAMA 2010; 304(12): 1350-1357.
- Costa F, et al: Derivazione e validazione del punteggio di previsione delle complicanze emorragiche nei pazienti sottoposti a impianto di stent e successiva terapia antipiastrinica duale (PRECISE-DAPT): un’analisi congiunta di set di dati individuali di studi clinici. Lancet 2017; 389: 1025-1034.
- Van Diepen S, et al: Mortalità e riammissione dei pazienti con insufficienza cardiaca, fibrillazione atriale o malattia coronarica sottoposti a chirurgia non cardiaca: un’analisi di 38.047 pazienti. Circolazione 2011; 124(3): 289-296.
- Gibson CM, et al: Prevenzione del sanguinamento nei pazienti con fibrillazione atriale sottoposti a PCI. New Engl J Med 2016; 375(25): 2423-2434.
- Rickli H, et al: Angina pectoris stabile: terapia farmacologica vs. stent. Il medico informato 2017; 2.
- Tada T, et al: Rischio di trombosi dello stent tra stent di metallo nudo, stent a rilascio di farmaco di prima generazione e stent a rilascio di farmaco di seconda generazione: risultati di un registro di 18.334 pazienti. JACC Cardiovasc Interv 2013; 6: 1267-1274.
CARDIOVASC 2017; 16(3): 15-19











