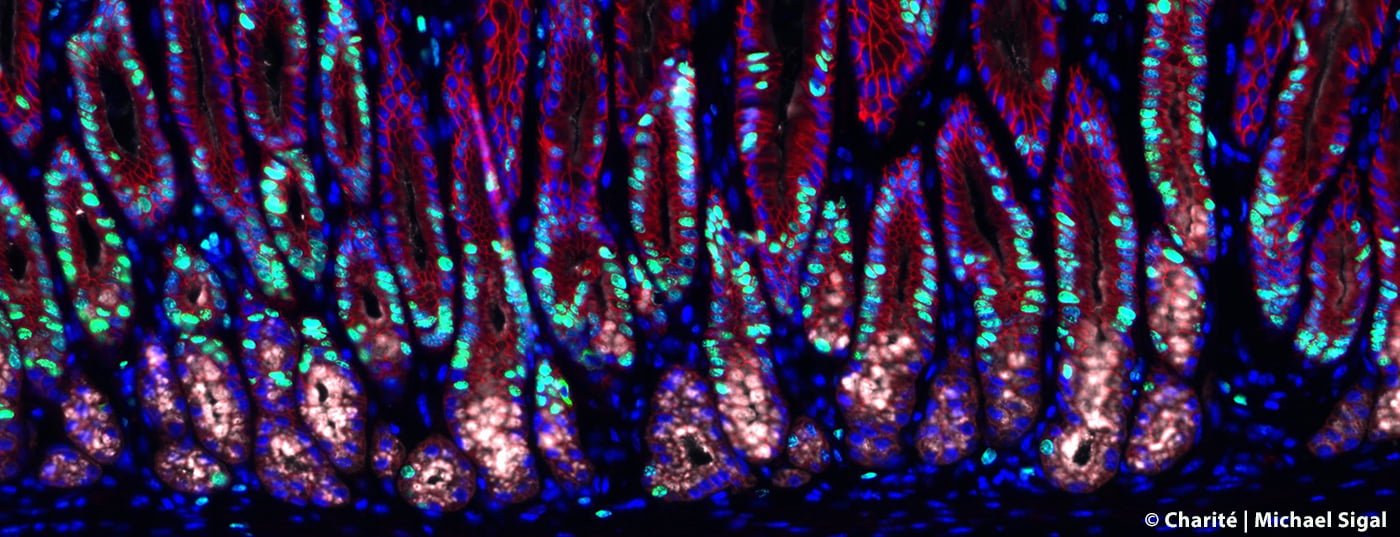
L’infezione del rivestimento dello stomaco con il batterio Helicobacter porta all’infiammazione dello stomaco e aumenta anche il rischio di cancro allo stomaco. Un team di ricerca della Charité – Universitätsmedizin di Berlino e del Centro Max Delbrück per la Medicina Molecolare dell’Associazione Helmholtz (MDC) è stato in grado di chiarire i cambiamenti caratteristici delle ghiandole gastriche nel corso di un’infezione. Gli scienziati hanno trovato un meccanismo precedentemente sconosciuto che limita la divisione cellulare nei tessuti sani e quindi protegge dallo sviluppo del cancro. Tuttavia, un’infezione allo stomaco annulla questo aspetto e le cellule possono crescere in modo incontrollato.
La colonizzazione dello stomaco con l’Helicobacter pylori si verifica in circa la metà dell’umanità nel mondo. Questo la rende una delle infezioni batteriche croniche più comuni. Di conseguenza, si può sviluppare un’infiammazione dello stomaco o un cancro allo stomaco. A causa del contatto costante con l’acido gastrico, il rivestimento sano dello stomaco si rinnova completamente nel giro di poche settimane, mentre la sua struttura e la sua composizione rimangono sempre invariate. “Fino ad ora, si pensava che un’infezione da Helicobacter danneggiasse direttamente le cellule ghiandolari della mucosa gastrica”, spiega il Prof. Dr. Michael Sigal, leader del gruppo di ricerca Emmy Noether presso la Clinica Medica Charité, con particolare attenzione all’epatologia e alla gastroenterologia, e presso l’Istituto di Biologia dei Sistemi Medici di Berlino (BIMSB), che fa parte del Centro Max Delbrück per la Medicina Molecolare dell’Associazione Helmholtz (MDC). “Il nostro team ha scoperto che le complesse interazioni di diverse cellule e i segnali che assicurano la stabilità dei tessuti sono interrotti dall’infezione”.
Per tracciare i cambiamenti nelle ghiandole gastriche causati dall’infezione da Helicobacter, il team di ricerca, insieme agli scienziati dell’Istituto Max Planck per la Biologia delle Infezioni, ha utilizzato modelli di topi complessi in cui cellule specifiche delle ghiandole gastriche possono essere visualizzate, isolate e studiate in dettaglio utilizzando tecnologie all’avanguardia come l’imaging e il sequenziamento di singole cellule sul tessuto. Inoltre, hanno sviluppato in laboratorio speciali microstrutture simili a organi – i cosiddetti organoidi – per poter limitare l’uso di modelli animali. Con l’aiuto di questi minuscoli stomaci in miniatura, hanno potuto ricreare molte delle proprietà delle ghiandole e studiare l’influenza di diversi segnali sulle cellule staminali presenti, che possono dare origine a diversi tipi di cellule.
“Abbiamo scoperto che le cosiddette cellule stromali che circondano le ghiandole non sono – come si pensava in precedenza – responsabili solo della stabilità meccanica. Producono anche sostanze messaggere che hanno un’influenza significativa sul comportamento delle ghiandole”, descrive il Prof. Sigal. Queste sostanze messaggere comprendono anche la “proteina morfogenetica dell’osso” (BMP), importante per lo sviluppo dei tessuti. I ricercatori sono riusciti a dimostrare che le cellule stromali che circondano la base della ghiandola sopprimono continuamente la via di segnalazione BMP e quindi stimolano la divisione delle cellule staminali in quel punto. Al contrario, le cellule stromali all’estremità della ghiandola attivano la via di segnalazione e quindi impediscono la divisione cellulare. Questa influenza dell’ambiente è la base della struttura stabile della ghiandola. L’infezione da Helicobacter porta al rilascio di sostanze infiammatorie come l’interferone-gamma (IFN-γ). Nel corso di questa reazione infiammatoria, vengono prodotte maggiori sostanze messaggere che stimolano la divisione cellulare delle cellule staminali nelle ghiandole. Questo porta alla fine alla cosiddetta iperplasia, cioè all’ingrossamento del tessuto e allo sviluppo di lesioni precancerose.
“I nostri risultati dimostrano che l’infezione e l’infiammazione associata hanno molti più effetti nei tessuti di quanto si pensasse in precedenza: le sostanze infiammatorie classiche come l’IFN-γ non solo hanno un effetto antimicrobico diretto, ma influenzano anche la divisione cellulare e il comportamento delle cellule staminali nei tessuti. In caso di danno tissutale, la divisione cellulare rapida può essere molto utile per consentire una guarigione rapida. Tuttavia, in caso di infiammazione cronica nel corso di un’infezione da Helicobacter, potrebbe favorire lo sviluppo di precursori del cancro”, riassume il Prof. Sigal. Le vie di segnalazione nell’interazione tra il sistema immunitario e le cellule staminali, che potrebbero essere significative anche per gli organi diversi dallo stomaco, rappresentano quindi un punto di partenza per nuove terapie – sia nella prevenzione del cancro che nella medicina rigenerativa.
Fonte originale:
Kapalczynska M, et al.: Schmidt F, et al.: Il ciclo feed-forward delle BMP promuove la differenziazione terminale nelle ghiandole gastriche e viene interrotto dall’infiammazione guidata dall’H. pylori. Nature Communication 2022; doi: 10.1038/s41467-022-29176-w.