Uno studio recente ha analizzato l’accordo tra la variabilità della frequenza cardiaca derivata dal segnale fotopletismografico di uno smartwatch disponibile in commercio e la variabilità della frequenza cardiaca derivata dall’elettrocardiogramma ad alta risoluzione (gold standard) nei pazienti con malattie cardiovascolari.
La variabilità della frequenza cardiaca (HRV) riflette la variazione degli intervalli del battito cardiaco ed è un comprovato strumento non invasivo per valutare lo stato funzionale del sistema nervoso autonomo cardiaco [2]. La disfunzione del sistema nervoso autonomo, spesso caratterizzata da un’iperattività del sistema nervoso simpatico e dal ritiro vagale, svolge un ruolo chiave nella patogenesi di varie malattie cardio- e cerebrovascolari ed è quindi associata a una prognosi peggiore [3,4]. Di conseguenza, le misurazioni dell’HRV sono state proposte per la previsione del rischio nei pazienti con malattie cardiovascolari, tra cui l’infarto del miocardio, l’insufficienza cardiaca cronica, il diabete mellito, l’ictus ischemico e altri [5–8].
Partendo dalle tradizionali misurazioni standard dell’HRV nel dominio del tempo e della frequenza, è stata sviluppata una varietà di misurazioni non standard [9], che comprendono, tra l’altro, i marcatori di complessità a breve termine [10], l’entropia [11] e l’analisi del grafico di Poincare [12], la capacità di decelerazione (DC) [13] e la turbolenza della frequenza cardiaca [14]. Sebbene alcune di queste misure abbiano mostrato risultati promettenti come predittori di rischio in ampi studi clinici, la HRV non è stata quasi mai utilizzata nella pratica clinica.
Anche una registrazione di 5 minuti dell’elettrocardiogramma (ECG) consente di analizzare l’HRV [2]. Tuttavia, ai fini della previsione del rischio, l’analisi HRV viene solitamente eseguita con registrazioni ECG più lunghe, soprattutto quando si valutano i parametri HRV che catturano le componenti a bassa frequenza dell’HRV. Questo può limitare l’applicabilità dell’HRV nella vita quotidiana, soprattutto se l’HRV deve essere utilizzato come strumento di monitoraggio continuo in ambito ambulatoriale. Con alcune limitazioni, l’HRV può essere calcolato anche dalle registrazioni fotopletismografiche (PPG) delle onde del polso [15]. La crescente prevalenza di indossabili con sensori PPG integrati nella popolazione potrebbe quindi rendere l’analisi HRV basata su PPG con dispositivi intelligenti disponibili in commercio un promettente approccio futuro. Due piccoli studi su popolazioni sane hanno già dimostrato la fattibilità generale dei marcatori HRV basati su smartwatch [16,17]. Tuttavia, non si conosce l’accuratezza dell’HRV derivato dallo smartwatch e basato sul PPG in popolazioni più ampie con malattie cardiovascolari o cerebrovascolari che potrebbero trarre beneficio dal monitoraggio continuo del rischio.
L’obiettivo di un recente studio è stato quindi quello di determinare l’accuratezza dei marcatori HRV standard e non standard calcolati dalle registrazioni PPG di uno smartwatch disponibile in commercio rispetto alle metriche HRV derivate dall’ECG in un numero rilevante di pazienti con malattie cardio- e cerebrovascolari [1].
Disegno dello studio e partecipanti
Lo studio ha incluso tre diverse coorti che si sono presentate in un ambulatorio di cardiologia tra giugno 2021 e luglio 2022: Pazienti dopo infarto miocardico con innalzamento del tratto ST (coorte STEMI), pazienti dopo ictus ischemico (coorte STROKE) e pazienti senza malattia cardiovascolare strutturale nota (coorte CONTROL).
I criteri di inclusione per la coorte STEMI erano i pazienti con un primo STEMI trattato con un intervento coronarico percutaneo primario entro 24 ore dalla comparsa dei sintomi. I criteri di inclusione per la coorte STROKE erano i pazienti con ictus ischemico acuto confermato dalla tomografia computerizzata o dalla risonanza magnetica con insorgenza dei sintomi entro 30 giorni prima del ricovero in ospedale. La coorte CONTROL comprendeva pazienti senza una storia nota di malattia cardiovascolare strutturale manifesta. I criteri generali di inclusione includevano un’età ≥18 anni e la presenza di ritmo sinusale. Sono stati esclusi i pazienti con frequenti battiti ventricolari prematuri (>10% dei battiti totali) o di scarsa qualità.
Registrazioni ed elaborazione del segnale
L’ECG e il PPG sono stati registrati simultaneamente per 30 minuti in tutti i soggetti. Le registrazioni sono state effettuate in condizioni standardizzate in posizione supina e con respirazione spontanea. Gli stimoli esterni (rumore, ecc.) sono stati ridotti al minimo e i pazienti sono stati istruiti a rilassarsi.
Dei 282 soggetti che avevano registrazioni simultanee di ECG e PPG, 263 soggetti hanno soddisfatto i criteri di inclusione e sono stati arruolati nello studio. Di questi, 104 hanno avuto uno STEMI, 129 un ictus e 30 erano nella coorte CONTROL. L’età media della coorte totale era di 61 anni e 71 (27%) erano donne. Il tempo di registrazione mediano è stato di 32,1 minuti. Nelle coorti STEMI e STROKE, le registrazioni sono state effettuate rispettivamente tre e cinque giorni dopo gli eventi indice. Le misure HRV erano significativamente più basse nelle coorti STEMI e STROKE rispetto alla coorte CONTROL (P <0,05 per tutte, tranne DF-α2).
Valutazione della variabilità della frequenza cardiaca
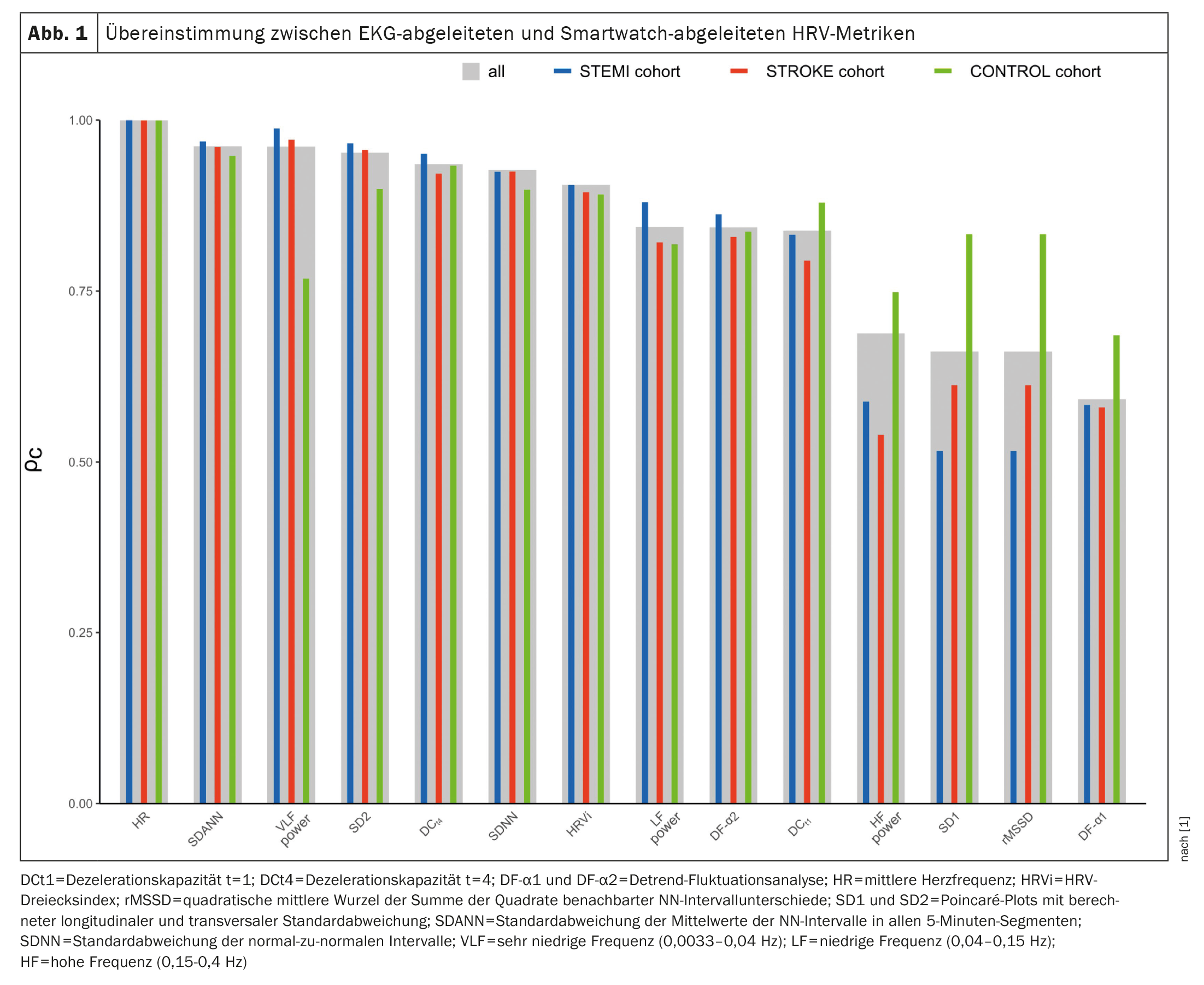
L’accordo tra le misurazioni PPG ed ECG è stato valutato utilizzando il coefficiente di correlazione di concordanza di Lin (ρc), il coefficiente di correlazione intraclasse (ICC; modello di effetti misti a due vie), l’errore assoluto medio (MAE), l’errore percentuale assoluto medio (MAPE) e i diagrammi Bland-Altman con i bias calcolati e i limiti di accordo (LoA). Le concordanze tra le metriche HRV derivate dall’ECG e dal PPG sono mostrate nella Figura 1 [1]. Le concordanze più elevate sono state osservate per la frequenza cardiaca media (ρc=0,9998), SDANN (ρc=0,9617), potenza VLF (ρc = 0,9613) e SD2 (ρc=0,9523). Al contrario, SD1 (ρc=0,6617), rMSSD (ρc=0,6617) e DF-α1 (ρc=0,5919) hanno mostrato il minor accordo. Per la potenza RF, le concordanze SD1, rMSSD e DF-α1 erano più basse nelle coorti STEMI e STROKE rispetto ai controlli. Per tutti gli altri marcatori, le concordanze erano simili tra le tre coorti. I coefficienti di correlazione intraclasse variavano da 0,6318 per il DF-α1 a 0,9998 per la frequenza cardiaca media. L’accordo è stato valutato eccellente per sette (50%), buono per tre (21%), moderato per quattro (29%) e scarso per nessuno dei marcatori. Non è stato possibile osservare alcuna deviazione sistematica, con deviazioni vicine allo zero in tutte le analisi. Un accordo quasi perfetto è stato trovato per VLF e SD2, mentre DCt4, SDNN, SDANN, HRVi e DF-α2 hanno mostrato un notevole accordo. Al contrario, è stato trovato solo un basso livello di accordo per rMSSD e SD1.
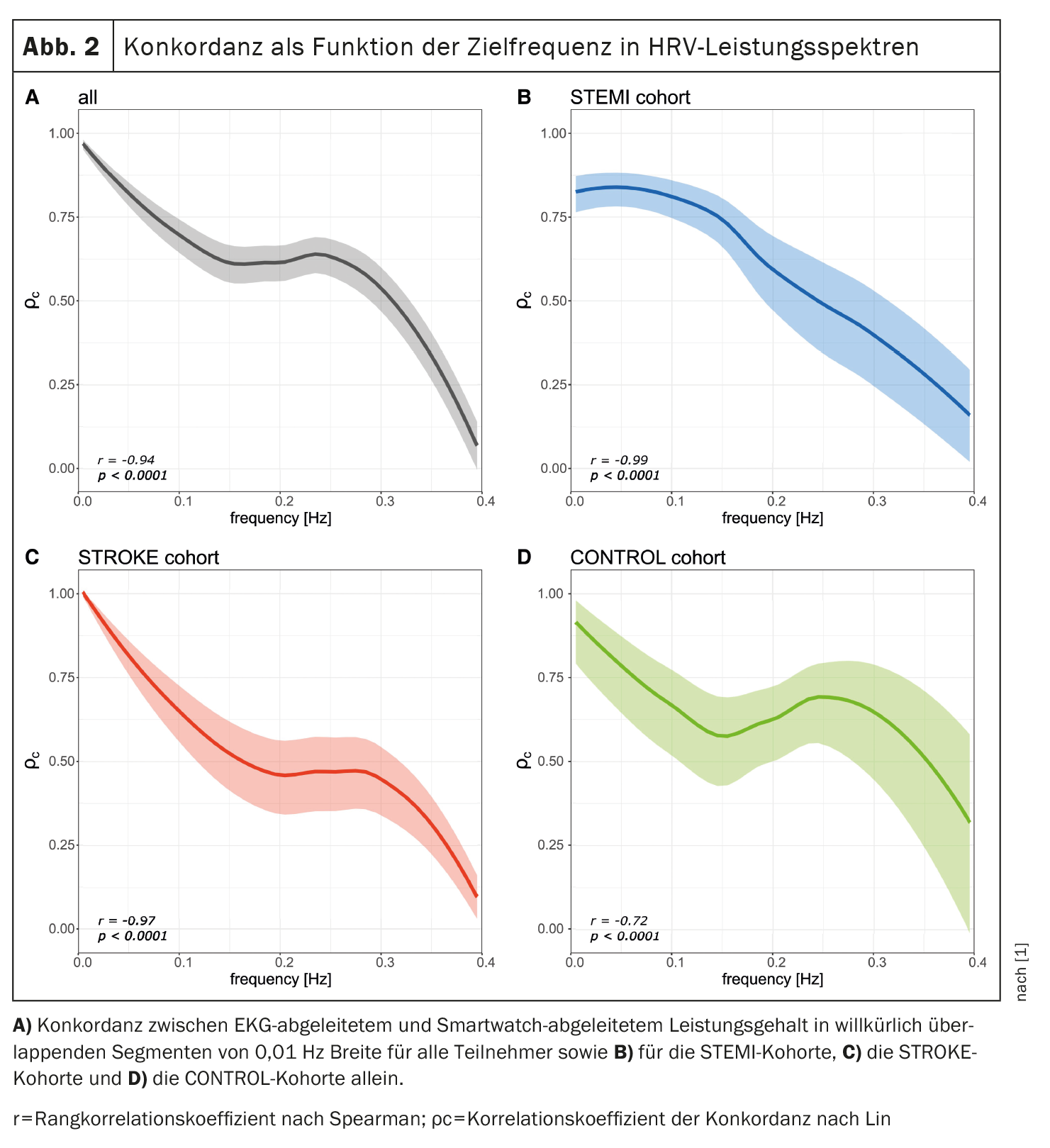
Inoltre, è stata calcolata la concordanza tra il contenuto di potenza derivato dall’ECG e dal PPG in bande di frequenza arbitrariamente sovrapposte, per valutare una possibile relazione tra la frequenza spettrale dell’HRV e la rispettiva concordanza. Come mostrato nella Figura 2 [1], è stata osservata una relazione inversa tra la frequenza spettrale HRV e la concordanza tra le metriche HRV derivate dall’ECG e dal PPG (r=-0,94, p<0,0001). Questa tendenza è stata osservata in tutte e tre le coorti.
I parametri HR derivati dallo smartwatch offrono una pratica alternativa
In sintesi, lo studio fornisce prove sufficienti che il calcolo dei marcatori HRV dal segnale PPG di uno smartwatch è possibile in condizioni di riposo. L’accordo tra l’HRV derivato dallo smartwatch e l’HRV derivato dall’ECG ad alta risoluzione è eccellente per i parametri a bassa frequenza, ma solo moderato per le metriche ad alta frequenza, soprattutto nei pazienti con malattie cardio- o cerebrovascolari note. Sono necessari studi futuri per convalidare questi risultati in situazioni reali.
Letteratura:
- Theurl F, et al.: Variabilità della frequenza cardiaca derivata dallo smartwatch: un confronto testa a testa con il gold standard nelle malattie cardiovascolari. European Heart Journal 2023; doi: https://doi.org/10.1093/ehjdh/ztad022.
- Task Force dell’ESC: Standard di misurazione della variabilità della frequenza cardiaca, interpretazione fisiologica e uso clinico. Circolazione 1996; 93:1043-1065.
- Corr P, et al: Meccanismi di controllo della funzione autonoma cardiaca e loro relazione con l’aritmogenesi. New York: Raven Press; 1986.
- Lown B, Verrier RL: Attività neurale e fibrillazione ventricolare. N Engl J Med 1976; 294: 1165-1170.
- Kleiger RE, et al: Diminuzione della variabilità della frequenza cardiaca e sua associazione con l’aumento della mortalità dopo un infarto miocardico acuto. Am J Cardiol 1987; 59: 256-262.
- Adamson PB, et al: Valutazione autonomica continua nei pazienti con insufficienza cardiaca sintomatica: valore prognostico della variabilità della frequenza cardiaca misurata da un dispositivo di risincronizzazione cardiaca impiantato. Circulation 2004; 110: 2389-2394.
- Gerritsen J, et al: Una funzione autonomica compromessa è associata ad un aumento della mortalità, soprattutto nei soggetti con diabete, ipertensione o una storia di malattia cardiovascolare: lo studio Hoorn. Diabetes Care 2001; 24: 1793-1798.
- Yperzeele L, et al: Variabilità della frequenza cardiaca e sensibilità barorecettoriale nell’ictus acuto: una revisione sistematica. Int J Stroke 2015; 10: 796-800.
- Sassi R, et al: Progressi nell’analisi del segnale di variabilità della frequenza cardiaca: dichiarazione di posizione congiunta del Gruppo di lavoro e-Cardiology ESC e dell’Associazione Europea del Ritmo Cardiaco co-appoggiata dalla Società del Ritmo Cardiaco dell’Asia Pacifica. Europace 2015; 17: 1341-1353.
- Peng CK, et al.: Quantificazione degli esponenti di scala e dei fenomeni di crossover nelle serie temporali non stazionarie del battito cardiaco. Chaos 1995; 5: 82-87.
- Richman JS, Moorman JR: Analisi delle serie temporali fisiologiche utilizzando l’entropia approssimativa e l’entropia del campione. Am J Physiol Heart Circ Physiol 2000; 278: H2039-H2049.
- Huikuri HV, et al: Anomalie nella dinamica da battito a battito della frequenza cardiaca prima dell’insorgenza spontanea di tachiaritmie ventricolari pericolose per la vita in pazienti con infarto miocardico precedente. Circulation 1996; 93: 1836-1844.
- Bauer A, et al: Capacità di decelerazione della frequenza cardiaca come predittore di mortalità dopo un infarto miocardico: studio di coorte. Lancet 2006; 367: 1674-1681.
- Schmidt G, et al: La turbolenza della frequenza cardiaca dopo i battiti prematuri ventricolari come predittore di mortalità dopo un infarto miocardico acuto. Lancet 1999; 353: 1390-1396.
- Vescio B, et al.: Confronto tra rilevamento elettrocardiografico e fotopletismografico del polso al lobo dell’orecchio per valutare la variabilità della frequenza cardiaca in soggetti sani in registrazioni a breve e lungo termine. Sensors (Basel) 2018; 18: 844.
- Hernando D, et al.: Validazione dell’Apple Watch per la misurazione della variabilità della frequenza cardiaca durante il rilassamento e lo stress mentale in soggetti sani. Sensors (Basel) 2018; 18:2619.
- Miller DJ, Sargent C, Roach GD: Una validazione di sei dispositivi indossabili per stimare il sonno, la frequenza cardiaca e la variabilità della frequenza cardiaca in adulti sani. Sensori (Basilea) 2022; 22: 6317.
CARDIOVASC 2023; 22(3): 46-48