La diagnosi del versamento pleurico è molto complessa, perché una varietà di condizioni mediche può causare il versamento pleurico. La distinzione più importante è quella tra versamenti transudativi ed essudativi e le loro cause. I parametri chimici di laboratorio e gli esami citologici sono di aiuto in questo caso. A seconda della causa, si può iniziare un’ulteriore terapia. Per questo sono disponibili numerosi metodi, dalla semplice puntura di decompressione al drenaggio pleurico e alla toracoscopia.
In quanto pelle sierosa che ricopre i polmoni, la pleura è una parte importante della meccanica respiratoria del sistema complessivo. Un sottile strato di liquido è necessario per garantire che i fogli pleurici scivolino facilmente l’uno sull’altro e quindi sui polmoni all’interno del torace. Ciò consente una rapida trasmissione della forza dai muscoli respiratori e l’escursione toracica ai polmoni. Il polmone stesso è accoppiato alla parete toracica da questo fluido. Le cellule mesoteliali della pleura hanno un ruolo passivo nella lubrificazione del sistema respiratorio da un lato e un ruolo attivo nella formazione di macromolecole, citochine infiammatorie, fattori di crescita e peptidi chemiotattici dall’altro. Una funzione importante è il trasporto attivo di proteine, fluido linfatico e cellule attraverso la sierosa, nonché l’assorbimento di fluidi accoppiati agli elettroliti.
Cambiamento della permeabilità pleurica a causa di processi patologici
In caso di infiammazione della pleura e/o delle strutture polmonari adiacenti, si verifica una perdita di proteine nello spazio pleurico a causa di cambiamenti nelle cellule mesoteliali e nella struttura della superficie pleurica. Le forze trainanti dell’accumulo di fluidi sono l’aumento della pressione idrostatica, la diminuzione della pressione oncotica e l’alterazione della rimozione del fluido linfatico. La permeabilità pleurica è alterata dal contatto con batteri, lipopolisaccaridi, trombina [1]. Questo contatto aumenta la secrezione di VEGF nelle cellule mesoteliali, che è un potente mediatore dell’aumento della permeabilità [2].
Clinica e presentazione
I sintomi tipici del versamento pleurico sono dolore al petto, tosse e dispnea. Il dolore pleuritico ha origine nella pleura parietale, perché né la pleura viscerale né i polmoni hanno recettori del dolore. In genere, si tratta di un dolore grave e di rapida insorgenza, con irradiazione alla spalla e all’addome superiore. Quando il versamento pleurico aumenta, il dolore di solito diminuisce. La tosse nelle malattie pleuriche è un sintomo aspecifico, piuttosto secco e persistente e associato alla mancanza di respiro. La dispnea deriva inizialmente da febbre e dolore e da versamenti in rapido aumento dovuti alla compressione dei polmoni. In genere, la dispnea è dipendente dalla posizione [3].
Imaging diagnostico
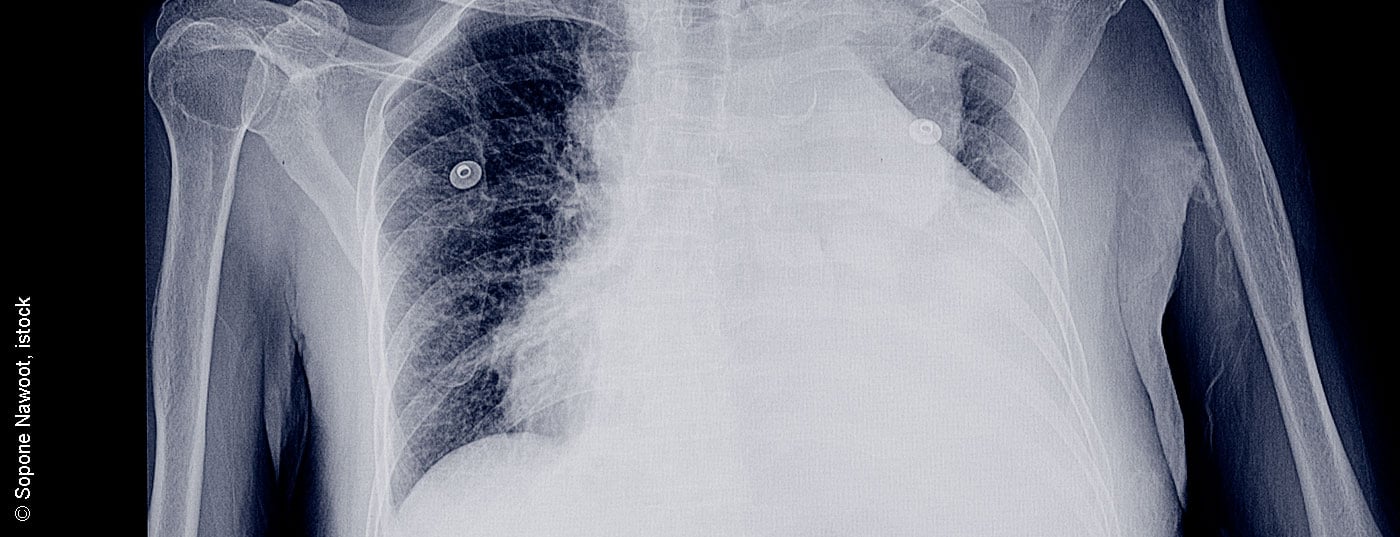
Il versamento pleurico e le malattie pleuriche possono essere rilevati e chiariti ulteriormente con tutte le procedure radiologiche. Le radiografie toraciche postero-anteriori possono mostrare versamenti superiori a 200 ml, anche se spesso i versamenti più grandi possono essere ignorati dalle radiografie toraciche. La TAC è già in grado di rilevare un’effusione significativamente minore e può riuscire a diagnosticare una serie di patologie concomitanti del polmone e della pleura. Le patologie sottostanti, come polmonite, embolia polmonare, neoplasie toraciche, malattie polmonari interstiziali, patologie pleuriche, nonché patologie cardiache e dell’addome superiore adiacente, possono essere diagnosticate in modo adeguato. La differenziazione di sovrapposizioni benigne e strutture maligne riesce con una sensibilità del 90% [4].
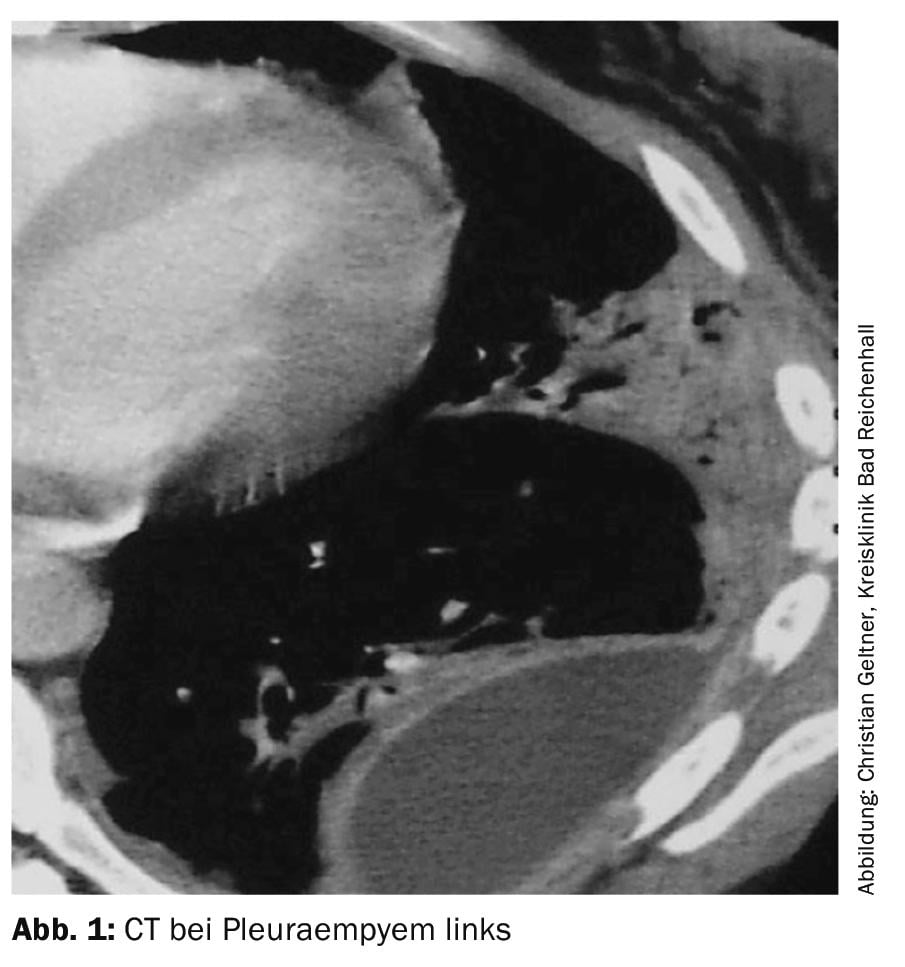
Si deve eseguire una TAC con potenziamento del contrasto e una piccola quantità di liquido residuo (Fig. 1) . I versamenti di grande volume devono essere drenati prima [4].
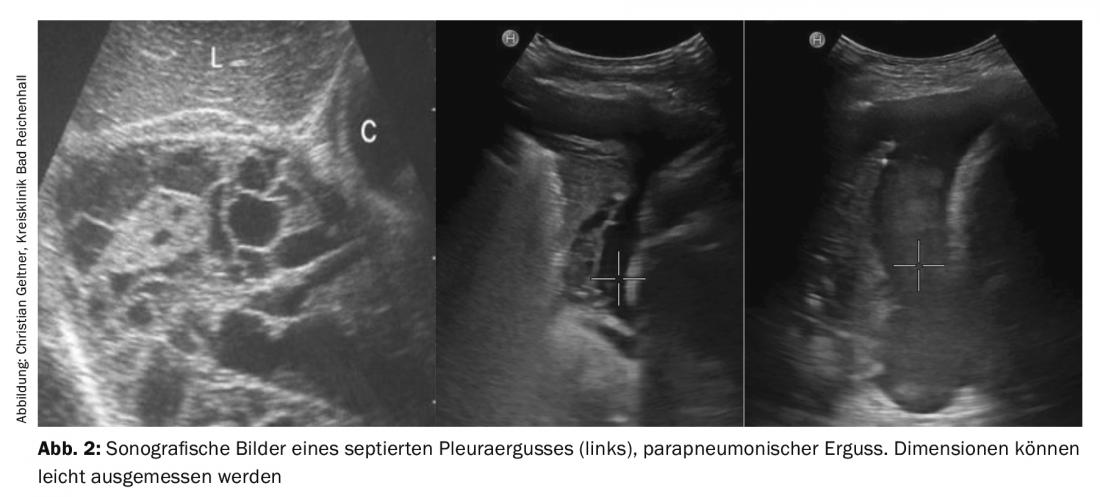
L’ecografia toracica e pleurica è un metodo sicuro e innocuo per diagnosticare e quantificare i versamenti e per evidenziare le malattie concomitanti (Fig. 2). Può anche distinguere tra versamenti parapneumonici semplici e complicati, escrescenze maligne e infiltrazioni polmonari. La risonanza magnetica non dovrebbe essere eseguita di routine. L’unico miglioramento diagnostico riguarda la stadiazione del mesotelioma pleurico accertato [5].
Diagnostica invasiva
Una puntura pleurica (toracocentesi) è necessaria per la diagnosi differenziale in tutti i versamenti pleurici, dopo aver escluso le cause più importanti del trasudato [6]. I versamenti trasudativi non devono essere perforati se la causa è chiara. In questo caso, la causa deve essere trattata prima con i farmaci. Un esame ecografico prima della puntura è utile, in quanto è possibile stimare il sito di puntura e la quantità di puntura. La puntura pleurica è un metodo invasivo di diagnosi molto sicuro. Lo pneumotorace si verifica nel 3-10% circa. Un esame chimico del liquido pleurico di solito può spiegare la causa. La citologia porta a una diagnosi certa nel 60% dei casi di tubercolosi e solo nel 25% dei casi di malignità. Una citologia negativa non esclude un versamento pleurico maligno.
Esistono diverse tecniche di biopsia pleurica per ottenere campioni istologici dalla pleura. Sono stati sviluppati diversi aghi per la biopsia della pleura parietale, che consentono il prelievo di tessuto per l’esame istologico. I rischi in questo caso sono un’emorragia maggiore, uno pneumotorace e una lesione del diaframma e della superficie polmonare. La resa diagnostica è circa dell’80% per la tubercolosi, del 43% per la carcinomatosi pleurica e del 25% per il mesotelioma pleurico maligno [7,8].
La toracoscopia medica come semplice procedura minimamente invasiva ha vissuto una rinascita con lo sviluppo di sistemi ottici di piccole dimensioni e di endoscopi semi-flessibili. Qui è possibile effettuare una biopsia della pleura e del polmone controllata otticamente, con una sensibilità e una specificità diagnostica fino al 98%.
Oltre a ottenere biopsie e resezioni cuneiformi più grandi dei polmoni, la toracoscopia chirurgica video-assistita (VATS) è anche una procedura terapeutica con tutte le possibilità di interventi chirurgici toracici come l’abrasione pleurica, la pleurectomia, la decorticazione e le lob e pneumectomie.
Distinzione tra essudato e trasudato
Nelle effusioni macroscopicamente chiare, bisogna distinguere tra trasudati puri ed essudati. L’analisi chimica del puntato e i criteri secondo Light (misurazione del contenuto di proteine e LDH nel liquido pleurico e nel siero) hanno la massima sensibilità.
Un criterio clinicamente importante è se le effusioni si verificano su uno o entrambi i lati; questo aiuta nella diagnosi differenziale. I transudati sono tipicamente bilaterali, anche se possono verificarsi unilateralmente in circa il 20% dei casi. I versamenti infiammatori di solito si verificano sul lato della patologia, con l’eccezione principale delle malattie sistemiche (come nelle collagenosi o nei carcinomi metastatici).
Il versamento pleurico transudativo
I versamenti trasudativi sono causati da variazioni di pressione nella pleura. Un aumento dell’afflusso di fluido nella pleura, da un lato, e una diminuzione del deflusso di fluido, dall’altro, si verificano con un aumento della pressione venosa nella circolazione sistemica (insufficienza cardiaca destra), nella circolazione polmonare (insufficienza cardiaca sinistra), nella circolazione portale (cirrosi epatica) o con una diminuzione della pressione pleurica nell’atelettasia polmonare o nell’embolia polmonare. La quantità di fluido dipende dalle condizioni di pressione modificate e dalla filtrazione attraverso la pleura. Le cause più importanti sono l’insufficienza cardiaca sinistra e la malattia renale con perdita di proteine.
L’essudato nella pleura
La base di qualsiasi essudato è una reazione infiammatoria pleurica. L’infiammazione della pleura può derivare da infezioni o dal coinvolgimento della pleura in una serie di malattie sistemiche. La pleurite infettiva è comune nei casi di coinvolgimento pleurico nel contesto della polmonite. Questo può variare da una semplice pleurite concomitante a versamenti parapneumonici semplici e complicati, fino all’empiema pleurico. Il grado e il tipo di reazione infiammatoria possono essere riconosciuti dal numero e dal tipo di cellule infiammatorie presenti nel liquido pleurico.
Effusioni parapneumoniche
I versamenti parapneumonici si verificano nel 20-40% dei pazienti ricoverati per polmonite. Il rischio di decorso prolungato e di mortalità è significativamente più alto con il verificarsi di un versamento parapneumonico nella polmonite. L’insorgenza di un empiema pleurico senza una precedente polmonite è rara, ma deve essere presa in considerazione in relazione a interventi chirurgici, in seguito a punture iatrogene o in pazienti con grave immunosoppressione. Con una terapia antibiotica sistemica sufficiente e tempestiva, la maggior parte dei versamenti infettivi guarisce. Fondamentalmente, c’è una transizione graduale dall’effusione essudativa parapneumonica all’effusione complicata all’empiema pleurico (tab. 1).
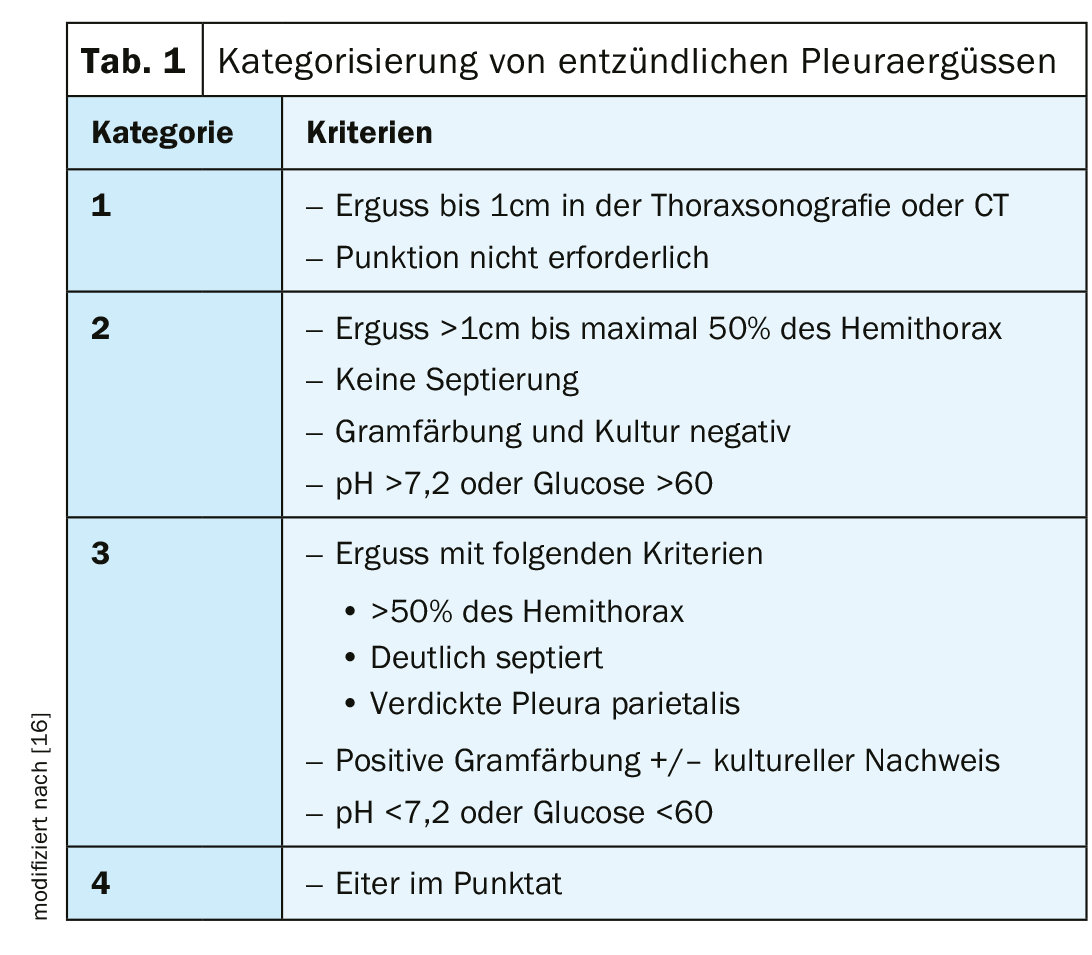
Il primo stadio di un’effusione infiammatoria è l’effusione parapneumonica essudativa a flusso libero; questa è sterile e presenta parametri chimici di laboratorio normali (leucociti, LDH, pH, glucosio). La terapia antibiotica è sufficiente. Con una terapia inadeguata, un semplice versamento può complicarsi in uno stadio fibropurulento. L’immigrazione di batteri e cellule infiammatorie porta a processi infiammatori con un aumento dell’attività di formazione della fibrina, con conseguente formazione di fili di fibrina, setti e ulteriore crescita batterica. Questo mostra un aumento della settatura e dell’organizzazione dell’effusione sulla diagnostica per immagini. I seguenti parametri di laboratorio sono patognomici: pH <7,2, glucosio <60, LDH >1000. La comparsa di pus macroscopicamente visibile si chiama empiema. Ciò comporta l’ostruzione meccanica del polmone, la formazione di setti purulenti, la riformazione dei vasi e l’organizzazione del versamento da parte di fibroblasti e leucociti.
Dopo la chimica per differenziare i trasudati dagli essudati, il work-up citologico dell’effusione è di cruciale importanza diagnostica. I granulociti neutrofili si trovano nelle infezioni batteriche precoci fino all’empiema pleurico. I versamenti linfocitari sono tipici nelle tubercolosi, nelle sarcoidosi, nei linfomi e nelle collagenosi, nonché in tutti i tumori maligni, mentre troviamo versamenti eosinofili nelle embolie polmonari, nelle asbestosi, nelle aspergillosi, nei mesoteliomi e nelle carcinosi pleuriche. I versamenti “vecchi” mostrano un aumento della popolazione di linfociti nel punteggiato [4]. Più cellule infiammatorie ci sono nella pleura, più è probabile che ci siano aderenze, formazione di fibrina, formazione di membrane e aderenze. Nel caso di versamenti parapneumonici, può svilupparsi successivamente un empiema pleurico. In questo caso, la coltura batteriologica è solitamente negativa, poiché spesso sono coinvolti anaerobi, difficili da coltivare.
La graduazione per le effusioni parapneumoniche è la seguente:
- Versamento parapneumonico non complicato: essudato, prevalentemente neutrofilo.
- Effusione parapneumonica complicata: aumento dell’invasione batterica: il pH diminuisce, il glucosio diminuisce, l’LDH aumenta. Si verificano depositi di fibrina e formazione di membrane.
- Empiema = pus nella puntura. In questo caso, di solito è necessario un intervento chirurgico.
Le cause più comuni di essudato sono i versamenti maligni, che si verificano più frequentemente nei bronchi, nei carcinomi mammari o ovarici (tab. 2).
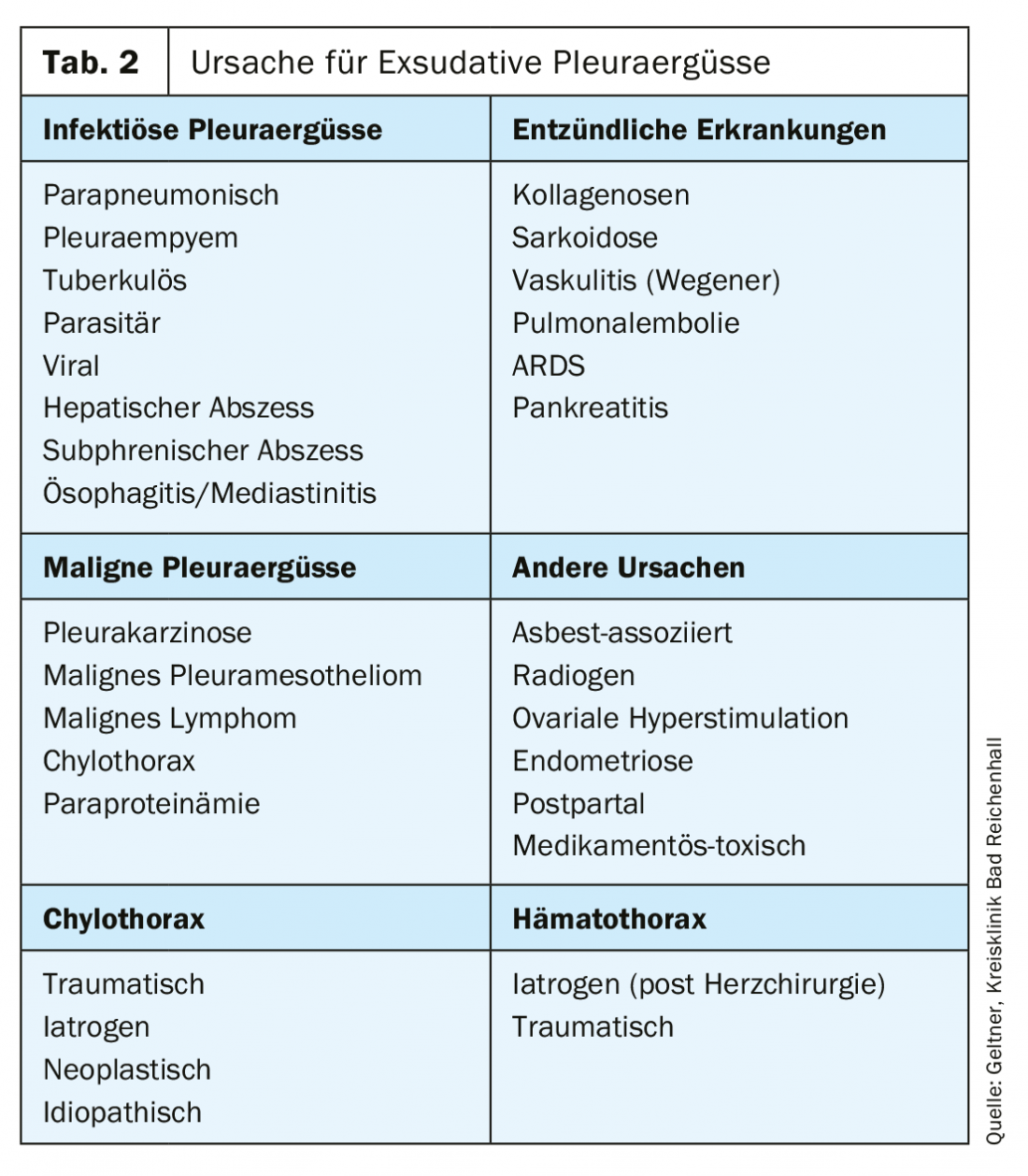
Gestione del versamento pleurico
Il primo passo nella gestione di un’effusione è il work-up diagnostico dell’effusione. La British Medical Society ha sviluppato un algoritmo pratico nelle sue linee guida (Fig. 3).
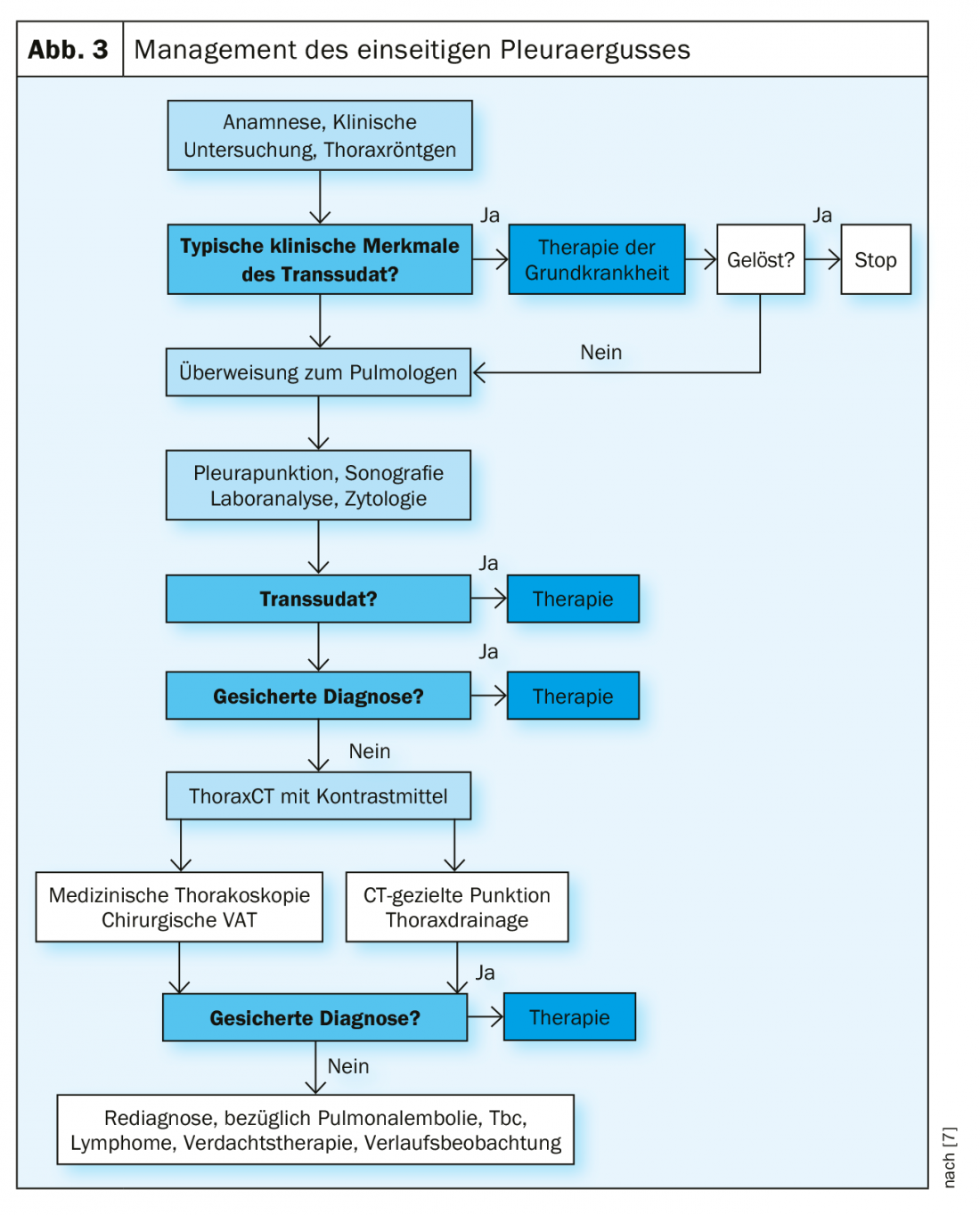
Gestione del versamento maligno
I versamenti maligni e la carcinomatosi pleurica sono una complicanza frequente dei tumori maligni toracici ed extratoracici [9]. Molto spesso sono chiaramente sintomatici e richiedono una terapia palliativa (Fig. 4). La terapia curativa di solito non è più possibile a questo stadio [10].
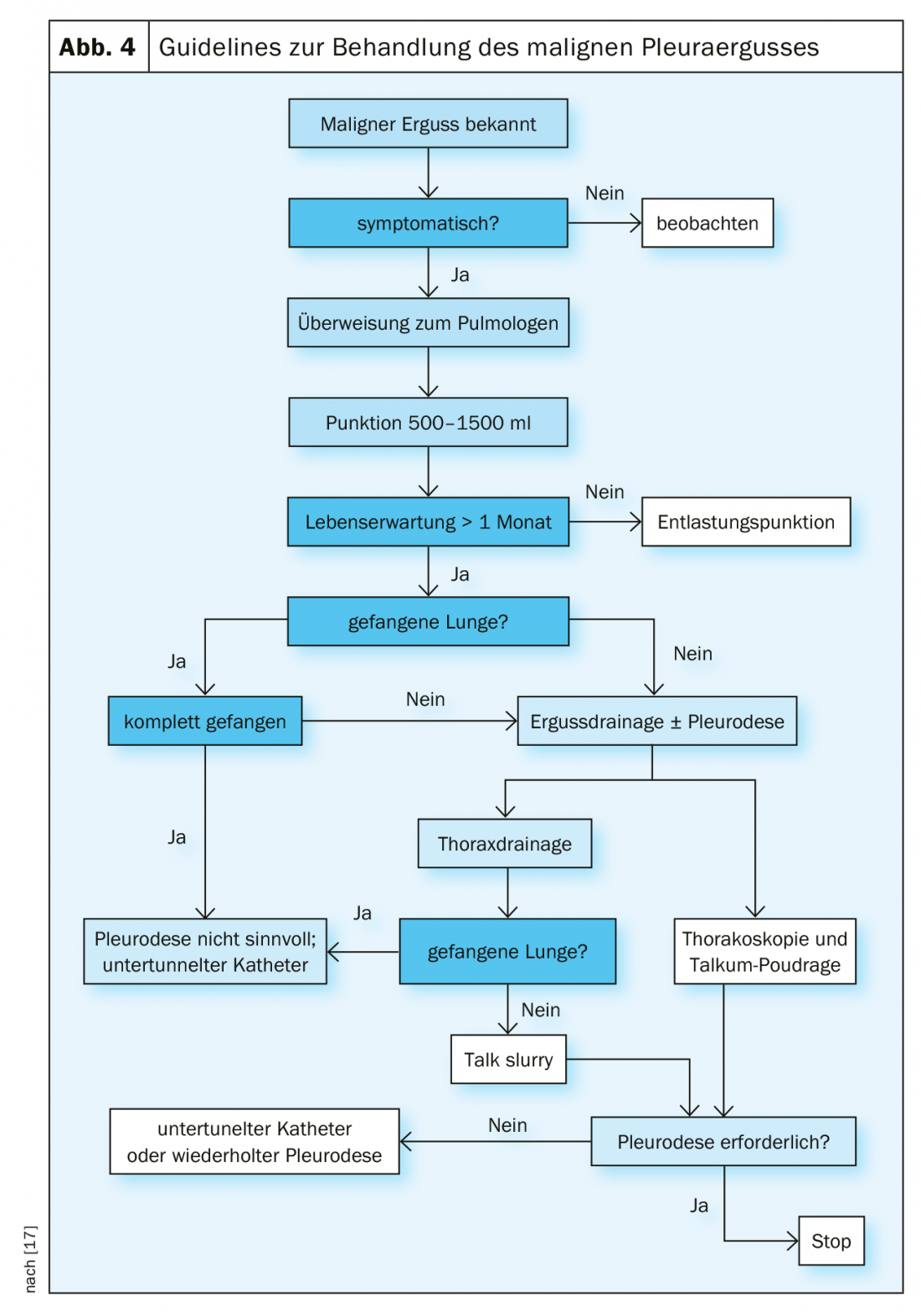
Puntura di scarico: questa procedura è il metodo di prima scelta nei pazienti sintomatici. Le punture ripetute non devono essere eseguite nei pazienti con un’aspettativa di vita superiore a un mese, a causa del rischio di un’aspettativa pleurica e della formazione di un polmone “intrappolato”. In questo caso, si raccomanda di eseguire una pleurodesi. C’è il rischio di edema polmonare da riespansione se vengono scaricati più di 1,5 litri . In questo caso, è preferibile un drenaggio lento o l’inserimento di un drenaggio toracico. La puntura in rilievo ha un alto tasso di recidiva del versamento e un basso rischio di pneumotorace o empiema [11].
Drenaggio toracico: per i pazienti in condizioni generali accettabili e con un’aspettativa di vita superiore a 1 mese, si deve eseguire un drenaggio toracico con successiva pleurodesi. Gli agenti sclerosanti producono un’infiammazione sterile della pleura e aumentano l’attività fibrinolitica. La somministrazione di steroidi riduce l’effetto della pleurodesi. Il talco è la sostanza più efficace e quindi consigliata per la pleurodesi. I farmaci antinfiammatori non steroidei (FANS) sono generalmente possibili dopo la pleurodesi. La gestione del dolore è la stessa degli oppiacei (ma non migliore). Non è stato dimostrato un effetto negativo sul tasso di pleurodesi, quindi i FANS dopo la pleurodesi sono molto utili e anche raccomandati (TIME-1-RCT) [12]. Il diametro dei drenaggi toracici consigliati è ulteriormente diminuito. A causa del minor dolore, le linee guida del 2010 raccomandano drenaggi sottili (12F). Tuttavia, questi sistemi di drenaggio, che sono frequentemente utilizzati per i versamenti pleurici, non mostrano alcun vantaggio in termini di sensazione di dolore e hanno risultati più scarsi in termini di successo della pleurodesi con talco.
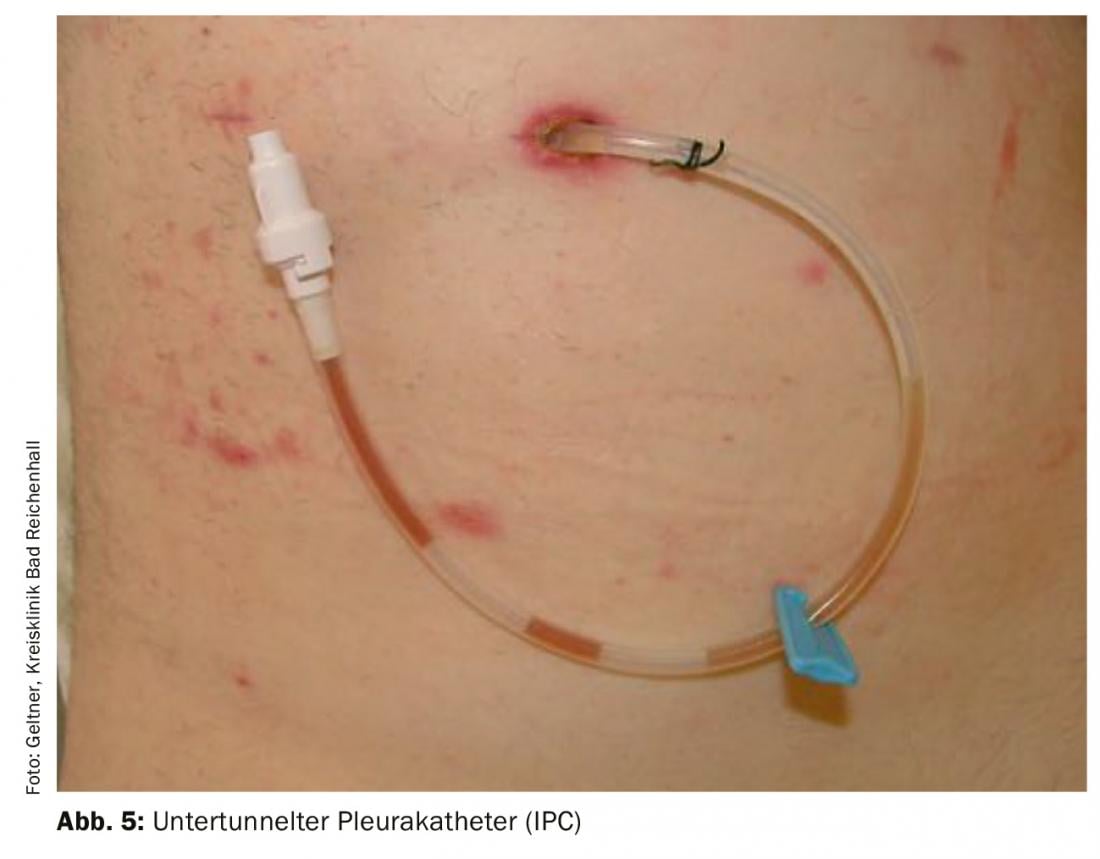
Cateteri pleurici impiantabili permanenti (IPC) [13] (Fig. 5): Gli IPC sono facili da impiantare e molto sicuri in termini di tassi di infezione e complicanze. I pazienti saranno in grado di autogestire le punture di sollievo utilizzando semplici sistemi di sollievo a vuoto. Se necessario, la pleurodesi può essere eseguita anche attraverso questi cateteri. L’impianto viene solitamente eseguito in regime ambulatoriale. La combinazione di IPC su cui viene poi applicato il talco ha aumentato di due volte il tasso di pleurodesi acuta. La pleurodesi completa si ottiene nel 45% dei casi dopo 5 settimane. Dal punto di vista odierno, l’applicazione del talco dovrebbe essere effettuata dopo la creazione di un IPC. La rimozione è quindi possibile prima in numerosi casi [14].
Toracoscopia medica minimamente invasiva: questa procedura è il metodo di scelta per eseguire la pleurodesi [15]. In anestesia locale con sedoanalgesia, la toracoscopia può essere eseguita nella maggior parte dei pazienti. Non è necessaria l’anestesia con intubazione a doppio lume. Anche in caso di malattia molto avanzata e di scarsa funzionalità polmonare o cardiaca, si può ottenere una pleurodesi sufficiente attraverso il poudrage di talco. Il tasso di successo è tra l’80-90%.
Letteratura:
- Krogel C: Immunobiologia dell’infiammazione pleurica: potenziale implicazione per la patogenesi, la diagnosi e la terapia. ERJ 1997; 10: 2411-2418
- Hott JW: Ruolo del VEGF nello sviluppo di versamenti pleurici maligni. AJRCCM 1999; A212: 159.
- Yernault JC: Storia, sintomi ed esame clinico nelle malattie della pleura. Eur Resp Monograph 2002; 22: 60-75.
- Traill ZC, Davies RJO, Gleeson FV: Tomografia computerizzata toracica in pazienti con sospetti versamenti pleurici maligni. Clin Radiol 2001; 56: 193-196.
- Giesel FL: Risonanza magnetica dinamica con contrasto del mesotelioma pleurico maligno: uno studio di fattibilità di valutazione non invasiva, follow-up terapeutico e possibile predittore di un esito migliore. Chest 2006; 129; 1570-1576.
- Hooper C, et al: Indagine su un versamento pleurico unilaterale negli adulti: linea guida della British Thoracic Society sulle malattie pleuriche 2010. BMJ Thorax 2010; 65(Suppl 2): ii4-7.
- Loddenkemper R: Valutazione prospettica dei metodi bioptici nella diagnosi di versamento pleurico maligno. Confronto intrapaziente tra citologia del liquido pleurico, agobiopsia alla cieca e toracoscopia. ARRD 1983; 127: 114.
- Astoul P: Pleurodesi per le effusioni pleuriche maligne ricorrenti: la ricerca del Santo Graal. Eur J Cardiothorac Surg 2011; 40(2): 277-279.
- Geltner C, Errhalt P: Versamento pleurico maligno: patogenesi, diagnosi e gestione. MEMO 2016, online il 19.11.2016. DOI 10.1007/s12254-015-0246-0.
- Feller-Kopman DJ, Gestione del versamento pleurico maligno. Una linea guida ufficiale di pratica clinica ATS/STS/STR. Am J Respir Crit Care Med 2018; 198(7): 839-849.
- Sorensen PG, Svendsen TL, Enk B: Trattamento del versamento pleurico maligno con drenaggio, con e senza instillazione di talco. Eur J Respir Dis 1984; 65: 131-135.
- Rahman NM: Effetto degli oppioidi rispetto ai FANS e delle dimensioni del tubo toracico più grandi rispetto a quelle più piccole sul controllo del dolore e sull’efficacia della pleurodesi nei pazienti con versamento pleurico maligno: lo studio clinico randomizzato TIME1. JAMA 2015; 314(24): 2641-2653.
- Musani AI: Opzioni di trattamento per il versamento pleurico maligno. Curr Opin Pulm Med 2009; 15: 380-387.
- Bhatnagar R: Somministrazione ambulatoriale di talco tramite catetere pleurico indwelling per l’effusione maligna. NEJM 2018; 378(14): 1313-1322.
- Tschopp JM, et al: Pleurodesi con poudrage di talco in toracoscopia medica semplice: un parere internazionale. Thorax 2009; 64(3): 273-274.
- Light RW: Versamenti parapneumonici ed empiema. Proc Am Thorac Soc 2006; 3(1): 75-80.
- Mac Duff A, Arnold A, Harvey J: Gestione dello pneumotorace spontaneo: linea guida della British Thoracic Society sulle malattie pleuriche 2010, Thorax 2010; 65: ii18-ii31.
PRATICA GP 2019; 14(9): 16-20