Una rapida consulenza interdisciplinare quando viene diagnosticata una neoplasia è imperativa e consente di “prendere decisioni informate” per le persone interessate. La protezione della fertilità non deve peggiorare la prognosi. L’omissione di informazioni può avere conseguenze sulla responsabilità. Nelle malattie benigne dello spettro ematologico, reumatologico e ginecologico, è importante considerare la riduzione della riserva ovarica. Anche con un rischio medio o piccolo di danni alle ovaie, si può prevedere una riduzione della fase di vita fertile fino a dieci anni. Dopo la terapia gonadotossica nell’infanzia, la riserva di fertilità deve essere controllata nella giovane donna. La crioconservazione degli ovociti in questo momento può consentire di realizzare il desiderio di un figlio in un momento successivo.
<Secondo il Registro Tumori tedesco, ogni anno in Germania viene diagnosticato il cancro a 1800 bambini di 1500 anni e a 30.000 adulti di 16-45 anni; in Svizzera, la cifra è di circa 250 bambini all’anno. Con un tasso di sopravvivenza dell’80% per i bambini e del 50% per tutte le fasce d’età, si tratta di migliaia di sopravvissuti sotto i 45 anni ogni anno. Se aggiungiamo le malattie benigne con terapia gonadotossica, il numero totale di persone colpite la cui fertilità è ridotta a causa di una malattia e della terapia corrispondente è molto più alto. Ora ci sono anche prove che la gravidanza dopo il cancro non peggiora la prognosi, anche nei tumori ormono-dipendenti come il carcinoma mammario. La protezione della fertilità non è quindi un argomento esotico, ma riguarda oncologi, ginecologi e medici di base [1]. L’attenzione si concentra sulla consulenza interdisciplinare tempestiva, insieme ai medici della riproduzione, per consentire alle persone interessate – anche in una situazione eccezionale di pericolo di vita – di prendere una “decisione informata”. Per ragioni di spazio, in questo articolo mi limito alla protezione della fertilità nelle donne.
Danno alla riserva ovarica
La chirurgia, la chemioterapia e la radioterapia sono i pilastri della terapia del cancro. I danni diretti causati dal tumore stesso o dalle misure chirurgiche colpiscono i tumori maligni della piccola pelvi, cioè i carcinomi del colon, delle ovaie, dell’utero e della cervice.
L’effetto gonadotossico della chemioterapia dipende dalla sostanza, dalla dose e dalla durata della terapia, nonché dall’età della paziente e dalla riserva ovarica (Tab. 1) [2]. È prevedibile un aumento del rischio di aborto o di malformazione nei primi sei mesi dopo il completamento della chemioterapia. A differenza della chemioterapia, la radioterapia colpisce le ovaie e l’utero [3].

Il 90% dei pazienti dopo l’irradiazione totale del corpo prima del trapianto di cellule staminali presenta un’insufficienza ovarica, mentre dopo l’irradiazione diretta del bacino è quasi il 100%. I danni conseguenti della radioterapia nell’infanzia sull’utero sono la fibrosi del miometrio e l’atrofia dell’endometrio, con un aumento del rischio di aborto e prematurità. La trasposizione delle ovaie al di fuori del campo di irradiazione non è priva di problemi.
Quale metodo di conservazione della fertilità può essere offerto dipende da la diagnosi oncologica e dalla finestra temporale fino all’inizio previsto della terapia (scheda 2) . La tecnica di vitrificazione degli ovociti ha migliorato in modo decisivo le possibilità di successo. Parallelamente, la crioconservazione del tessuto ovarico con trapianto è uscita dalla fase sperimentale. Per entrambe le opzioni, è importante ricordare che i pazienti affetti da tumore hanno spesso un rischio maggiore di tromboembolia, emorragia o infezione. È necessario prendere le dovute precauzioni.

Crioconservazione degli ovociti o degli zigoti
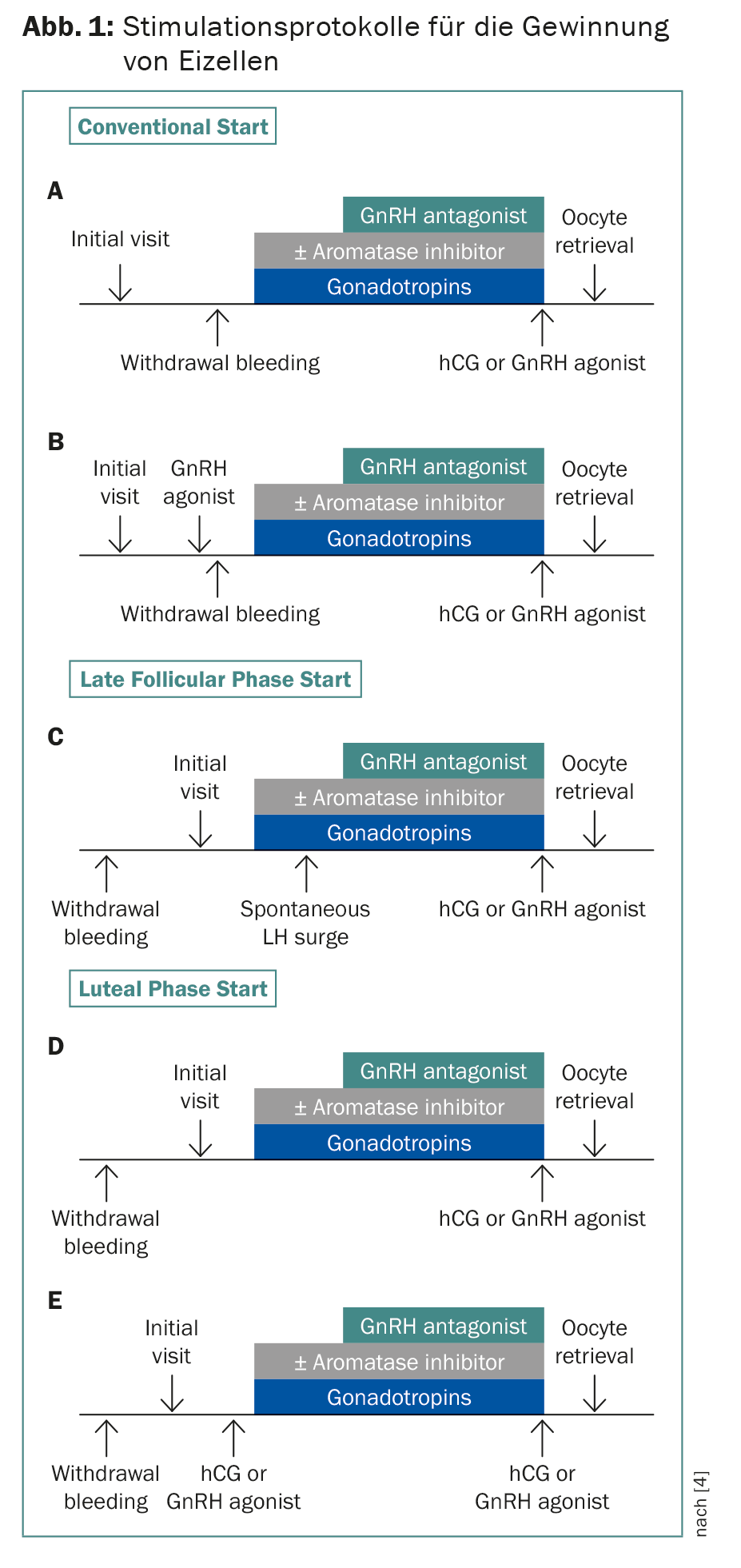
La crioconservazione di zigoti ed embrioni è stata stabilita da anni. Grazie alla tecnica di vitrificazione, oltre il 90% degli ovociti sopravvive. Poiché di solito il tempo è fondamentale, sono stati sviluppati protocolli di stimolazione che iniziano indipendentemente dall’inizio delle mestruazioni, con un ritardo di due o tre settimane per la chemioterapia (Fig. 1) . È possibile anche una doppia stimolazione, a partire dalla fase follicolare e dalla fase luteale. Ciò significa che si può ottenere il doppio delle uova in quattro settimane. Questo è significativo perché nelle pazienti di età inferiore ai 36 anni, sono necessari circa 12-14 ovociti per la successiva nascita di un bambino, e nelle pazienti di età compresa tra 37 e 39 anni, più del doppio [4]. La combinazione con letrozolo abbassa i livelli di estrogeni, il che è importante per i tumori ormono-dipendenti e per evitare la sindrome da iperstimolazione [5]. In linea di principio, consiglio la crioconservazione degli ovociti piuttosto che degli zigoti – anche in un rapporto di coppia – in modo che la donna mantenga l’autonomia riproduttiva.
Crioconservazione del tessuto ovarico
Già nel 2004, Donnez ha pubblicato un articolo su una nascita dopo un trapianto ortotopico di tessuto ovarico [6]. Nel frattempo, il metodo è uscito dalla fase sperimentale. Per via laparoscopica, viene asportata poco meno della metà di un’ovaia e viene crioconservata. In un’analisi retrospettiva della rete FertiPROTEKT, sono state registrate 21 gravidanze dopo 95 trapianti nel restovar o in una tasca peritoneale nella piccola pelvi [7]. Nel 2011, è nato il primo bambino svizzero dopo il trapianto di tessuto ovarico da parte del team del Kinderwunschzentrum Baden. Per la crioconservazione del tessuto ovarico, devono essere soddisfatte alcune condizioni (Tab. 3).

Gli analoghi del GnRh come terapia adiuvante fertiprotettiva
Lo sviluppo di farmaci ovoprotettivi è un obiettivo urgente per consentire alle pazienti di mantenere la fertilità naturale dopo la terapia citotossica. Si stanno valutando diverse sostanze, ma finora si sono affermati solo gli analoghi del GnRh. La soppressione delle gonadotropine a livelli prepuberali e la ridotta perfusione utero-ovarica sono postulati come meccanismi protettivi. Un ampio studio prospettico randomizzato ha dimostrato che il rischio di insufficienza ovarica prematura può essere ridotto del 50% [8]. I timori che la terapia con analoghi del GnRh potesse ridurre l’effetto della chemioterapia sono stati fugati. La terapia può quindi essere generosamente consigliata, anche in combinazione con altri metodi.
Protezione della fertilità prima del menarca
Oggi, più dell’80% dei bambini che sviluppano un cancro in Svizzera sopravvive. Due su tre soffrono di effetti tardivi, tra cui la sterilità. Naturalmente, il pensiero di una bambina di dieci anni che desidera avere figli in seguito è molto lontano al momento della diagnosi di cancro; si tratta solo di sopravvivere. Proprio per questo è indispensabile una consulenza interdisciplinare ai genitori e, per quanto possibile, ai bambini colpiti, in modo da non perdere nessuna decisione importante per la “vita dopo”. E’ stato pubblicato di recente il primo trapianto di successo dopo il congelamento delle ovaie nell’infanzia [9]. La crioconservazione del tessuto ovarico è quindi l’unica opzione per la protezione della fertilità nelle ragazze e nelle donne molto giovani, associata a una procedura chirurgica con rare complicazioni come infezioni ed emorragie.
Solo l’8% delle ragazze con cancro ha un rischio elevato di insufficienza ovarica post-terapeutica e quindi beneficia della crioconservazione del tessuto ovarico. Ma anche con un rischio basso o medio, si può prevedere un periodo fertile ridotto fino a dieci anni. Questo è ancora più importante perché l’avere figli viene sempre più spesso rimandato al quarto decennio. L’età media di una donna alla nascita del primo figlio in Svizzera è di 31 anni, e la tendenza è in aumento. Di conseguenza, tutte le ragazze sopravvissute in giovane età devono essere consigliate sulla loro riserva ovarica. Vengono determinati l’ormone antimulleriano e il numero di follicoli antrali. Questo è possibile anche con la contraccezione orale, i valori sono più bassi di circa il 20%. Un ciclo spontaneo normale dice poco su una fase di vita fertile ridotta. La crioconservazione degli ovuli all’inizio dei 20 anni potrebbe lasciare aperta l’opzione per la giovane donna di rimandare il desiderio di avere un figlio fino al momento desiderato – dopo la formazione o l’università.
Protezione della fertilità nei pazienti non oncologici
La protezione della fertilità è ormai consolidata nei pazienti oncologici. La situazione è diversa per le malattie benigne che vengono trattate con sostanze gonadotossiche (Tab. 4) . È anche importante sapere che le malattie autoimmuni come il lupus eritematoso di per sé possono essere associate a una ridotta riserva ovarica [10]. A differenza della situazione acuta quando viene diagnosticata una neoplasia, questi pazienti di solito hanno tempo sufficiente per una consulenza differenziata e per la crioconservazione di un numero sufficiente di ovociti o zigoti prima di iniziare la terapia.

Cosa ci riserva il futuro?
Temi come la chirurgia di preservazione degli organi per il carcinoma ovarico epiteliale in fase iniziale, i tumori sierosi borderline dell’ovaio o i tumori delle cellule staminali dell’ovaio, la terapia con progestinici locali e sistemici nella fase iniziale del carcinoma endometriale o persino il trapianto dell’utero dopo il carcinoma cervicale sono in discussione e sono già stati testati in casi individuali. La maturazione in vitro (IVM) dei gameti immaturi è ancora sperimentale [11]. Attualmente, rimangono molte domande senza risposta che devono essere chiarite attraverso studi, per poter offrire al paziente un approccio adeguato e sicuro.
Aspetti legali della protezione della fertilità
La Legge federale sulla procreazione medicalmente assistita consente espressamente la conservazione delle cellule germinali per un periodo illimitato in caso di terapia gonadotossica. Nel caso di tumori maligni, la maggior parte delle persone colpite viene informata sui metodi di conservazione della fertilità; nel caso di processi benigni, questo è piuttosto raro prima della terapia citotossica. Le cause di responsabilità vinte in caso di consulenza omessa (o non documentata) sulla crioconservazione dello sperma sono già note. Purtroppo, i costi per la protezione della fertilità non sono coperti dall’assicurazione sanitaria.
Il colloquio di consulenza
Una rapida valutazione interdisciplinare tra oncologi e specialisti della fertilità consente una consulenza differenziata delle persone colpite [12]. Si tratta di domande come il tipo e lo stadio del tumore, la terapia pianificata con una finestra temporale prima del suo inizio, il rischio di infertilità dopo la terapia oncologica, le condizioni generali della paziente, ma anche la capacità di recupero psicologico, la situazione familiare e l’ambiente sociale. La terapia medica riproduttiva non deve mai mettere a rischio la prognosi del paziente. La discussione con la paziente, eventualmente insieme al suo partner o ai genitori, viene condotta secondo una lista di controllo (scheda 5).

L’esame clinico comprende l’ecografia dell’utero e delle ovaie (patologia nella pelvi, dimensioni dell’utero e delle ovaie e numero di follicoli antrali). L’ormone antimulleriano è attualmente considerato il parametro prognostico più importante per quanto riguarda la riserva ovarica.
Oltre ai dettagli tecnici di una possibile terapia, la sessione di consulenza si concentra anche sugli aspetti emotivi [12]. Il paziente e l’intero ambiente sono sotto lo shock di una diagnosi minacciosa. Termini come pericolo di vita, paura della morte, perdita, dolore, sofferenza, lutto e rabbia sono presenti nella stanza. Parlando di conservazione della fertilità, il desiderio di avere figli più tardi, possiamo creare un contrappunto. Vogliamo dare spazio alla speranza, alla gioia e al significato della vita, ai pensieri sulla vita dopo il cancro.
Letteratura:
- von Wolff M, et al: Consulenza e trattamento di conservazione della fertilità per motivi medici: dati di una rete multinazionale di oltre 5000 donne. Reprod Biomed Online 2015 Nov; 31(5): 605-612.
- Meirow D, et al.: Tossicità della chemioterapia e delle radiazioni sulla riproduzione femminile. Clin Obstet Gynecol 2010; 53: 727-739.
- Mahajan N: Conservazione della fertilità nelle pazienti oncologiche di sesso femminile: una panoramica. J Hum Reprod Sci 2015; 8(1): 3-13.
- Cakmak H, et al: Metodo efficace per la conservazione della fertilità in emergenza: la stimolazione ovarica controllata ad avvio casuale. Fertil Steril 2013; 100: 1673-1680.
- Rodriguez-Wallberg KA, et al: Conservazione della fertilità e gravidanza in donne con e senza cancro al seno positivo alla mutazione BRCA. L’Oncologo 2012; 17: 1409-1417.
- Donnez J, et al: Parto vivo dopo trapianto ortotopico di tessuto ovarico crioconservato. Lancet 2004; 364: 1405-1414.
- Van der Ven, et al.: Novantacinque trapianti ortotopici di tessuto ovarico dopo un trattamento citotossico in una rete di fertilità – attività del tessuto, tassi di gravidanza e di parto. FertiPROTEKT 2015 (in preparazione).
- Moore HC, et al: Goserelin per la protezione delle ovaie durante la chemioterapia adiuvante del cancro al seno. N Eng J Med 2015; 372: 923-932.
- Demeestere I, et al: Parto vivo dopo autotrapianto di tessuto ovarico crioconservato durante l’infanzia. Hum Reprod 2015; 9: 2107-2109.
- Oktem O, et al: Funzione ovarica ed esiti riproduttivi delle pazienti con lupus eritematoso sistemico e strategie per preservare la loro fertilità. Obstet Gynecol Surv 2015; 70(3): 196-210.
- Tomao F, et al: Questioni speciali nella conservazione della fertilità per i tumori maligni ginecologici. Crit Rev Oncol Hematol 2016 Jan; 97: 206-219.
- Baysal Ö, et al: Il processo decisionale nella conservazione della fertilità femminile consiste nel bilanciare l’onere previsto del trattamento di conservazione della fertilità e il desiderio di concepire. Hum Reprod 2015; 7: 1625-1634.
InFo ONCOLOGIA & EMATOLOGIA 2016; 4(1): 30-33