A causa della particolare fisiopatologia e delle opzioni terapeutiche che ne possono derivare, il medico di base svolge un ruolo decisivo nella diagnosi e nella terapia del dolore neuropatico. La conoscenza essenziale della diagnostica clinica e delle apparecchiature e delle opzioni terapeutiche dovrebbe essere familiare a ogni medico. Non di rado è necessario indirizzare il paziente a esperti di neurologia o neurochirurgia, oppure a uno studio o a una clinica del dolore interdisciplinare e multimodale.
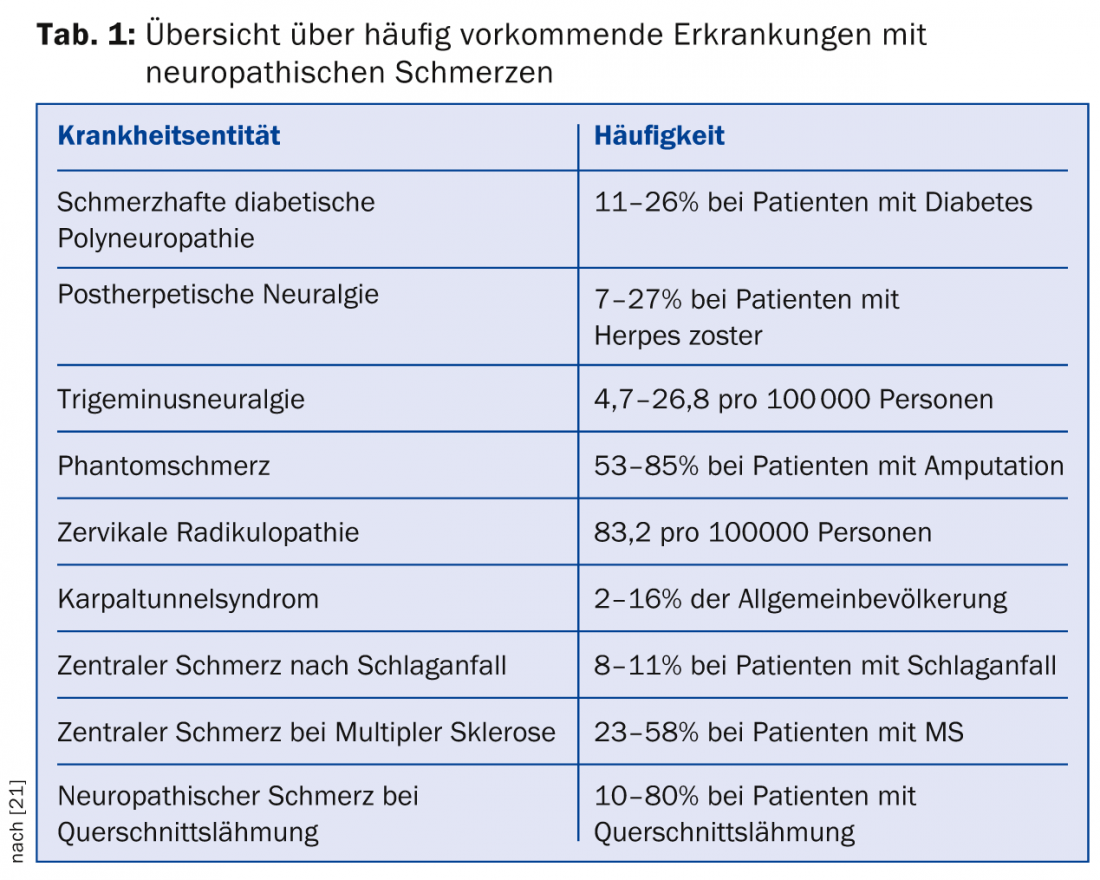
La prevalenza del dolore neuropatico nella medicina generale è di circa l’8%; questa elevata prevalenza sottolinea l’importanza del medico di base nella diagnosi e nel trattamento di questi sintomi [1]. La Tabella 1 offre una panoramica della prevalenza delle malattie comuni associate al dolore neuropatico.
Come viene definito il dolore neuropatico?
Il dolore neuropatico è definito dall’Associazione Internazionale per lo Studio del Dolore (IASP) come “dolore causato da una lesione o malattia del sistema somatosensoriale” [2]. Il sistema somatosensoriale è la parte del sistema nervoso che elabora le informazioni provenienti dai recettori cutanei, articolari e muscolari e media la percezione di qualità sensoriali come la pressione, il tatto, il dolore e la temperatura. Coinvolge i nervi afferenti periferici, le loro vie centrali di conduzione e i centri di elaborazione come il talamo e la corteccia somatosensoriale.
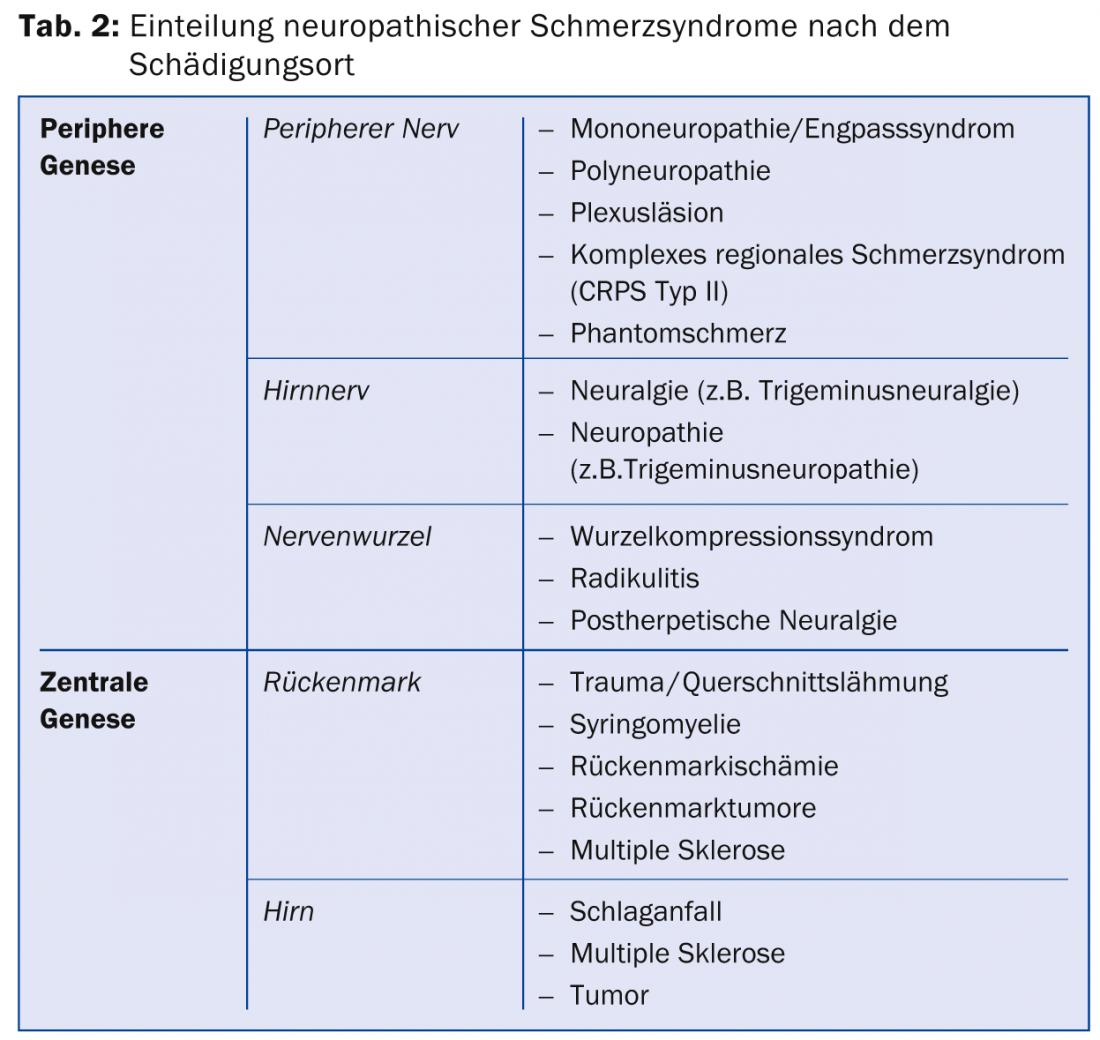
A seconda della localizzazione della lesione nervosa, ciò si traduce in alcune sindromi di dolore neuropatico (Tab. 2) . La causa può variare a seconda della malattia.
Una forma particolare è la sindrome dolorosa regionale complessa (CRPS) di tipo I, cioè senza danni ai nervi rilevabili. Secondo i nuovi criteri diagnostici sopra menzionati, non può più essere chiaramente classificato come una sindrome del dolore neuropatico, perché la localizzazione della lesione nervosa non è chiara, anche se sono presenti diverse indicazioni di fenomeni neuropatici. Pertanto, vengono applicati criteri diagnostici speciali, prendendo in considerazione le informazioni anamnestiche e i risultati clinici relativi all’allodinia, all’iperalgesia, alle anomalie della temperatura cutanea, al colore della pelle, alla sudorazione, alla formazione di edemi, alla funzione motoria, nonché alla crescita di unghie e capelli nell’area del dolore, in un confronto laterale senza una certa distribuzione dermatomica [3]. Nella CRPS di tipo II, i sintomi sono identici, ma è possibile rilevare una lesione nervosa iniziale.
Dal pato-meccanismo al dolore neuropatico
Una lesione (ad esempio, una lesione da pressione della radice nervosa a causa di un’ernia del disco) o una malattia (ad esempio, un danno alle fibre nervose a causa dell’iperglicemia nel diabete) che colpisce il sistema somatosensoriale è associata al rilascio di citochine proinfiammatorie come il TNF-α e di fattori neurotrofici come il NGF. Questo rilascio porta alla formazione di canali ionici come i canali Na+ o anche di recettori come TRPV1 o NA (noradrenalina), sia sulle cellule nervose danneggiate che su quelle sane vicine. Di conseguenza, si verificano fenomeni corrispondenti al dolore neuropatico. Ad esempio, l’accumulo di canali Na+ porta allo sviluppo della cosiddetta eccitazione nervosa ectopica spontanea, che si manifesta clinicamente con un dolore elettrizzante e lancinante, quando sono interessate le fibre C e Aδ che conducono il dolore. Nel caso di un’affezione delle fibre A-β, che mediano gli stimoli meccanici, l’eccitazione nervosa ectopica può manifestarsi solo con sensazioni di formicolio.
Il recettore TRPV1 è coinvolto nel meccanismo della sensibilizzazione periferica. Clinicamente, questa sensibilizzazione può manifestarsi con un dolore costante e bruciante o con un’iperalgesia da calore. Come risultato della costante segnalazione ectopica delle fibre C danneggiate, si verifica anche la cosiddetta sensibilizzazione centrale nel punto in cui la fibra del dolore periferico nel corno posteriore del midollo spinale viene commutata nella via del dolore centrale (midollo anteriore). I meccanismi di adattamento, come l’aumento dell’accumulo dei canali Ca++ e dei recettori NMDA, portano all’amplificazione del segnale, per esempio a una sensazione dolorosa di picchiettatura, l’iperalgesia di Prinprick, o a una sensazione dolorosa al tatto, la cosiddetta allodinia [4,5].
Diagnosi del dolore neuropatico
In ogni paziente con dolore nella pratica clinica, il modello del dolore dovrebbe essere esaminato per trovare indicazioni di meccanismi di dolore neuropatico. Secondo le linee guida europee per la diagnosi del dolore neuropatico, bisogna prestare attenzione ai seguenti punti (Tab. 3) [6].

Anamnesi: nell’anamnesi, il carattere del dolore deve essere controllato per verificare la presenza di segni neuropatici (bruciore, elettrizzazione, formicolio, costrizione). Inoltre, si esamina se la localizzazione corrisponde a una distribuzione neurologicamente plausibile (ad esempio, distribuzione dermatomica, emiparesi, distribuzione distale-simmetrica). Si deve anche ricercare una lesione (ad esempio, l’evidenza di un’ernia discale) o una malattia (ad esempio, il diabete mellito) che possa causare la sindrome del dolore neuropatico.
Esame clinico: l’esame clinico prevede la ricerca di segni sensoriali positivi o negativi per le diverse qualità somatosensoriali. L’area del dolore sospetto viene esaminata per verificare l’aumento o la diminuzione della sensazione tattile (ad esempio, con un tampone di cotone, una spazzola), l’aumento o la diminuzione della sensazione di dolore (ad esempio, con lo stimolo della puntura di spillo) o l’aumento o la diminuzione della sensazione di temperatura (ad esempio, con lo stimolo del freddo). Se c’è un’anamnesi di polineuropatia, l’esame viene effettuato confrontando la parte prossimale (coscia) con quella distale (dorso del piede) [7].
Diagnostica apparente: possono essere eseguiti ulteriori esami diagnostici per verificare la disfunzione neurologica sottostante, ad esempio la diagnostica per immagini per il sospetto di dolore dopo un ictus o il sospetto di ernia del disco o gli esami neurofisiologici per confermare una lesione nervosa (ad esempio, sospetto di radicolopatia, sindrome del tunnel carpale o polineuropatia).
Più indicazioni ci sono, più si può valutare con certezza il sospetto diagnostico di dolore neuropatico. Se la diagnosi è incerta o poco chiara, il paziente deve essere presentato a un neurologo o a un centro per il dolore. Nei centri per il dolore sono disponibili strumenti diagnostici speciali, come il test sensoriale quantitativo (QST), i potenziali evocati dal calore di contatto (CHEPS), i potenziali evocati dal laser (LEP) o la biopsia cutanea, che possono essere utilizzati, ad esempio, per esaminare la funzione delle piccole fibre nervose che conducono il dolore, come le fibre Aδ e le fibre C, e per confermare o invalidare la diagnosi di dolore neuropatico [7,8]. Gli ultrasuoni stanno diventando sempre più importanti nella ricerca di una lesione focale dei nervi periferici [9].
Importante diagnosi differenziale tra nocicettivo e neuropatico.
Inizialmente, un paziente può presentarsi con un problema circoscritto, come un dolore alla schiena e alle gambe. L’esame clinico suggerisce una radicolopatia con evidenza di ernia discale alla risonanza magnetica. Anche se la diagnosi e la terapia sembrano semplici in questo caso, la visione dovrebbe sempre andare oltre. Non è raro scoprire che il quadro clinico, che a prima vista sembra essere monosintomatico, è solo la punta di una patologia dolorosa cronica e multiloculare, per esempio se sono già state eseguite diverse operazioni alla schiena. Nel caso dei pazienti con dolore cronico, la diagnosi di dolore neuropatico con radicolopatia, che era chiara all’inizio, può quindi svolgere un ruolo subordinato, poiché si aggiungono altri aspetti biopsicosociali della cronicizzazione del dolore, come dimostra il fatto che le opzioni terapeutiche a noi note hanno scarso effetto.
I fattori biologici possono essere l’evento neurologico iniziale che, nel corso del tempo, acquisisce una componente miofasciale o nocicettiva con fattori muscolari come conseguenza della cattiva postura. I fattori psicologici sono, ad esempio, un conseguente sviluppo depressivo e concetti inadeguati di malattia, mentre i fattori sociali riflettono l’interazione del dolore nella vita professionale e privata. In questo contesto, è importante la diagnosi differenziale tra dolore nocicettivo e miofasciale. Si dovrebbe sempre tentare di elaborare la componente del dolore nocicettivo.
Le indicazioni del dolore nocicettivo sono il dolore che si intensifica o si attenua a seconda del movimento o delle variazioni dovute a un cambiamento di posizione. Di solito c’è una tensione delle strutture muscolo-scheletriche, ma non sempre c’è evidenza di patologia scheletrica sulla diagnostica per immagini. In genere, i pazienti descrivono il dolore come sordo, pressante o tirante. La descrizione del dolore bruciante deve essere messa in discussione in modo critico, poiché questa descrizione non è patognomonica per il dolore neuropatico – anche il dolore miofasciale è spesso descritto come bruciante.
Bisogna anche fare una distinzione tra il dolore a insorgenza improvvisa: Il dolore lancinante solo durante il movimento è più correlato al dolore nocicettivo, mentre il dolore neuropatico lancinante si verifica tipicamente a riposo, soprattutto la sera o la notte. Questa importante distinzione si riflette nella letteratura recente, dove ci sono diverse proposte di classificazione del dolore in diverse condizioni neurologiche, ad esempio la classificazione del dolore nell’ictus [10], nella paraplegia [11] e nella sclerosi multipla [12]. Queste classificazioni sottolineano che, anche in presenza di una malattia neurologica sottostante, il dolore non deve necessariamente essere neuropatico.
La sindrome del dolore post-chirurgico persistente (PPSP), sempre più discussa in letteratura, ha uno status particolare [13]. La PPSP, con un’incidenza del 14,8% dopo un intervento chirurgico, è fisiopatologicamente poco compresa e presenta aspetti sia nocicettivi che neuropatici [14,15]. Le sindromi a noi note, come il dolore postmastectomia, il dolore posttoracotomia, il dolore postreniotomia e altre, sono incluse qui.
Aspetti terapeutici multimodali
Se il dolore è complesso, anche le singole componenti del dolore devono essere trattate in modo specialistico, oppure il paziente deve essere indirizzato a uno studio interdisciplinare e multimodale sul dolore o a una clinica del dolore specializzata. -clinica. Nelle priorità terapeutiche, la terapia farmacologica antineuropatica, la fisioterapia e la gestione psicologica del dolore devono essere sullo stesso piano. Inoltre, la terapia interventistica del dolore può fornire un importante contributo diagnostico e terapeutico. Tuttavia, i dati attuali mostrano che l’efficacia degli interventi di medicina interventistica del dolore si basa su prove deboli [16], per cui questi interventi terapeutici dovrebbero essere eseguiti in studi o cliniche del dolore con esperienza in questo campo. Per esempio, ci sono solo deboli raccomandazioni per le iniezioni epidurali per l’herpes zoster, per le iniezioni di steroidi per la radicolopatia e per l’applicazione di uno stimolatore del midollo spinale per la cosiddetta “sindrome da intervento chirurgico fallito alla schiena” (dolore invariato alla schiena e alle gambe dopo un intervento chirurgico alla schiena), o per l’applicazione di uno stimolatore del midollo spinale in caso di “mal di schiena”. nella CRPS di tipo I. La situazione dei dati è inconcludente per una serie di procedure di terapia interventistica per vari quadri clinici [16].
I fondamenti della terapia farmacologica
I meccanismi fisiopatologici possono essere sfruttati farmacologicamente utilizzando antagonisti del Na+ (ad esempio carbamazepina, oxcarbazepina, lamotrigina), modulatori dei canali Ca++ (gabapentin, pregabalin) o anche antagonisti del TRPV1 (capsaicina) specificamente contro il dolore neuropatico. Inoltre, le vie spinali discendenti, inibitorie, che hanno origine nel tronco encefalico e inibiscono la trasmissione degli stimoli dolorosi nel midollo spinale, possono essere utilizzate terapeuticamente. I triciclici (amitriptilina) e gli inibitori della ricaptazione della serotonina e della noradrenalina (duloxetina, venlafaxina) alleviano il dolore aumentando questa inibizione. Gli oppiacei inibiscono la trasmissione dei segnali del dolore legandosi ai recettori µ o kappa, quindi possono essere utilizzati anche per trattare il dolore neuropatico. Gli oppiacei più recenti, come il tapentadolo e la buprenorfina, possono essere superiori agli oppiacei convenzionali, perché il tapentadolo ha un ulteriore effetto inibitorio discendente (legandosi ai recettori della noradrenalina) e la buprenorfina ha un’ulteriore proprietà di blocco dei canali K+. Il tramadolo inibisce anche le vie inibitorie discendenti. La lidocaina 5% in gel, che agisce come bloccante dei canali Na+, può essere applicata topicamente per le mononeuropatie dolorose circoscritte, come la nevralgia post-erpetica.
A seconda del meccanismo del dolore sottostante, devono essere prese in considerazione anche le terapie causali, per esempio il controllo ottimale della glicemia nei diabetici o gli interventi chirurgici (intervento di Janetta per la nevralgia del trigemino, decompressione per l’ernia del disco).
Gli obiettivi della terapia farmacologica sono ridurre il dolore di oltre il 50%, migliorare la qualità del sonno, mantenere l’attività sociale e le relazioni sociali e mantenere la capacità di lavorare. Ciò richiede una titolazione dei farmaci antineuropatici, tenendo conto dell’effetto e dell’effetto collaterale, con una durata di terapia sufficiente e una dose sufficientemente elevata. Spesso sono necessarie anche terapie combinate di diversi gruppi di farmaci.
Terapia farmacologica del dolore neuropatico generato a livello periferico e centrale
Le attuali linee guida svizzere per il trattamento del dolore neuropatico [7] sono in linea con le linee guida internazionali [17,18]. Per la terapia generale del dolore neuropatico generato perifericamente, sono disponibili come agenti terapeutici di prima linea i triciclici, i modulatori dei canali del calcio e gli inibitori selettivi della ricaptazione della serotonina e della noradrenalina (SNRI) ( tab. 4) [17]. Gli oppiacei possono essere utilizzati come farmaci di seconda linea. In termini di efficacia, gli oppiacei non differiscono dai farmaci di prima linea, ma presentano un tasso più elevato di effetti collaterali rispetto ai triciclici e al gabapentin, e c’è il rischio di una possibile iperalgesia indotta dagli oppiacei o dello sviluppo di una dipendenza da essi.
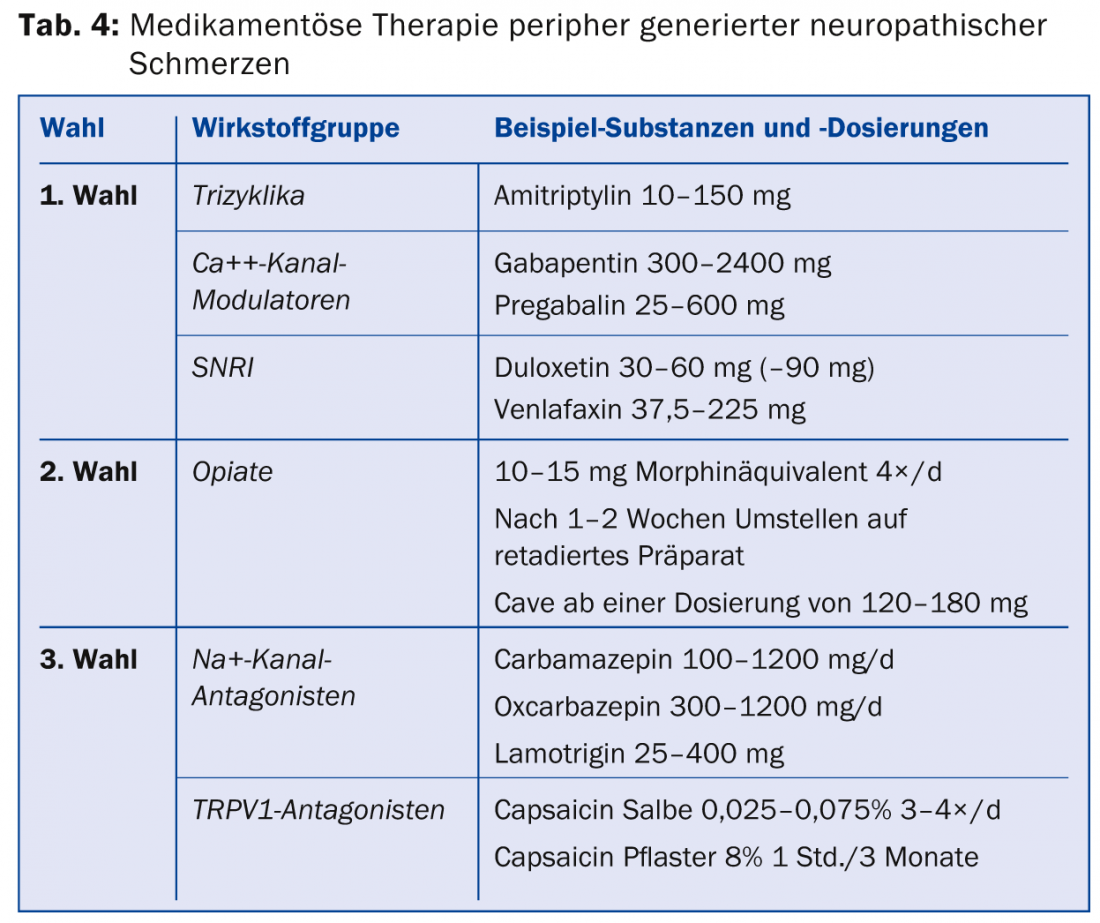
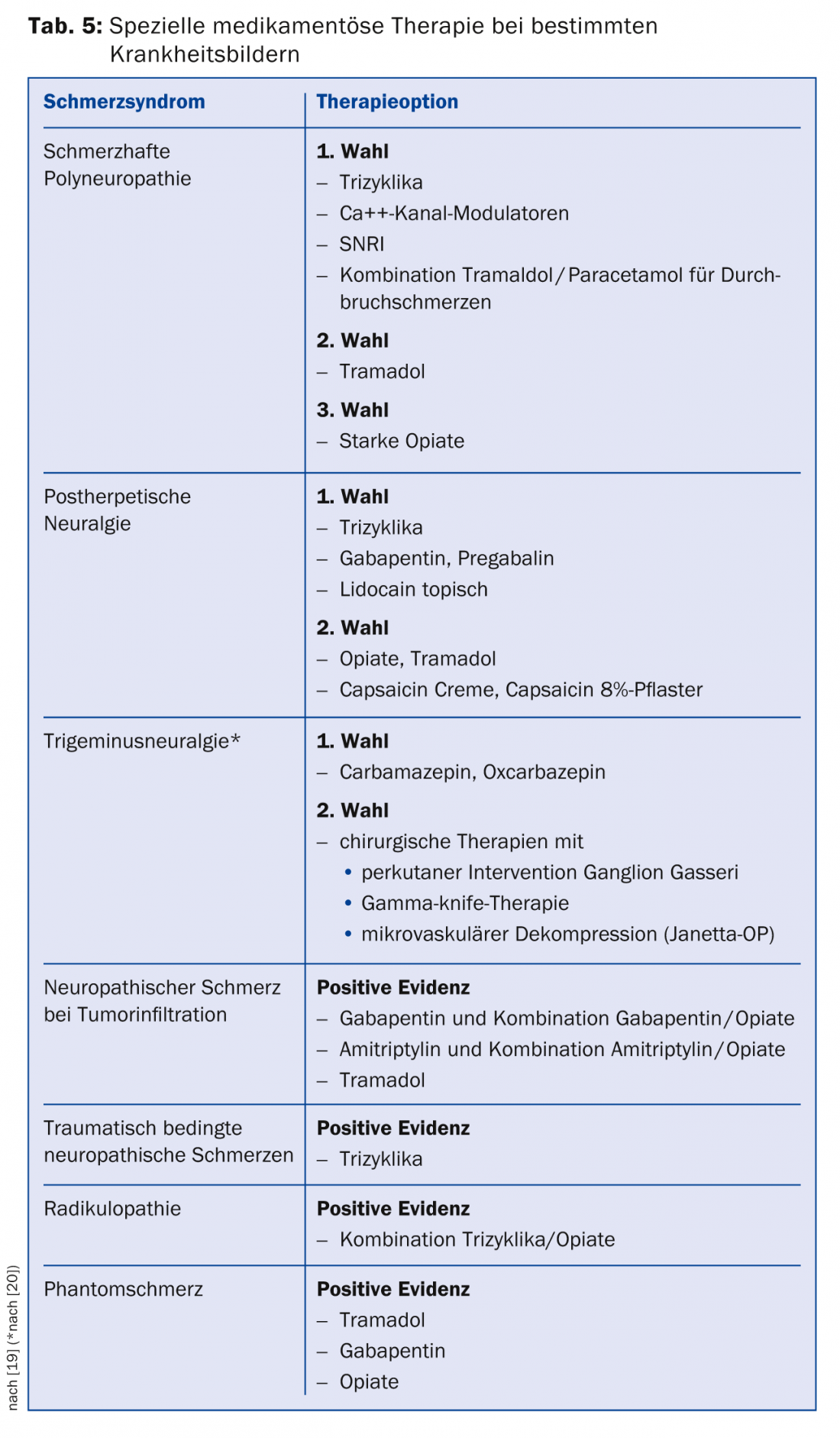
Se il dolore non può essere alleviato in modo sufficiente con questi farmaci, sono disponibili terapie di terza scelta per le quali è disponibile solo uno studio positivo o la situazione dei dati è incoerente. I rappresentanti di questa classe sono gli antagonisti del canale Na+, gli inibitori selettivi della ricaptazione della serotonina (SSRI), gli analoghi della lidocaina e anche la capsaicina. In Svizzera, la capsaicina (cerotto all’8%) è approvata per il trattamento del dolore neuropatico periferico negli adulti che non hanno il diabete. Per essere rimborsati dalla cassa malattia, di solito è necessario presentare una richiesta di approvazione dei costi. La capsaicina dovrebbe essere applicata nelle pratiche del dolore. Esistono raccomandazioni speciali per i singoli quadri clinici (Tab. 5) [19].
Per il trattamento del dolore neuropatico generato a livello centrale, le opzioni sono più limitate [8]. I farmaci di prima linea sono i triciclici per il dolore post-ictus e i modulatori dei canali del Ca++ per il dolore post-lesione del midollo spinale. I farmaci di seconda linea sono il tramadolo e gli oppiacei forti, nonché la lamotrigina per l’ictus e la paraplegia incompleta con allodinia, e i cannabinoidi per la sclerosi multipla, ma solo dopo il fallimento di altre terapie (tab. 6).

Se questi farmaci non sono efficaci o ci sono controindicazioni, si può ricorrere a farmaci di prima e seconda scelta per il dolore neuropatico generato perifericamente.
Conclusione per la pratica
- Per la diagnosi clinica del dolore neuropatico, è importante la conoscenza dei segni sensoriali positivi e negativi.
- Il sospetto di diagnosi di dolore neuropatico dovrebbe essere già formulato nello studio del medico di famiglia.
- Per confermare la diagnosi, spesso è indicato un chiarimento neurologico e, nei casi poco chiari o resistenti alla terapia, il rinvio a uno studio o a una clinica interdisciplinare del dolore.
- La diagnosi differenziale tra dolore nocicettivo e neuropatico svolge un ruolo importante anche nelle malattie neurologiche primarie.
- Il trattamento del dolore neuropatico richiede spesso un team interdisciplinare e multimodale.
- I triciclici, gli SNRI e i modulatori dei canali Ca++ sono disponibili per la terapia di prima linea del dolore neuropatico generato perifericamente.
- Per il trattamento del dolore neuropatico generato a livello centrale, le opzioni di prima linea sono i triciclici e i modulatori dei canali Ca++.
- Sebbene le prove per la gestione interventistica del dolore siano limitate, possono supportare la gestione diagnostica e terapeutica dei pazienti con dolore.
Letteratura:
- Torrance N, et al: L’epidemiologia del dolore cronico di origine prevalentemente neuropatica. Risultati di un sondaggio sulla popolazione generale. The journal of pain: official journal of the American Pain Society 2006; 7(4): 281-289.
- Treede RD, et al: Dolore neuropatico: ridefinizione e sistema di classificazione per scopi clinici e di ricerca. Neurologia 2008; 70(18): 1630-1635.
- Harden RN: Proposta di nuovi criteri diagnostici per la sindrome dolorosa complessa di Reghilan. Medicina del dolore 2007; 8(4): 326-331.
- Baron R: Dolore neuropatico. Anestesista 2000; 49: 373-386.
- Baron R, Freynhagen R: Compendio del dolore neuropatico. Seconda edizione, Casa editrice Aesopus, 2006.
- Cruccu G, et al: Linee guida EFNS sulla valutazione del dolore neuropatico: revisione 2009. Eur J Neurol 2010; 17(8): 1010-1018.
- Renaud R, et al: Dolore neuropatico cronico Raccomandazioni del Gruppo di interesse speciale (SIG) della Società svizzera per lo studio del dolore (SGSS). Swiss Medical Forum 2011; 11(Suppl. 57): 3-19.
- Gosrau G, et al: Metodi di misurazione elettrofisiologica nella terapia del dolore. Dolore 2008; 22: 471-481.
- Böhm J, Schelle T: Importanza della sonografia ad alta risoluzione nella diagnosi delle malattie dei nervi periferici. Neurol Akt 2013; 40(05): 258-268.
- Klit H, et al: Dolore centrale post-ictus: caratteristiche cliniche, fisiopatologia e gestione. Lancet Neurol 2009; 8(9): 857-868.
- Bryce TN, et al: Classificazione internazionale del dolore da lesione midollare: parte I. Background e descrizione. Midollo spinale 2012; 50(6): 413-417.
- Truini A, et al: Meccanismi del dolore nella sclerosi multipla: uno studio combinato clinico e neurofisiologico. Dolore 2012; 153(10): 2048-2054.
- Werner MU, Kongsgaard UE. Definire il dolore persistente post-chirurgico: è necessario un aggiornamento? Br J Anaesth 2014; 113(1): 1-4.
- Simanski CJ, et al: Incidenza del dolore cronico post-chirurgico (CPSP) dopo la chirurgia generale. Medicina del dolore (Malden, Mass) 2014; 15(7): 1222-1229.
- Haroutiunian S, et al: La componente neuropatica nel dolore post-chirurgico persistente: una revisione sistematica della letteratura. Dolore 2013; 154(1): 95-102.
- Dworkin RH, et al: Gestione interventistica del dolore neuropatico: raccomandazioni NeuPSIG. Dolore 2013; 154(11): 2249-2261.
- Dworkin RH, et al: Gestione farmacologica del dolore neuropatico: raccomandazioni basate sull’evidenza. Dolore 2007; 132(3): 237-251.
- O’Connor AB, Dworkin RH: Trattamento del dolore neuropatico: una panoramica delle recenti linee guida. Am J Med 2009; 122(10 Suppl): S22-32.
- Attal N, et al: Linee guida EFNS sul trattamento farmacologico del dolore neuropatico: revisione 2010. Eur J Neurol 2010; 17(9): 1113-1188.
- Cruccu G, et al: Linee guida AAN-EFNS sulla gestione della nevralgia del trigemino. Eur J Neurol 2008; 15(10): 1013-1028.
- Sadosky A, et al: Una revisione dell’epidemiologia della neuropatia periferica diabetica dolorosa, della nevralgia post-erpetica e delle condizioni di dolore neuropatico meno comunemente studiate. Pain practice: the official journal of World Institute of Pain 2008; 8(1): 45-56.
PRATICA GP 2015; 10(1): 14-21











