Le classiche neoplasie mieloproliferative (MPN) comprendono la policitemia vera, la trombocitemia essenziale e la mielofibrosi primaria. Diverse sessioni del Congresso EHA di metà giugno hanno affrontato la revisione delle linee guida, le novità sull’inibizione della JAK e l’impatto prognostico delle mutazioni driver.
(ag) Ruben Mesa, MD, Arizona, ha parlato dell’attuale diagnosi di policitemia vera (PV): “Si tratta di una malattia eterogenea delle cellule staminali, associata principalmente a un aumento dei globuli rossi. Di conseguenza, possono verificarsi eventi tromboembolici. Esiste il rischio di transizione verso la mielofibrosi o la leucemia acuta. La revisione dei criteri diagnostici dell’OMS proposta quest’anno [1] comprende tre criteri cosiddetti maggiori e uno minore. Per una diagnosi di PV, devono essere soddisfatti tutti e tre o i primi due criteri principali più uno minore”.
I criteri principali includono
- I valori di emoglobina di >16,5 g/dl (uomini) e di
- >16 g/dl (donne) o un ematocrito di > 49% (uomini) e > 48% (donne)
- Risultati del midollo osseo coerenti con i criteri dell’OMS con megacariociti pleomorfi.
- Presenza di una mutazione JAK2.
Il criterio minore elencato nella revisione è il livello di eritropoietina sierica subnormale. “Quindi i criteri diagnostici per la FV sono in fase di sviluppo. Si propone di abbassare la soglia dell’emoglobina e di aggiungere l’ematocrito come criterio principale. In definitiva, questo porterà alla semplificazione. Tuttavia, è necessaria una biopsia del midollo osseo”, ha concluso Mesa.
“PV “Masked
L’influenza della morfologia del midollo osseo come strumento diagnostico è discussa anche nella revisione delle linee guida dell’OMS per la cosiddetta FV “mascherata”, in quanto consente un’elevata riproducibilità della diagnosi anche nei casi che non raggiungono le precedenti soglie di emoglobina ed ematocrito. Questo è significativo perché la sopravvivenza complessiva nei pazienti con PV “mascherata” sembra essere peggiore rispetto a quella dei pazienti con PV manifesta (se si includono i fattori di rischio indipendenti di età > 65 anni e conta leucocitaria >15× 109 / l). Senza questi due fattori di rischio, i tassi di sopravvivenza dei due gruppi sono comparabili, il che, secondo gli autori, indica che alcuni dei pazienti che sono al di sotto delle soglie precedentemente richieste dalle linee guida dell’OMS dovrebbero essere considerati come pazienti con PV apparente [2,3].
Prognosi e sopravvivenza nell’MPN
Quali sono le mutazioni nella mielofibrosi primaria (PMF) e nella PV? Questa domanda è stata posta dal Prof. Alessandro Vannucchi, Firenze. Nella PV, circa il 95% delle mutazioni driver fenotipiche appartengono al tipo JAK2-V617F e il 4% al tipo JAK2-Exon12. Nella PMF, ci sono circa il 60% di mutazioni JAK2-V617F, il 20% di CALR, l’8% di MPL-W515 e il 10% di mutazioni cosiddette “triple negative”.
Secondo il Prof. Vannucchi, la prognosi nella PMF è influenzata da queste mutazioni driver fenotipiche, in quanto le mutazioni CALR mostrano un esito di sopravvivenza migliore rispetto alle mutazioni JAK2, MPL e “triple negative”.
Haifa Kathrin Al-Ali, MD, Lipsia, ha approfondito la prognosi e la sopravvivenza nei casi di MPN: “È chiaro che la mielofibrosi ha la peggiore sopravvivenza di tutte le MPN: Mentre secondo uno studio svedese [4] i pazienti con trombocitemia essenziale (ET) mostrano una sopravvivenza a 10 anni ridotta del 17% rispetto alla popolazione normale, i pazienti affetti da FV mostrano una sopravvivenza peggiorata del 28% e quelli con PMF dell’81%. Per valutare il rischio di morte e trombosi nella MPN, sono disponibili diversi strumenti prognostici, come le cosiddette scale Lille, IPSS, DIPSS e DIPSS Plus”.
Per quanto riguarda la mielofibrosi, esiste solo un’opzione terapeutica curativa: il trapianto allogenico di cellule staminali ematopoietiche. Tuttavia, l’esito dopo il trapianto dipende dalla classificazione iniziale sulla scala DIPSS [5].
I due studi COMFORT hanno anche dimostrato che ruxolitinib ha migliorato la sopravvivenza a lungo termine nei pazienti con MF (rispetto al placebo [6] e alla migliore terapia disponibile [7,8]). Secondo studi esplorativi, l’uso di questo agente per cinque anni potrebbe ritardare o addirittura invertire la fibrosi del midollo osseo (sempre rispetto alla migliore terapia disponibile) [9]. “È possibile, quindi, che l’inibizione sostenuta di JAK1&2 modifichi la malattia”, ha suggerito il dottor Al-Ali.
Nel campo della FV, i pazienti resistenti all’idrossiurea sono particolarmente colpiti da un’elevata mortalità. Gli studi parlano di un rischio di morte 5,6 volte superiore rispetto alla popolazione non resistente. Secondo il dottor Al-Ali, sono urgentemente necessarie nuove opzioni terapeutiche: “Il ruolo di ruxolitinib è stato testato nello studio RESPONSE. I risultati sono incoraggianti in termini di endpoint primario (controllo della conta dei globuli rossi e riduzione del volume della milza) e anche in termini di minor carico di sintomi rispetto alla migliore terapia disponibile [10].”
Cosa c’è dopo?
Claire Harrison, MD, Londra, ha descritto la diagnosi accurata come la pietra angolare delle terapie attualmente possibili per l’MPN: “In linea di principio, l’aspirina a basso dosaggio mostra buone evidenze solo nell’ambito della PV, ma non per la PMF e l’ET. Tuttavia, viene utilizzato anche come standard nell’ET (tranne che nei pazienti ad alto rischio). Qui è urgente consolidare la situazione dello studio”. Inoltre, tutti i fattori di rischio vascolare reversibili devono essere affrontati in modo aggressivo. Smettere di fumare è fondamentale.
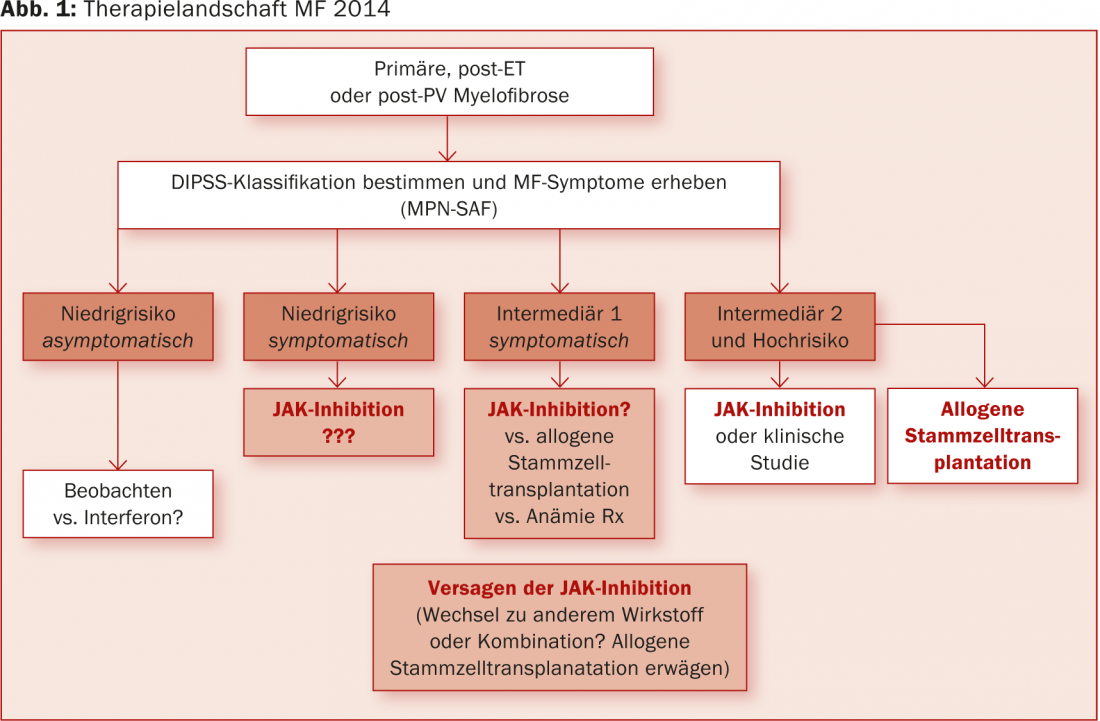
“Gli inibitori della JAK stanno cambiando radicalmente il panorama terapeutico della MF. Sta emergendo un vantaggio di sopravvivenza a lungo termine rispetto alla migliore terapia disponibile (aggiornamento a 3,5 anni al Congresso EHA 2014 [8]). Tuttavia, è necessario prima esaminare attentamente se in futuro possano essere considerati anche come agenti terapeutici nei pazienti con un rischio inferiore (Fig. 1)“.
Il Dr. Harrison ha anche affrontato la possibilità di modificare la malattia attraverso l’uso di ruxolitinib: “Tra l’altro, ha sollevato il sopracciglio un caso [11] in cui è stata osservata una risoluzione completa della fibrosi del midollo osseo in un paziente con MF (post-PV) dopo tre anni di inibizione di JAK1&2”.
Fonte: Congresso EHA 2014, 12-15 giugno 2014, Milano
Letteratura:
- Barbui T, et al: Ripensare i criteri diagnostici della policitemia vera. Leucemia 2014 Jun; 28(6): 1191-1195.
- Barbui T, et al: Policitemia vera mascherata diagnosticata secondo la classificazione OMS e BCSH. Am J Hematol 2014 Feb; 89(2): 199-202.
- Barbui T, et al: Policitemia vera mascherata (mPV): risultati di uno studio internazionale. Am J Hematol 2014 Jan; 89(1): 52-54.
- Hultcrantz M, et al: Modelli di sopravvivenza tra i pazienti con neoplasie mieloproliferative diagnosticate in Svezia dal 1973 al 2008: uno studio basato sulla popolazione. J Clin Oncol 2012 Aug 20; 30(24): 2995-3001.
- Scott BL, et al: Il Dynamic International Prognostic Scoring System per la mielofibrosi predice gli esiti dopo il trapianto di cellule ematopoietiche. Sangue 2012 Mar 15; 119(11): 2657-2664.
- Verstovsek S, et al.: Esiti a lungo termine della terapia con Ruxolitinib nei pazienti con mielofibrosi: aggiornamento a 3 anni da COMFORT-I. Sangue 2013; 122(21): 396.
- Cervantes F, et al: Risultati di efficacia, sicurezza e sopravvivenza a tre anni di COMFORT-II, uno studio di fase 3 che confronta ruxolitinib con la migliore terapia disponibile per la mielofibrosi. Sangue 2013 Dic 12; 122(25): 4047-4053.
- Harrison C, et al: Risultati di un aggiornamento di 3,5 anni di COMFORT-II, uno studio di fase 3 che confronta ruxolitinib (rux) con la migliore terapia disponibile (bat) per il trattamento della mielofibrosi. EHA 2014 #Abstract P403.
- Kvasnicka HM, et al: Effetti di cinque anni di terapia con Ruxolitinib sulla morfologia del midollo osseo in pazienti con mielofibrosi e confronto con la migliore terapia disponibile. Sangue 2013; 122(21): 4055.
- Vannucchi A: Ruxolitinib si dimostra superiore alla migliore terapia disponibile in uno studio prospettico, randomizzato, di fase 3 (risposta) in pazienti con policitemia vera resistenti o intolleranti all’idrossiurea. EHA 2014 #Abstract LB2436.
- Wilkins BS, et al: Risoluzione della fibrosi del midollo osseo in un paziente in trattamento con inibitore JAK1/JAK2 con ruxolitinib. Haematologica 2013 Dic; 98(12): 1872-1876.
SPECIALE KONRESS 2014; 2(5): 43-44